抗坏血酸对钴纳米粒子及钴离子致成纤维细胞毒性的保护作用
2018-03-06洪鸿翔刘雅克杨晓佑吴雪飞崔志明
洪鸿翔,朱 海,刘雅克,杨晓佑,吴雪飞,崔志明△,刘 璠
(1.江苏省南通市第一人民医院骨科 226001;2.南通大学附属医院骨科,江苏南通 226001)
随着金属对金属(metal-on-metal,MoM)髋关节置换术的普及,其不良反应渐渐引起人们的高度重视,如局部软组织反应及炎性假瘤等[1]。由钴铬合金制成的MoM髋关节置换植入物在体内会释放大量的金属纳米粒子及金属离子[2]。钴纳米粒子(cobalt nanoparticles,CoNPs)是植入物降解产物的重要组成部分[3]。因此,钴(CO)可能是导致MoM髋关节置换术中不良反应的主要原因。体外实验已经证明,CO2+可以导致氧化损伤、DNA损伤、炎症反应及有遗传毒性作用[4]。有报道称在体外实验中碳化钨-钴(WC-CO)微粒可以诱导细胞凋亡[5]。通过测定谷胱甘肽(GSH)水平的变化,可以发现与微粒相比,WC-CoNPs可以产生更高水平的活性氧(ROS),从而产生更强烈的氧化应激反应。进一步研究表明,在JB6细胞上,过氧化氢酶可以消除大量ROS,抑制WC-CoNPs诱导的线粒体膜通透性损伤[6]。抗坏血酸(ascorbic acid,AA)是一种常用的抗氧化剂,现已证实增加生理水平的AA可以抑制细胞内ROS水平[7]。本实验旨在探讨CoNPs和Co2+对成纤维细胞的毒性作用机制,并使用AA降低CoNPs和Co2+所致的毒性反应。
1 材料与方法
1.1材料 Balb/3T3细胞购自中国科学院上海生命科学研究院。CoNPs,氯化钴(COC1-2)和AA购于Sigma公司。抗体:细胞凋亡诱导因子(AIF),Bcl-2、 Bax、Caspase 3、血红素加氧酶1(HO-1)、β-actin购于美国Cell Signaling Technology公司,兔抗及鼠抗购自Sigma公司。Trizol总RNA提取试剂、逆转录试剂盒及PCR试剂盒购于Invitrogen公司,PCR引物购自Sigma公司,EDTA-Na2购于Life Sciences公司,细胞色素C试剂盒购自上海研谨生物科技公司,GSH检测试剂盒来自碧云天,CCK8试剂盒来自日本同仁化学研究所。
1.2方法 将Balb/3T3细胞平均适量接种到96孔板中培养,每孔约100 μL。分别加入100 μL含有不同浓度药液的培养基,分别处理12、24、48 h。加入CCK8试剂,酶标仪450 nm波长测量。将细胞平均适量接种到6孔板中,分为如下6个组:对照组、Co2+组、Co2++AA组、CoNPs组、CoNPs+AA组、AA组。其中,加入H2O2的对照组为阳性对照组。首先用50 μmol/L AA提前预处理1 h,然后用50 μmol/L CoNPs和50 μmol/L Co2+分别再处理24 h。分别用CCK8检测CoNPs、Co2+诱导及AA处理后的细胞毒性,使用细胞色素C试剂盒检测从线粒体释放到细胞质中细胞色素C的水平。采用荧光染色技术检测线粒体中ROS生成,Western blot技术检测相关蛋白表达,实时定量PCR技术检测mRNA水平的变化。所有检测重复3次。

A、B、C:细胞分别被不同浓度Co2+和CoNPs处理4、24、48 h;D:各组细胞活性比较;1:对照组,2:CO2+组,3:CO2++AA组,4:CoNP组,5:CoNPs+AA组,6:AA组;a:P<0.05,与CoNPS组比较;b:P<0.05,与对照组比较
图1 AA对Co2+和CoNPs处理过的Balb/3T3细胞的作用

2 结 果
2.1AA对细胞的保护作用 CoNPs和Co2+对细胞的毒性作用随时间延长而增加,随剂量加大而增加,具有时间和剂量依赖性,见图1A、B、C。CoNPs诱导的毒性作用明显强于Co2+。CoNPs和Co2+处理24 h后,其IC50值约为50 μmol/L。与CoNPs组比较,使用AA预处理可以明显提高细胞的存活率,差异有统计学意义(P<0.05);而AA预处理对Co2+处理的细胞存活率无明显影响(图1D)。
2.2AA对细胞内ROS及HO-1生成的影响 结果显示,CoNPs处理24 h可以明显增加ROS的表达(P<0.05);而使用AA预处理可以明显减少CoNPs诱导的ROS生成(P<0.05);Co2+可以轻微地增加ROS的水平,AA只轻微降低Co2+诱导的ROS水平(图2A)。CoNPs可以明显诱导HO-1的表达,差异有统计学意义(P<0.01);使用AA预处理,可以明显减少由CoNPs诱导的HO-1的表达(P<0.05);而Co2+对HO-1表达无影响,见图2B。
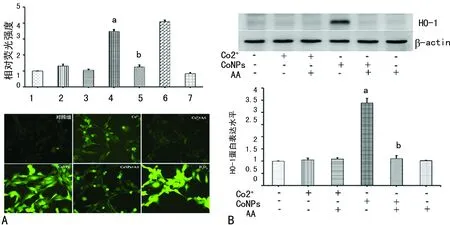
A:AA对细胞内ROS的影响;1:对照组;2:CO2+组;3:CO2++AA组;4:CONPS组;5:CONPS+AA组;6:H2O2处理阳性对照组;7:AA组;B:AA对细胞内HO-1的影响,a:P<0.05,与对照组比较,b:P<0.05,与CoNPs组比较
图2 AA对细胞内ROS及HO-1生成的影响
2.3AA对细胞内GSH生成及细胞色素C释放的影响 CoNPs处理可以明显减少GSH水平;AA预处理可以使CoNPs组GSH降低减弱(P<0.05);而Co2+对GSH几乎无影响(图3A)。CoNPs和Co2+都可诱导细胞色素C从线粒体释放进入细胞质中(P<0.05);AA预处理可以抑制CoNPs诱导的细胞色素C的释放(P<0.05);而AA对Co2+无明显作用,见图3B。
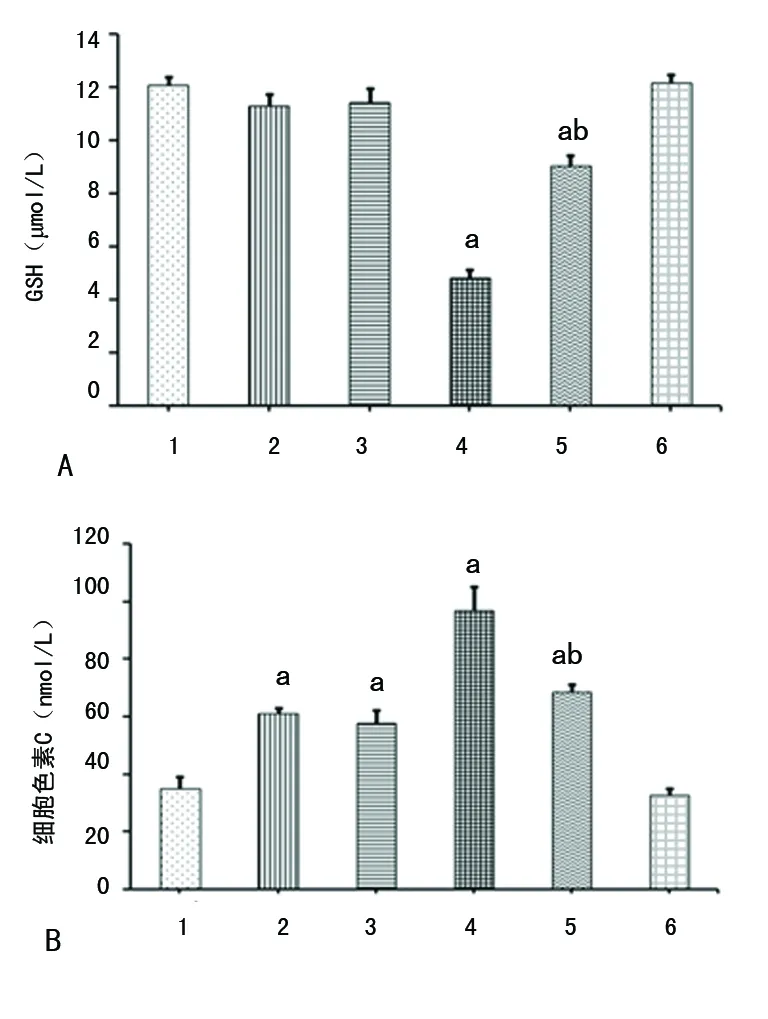
A:AA对细胞内GSH的影响;B:AA对细胞内细胞色素C的影响;1:对照组;2:CO2+组;3:CO2++AA组;4:CONPS组;5:CONPS+AA组;6:AA组;a:P<0.05,与对照组比较;b:P<0.05,与CoNPs组比较
图3 AA对细胞内GSH生成及细胞色素C释放的影响
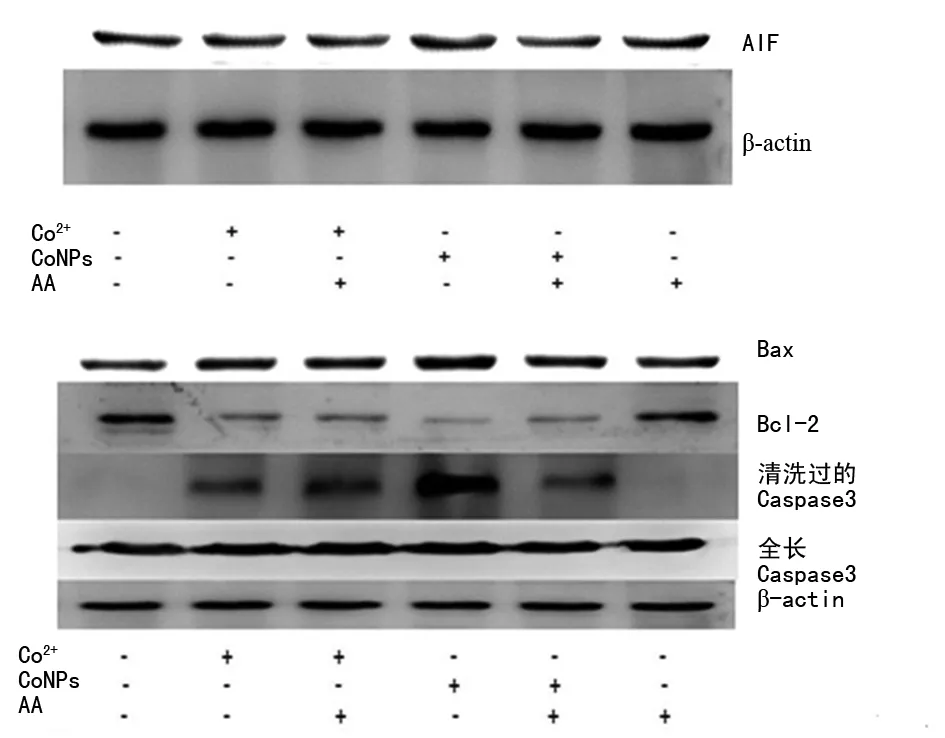
图4 Westem blot检测细胞内AIF、Bax等蛋白表达
2.4AA对细胞内Bax、Bcl-2及AIF、Caspases 3蛋白表达的影响 CoNPs和Co2+可明显抑制抗凋亡因子Bcl-2表达,其中CoNPs的抑制作用更明显;使用AA预处理可抑制CoNPs对Bcl-2作用,但对Co2+的抑制作用无明显影响。CoNPs和Co2+明显诱导促凋亡因子Bax表达,且CoNPs的诱导作用更明显;使用AA预处理后可降低CoNPs的诱导作用,但对Co2+无明显影响。CoNPs和Co2+可明显激活促凋亡Caspase家族表达,使其高表达,CoNPs的诱导作用更明显;使用AA预处理可降低CoNPs的诱导作用,但是对Co2+的诱导作用无明显影响。CoNPs可明显诱导AIF表达;使用AA预处理可以明显减少AIF的表达;Co2+对AIF的表达无明显的影响,见图4。
3 讨 论
随着MoM关节置换术应用越来越多,由假体释放的金属纳米粒子已成为潜在的健康威胁[1]。有报道称MoM髋关节假体会导致患者不明原因的疼痛[8],血液中金属离子浓度超标以及早期二次翻修率增高[9]。对假体组织检测发现,金属磨损物大多以CoCr纳米粒子形式存在,且Co可能是不良反应的主要原因[10]。
氧化应激是纳米粒子毒性作用的重要机制之一,且细胞内ROS是评价纳米粒子各种毒性作用的常用关键指标[11]。GSH是一种重要的抗氧化剂,在保护细胞对抗凋亡过程中发挥重要作用,GSH的损耗可以促进细胞内ROS堆积及HO-1表达,导致细胞凋亡[12]。HO-1水平是衡量氧化应激水平的代表性指标[13]。通过荧光染色测量ROS发现,CoNPs使细胞中自由基表达更高,GSH水平下降,HO-1表达增加,导致更严重的氧化应激反应。抗氧化剂AA是GSH的前体,可以抑制ROS生成,可部分缓解CoNPs诱导的细胞各项指标变化,减少细胞死亡,然而AA对Co2+引起的细胞指标变化无作用。这表明由CoNPs诱导的细胞死亡和ROS生成有关,AA能减少CoNPs诱导的死亡可能是通过减少了ROS的生成,而Co2+无明显诱导ROS生成的作用。
有研究测量暴露于CO2+细胞胞内AA水平,结果显示其水平降低,且在人巨噬细胞暴露于CoNPs时,在细胞中补充或维持AA水平能明显提高细胞活性[7]。据报道,当金属离子暴露于人支气管上皮细胞(HAEo)中,额外补充生理水平的AA(100 μmol/L)可以恢复细胞内AA盐水平,转化为类似于初始气管基部内皮细胞,也能在内皮细胞中预防CO2+毒性[14]。AA盐可抑制氧化应激相关的HO-1生成,同时降低涉及凋亡的Caspase家族活性[15]。这更进一步表明了AA的保护作用与ROS生成减少有密切的联系。
已有研究表明CoNPs和Co2+都可以诱导细胞凋亡[16],但其具体分子机制仍然不是很明确。哺乳动物细胞可以通过两条信号级联反应实现凋亡:内源性途径和外源性途径。Caspase属于半胱氨酸蛋白酶家族,在细胞凋亡、坏死和炎症中扮演必不可少的角色。本研究中,CoNPs和Co2+都激活了Caspase 3,并且CoNPs的效应高于Co2+,这表明CoNPs和Co2+诱导的细胞凋亡可能通过外源性信号转导途径。内源性凋亡途径主要通过氧化应激和其他因子损伤线粒体,导致细胞色素C和AIF从线粒体释放入细胞质激活内源性凋亡途径[17]。AIF直接靶向于DNA破碎和染色质凝结,是Caspase非依赖性凋亡途径[18],而细胞色素C以一种Caspase依赖性途径诱导细胞凋亡[19]。本研究发现CoNPs和Co2+都可以诱导细胞色素C和AIF从线粒体释放入细胞质。结果表明CoNPs和Co2+激活了细胞内源性凋亡途径。因此,CoNPs和Co2+可以同时激活内源性和外源性凋亡途径。
线粒体介导的内源性凋亡途径受Bcl-2家族调控。Bcl-2家族蛋白通过调控促凋亡蛋白和抗凋亡蛋白之间的平衡调控细胞生存或死亡[20]。在本研究中,CoNPs和Co2+都可以增加促凋亡因子Bax生成,减少抗凋亡因子Bcl-2生成,但是CoNPs的作用强于Co2+。
与Co2+相比,CoNPs导致更大幅度的GSH减少、HO-1增加和ROS高表达,而Co2+基本未改变这些指标。这表明Co2+并未导致高浓度的ROS生成。尽管以往研究表明Co2+也会产生ROS,这个矛盾的结论可能是因为Co2+浓度不同、时间点不同及CO盐的纯度不同而造成[7]。在实验中,尽管AA可以部分减少CoNPs的细胞毒性,但是它不能完全逆转CoNPs诱导的细胞凋亡,提示CoNPs可能也通过其他非依赖ROS的凋亡途径诱导细胞凋亡,这将有待进一步研究。
[1]GILL H S,GRAMMATOPOULOS G,ADSHEAD S A,et al.Molecular and immune toxicity of CoCr nanoparticles in MoM hip arthroplasty[J].Trends Mol Med,2012,18(3):145-155.
[2]XIA Z D,KWON Y M,MEHMOOD S,et al.Characterization of metal-wear nanoparticles in pseudotumor following metal-on-metal hip resurfacing[J].Nanomedicine,2011,7(6):674-681.
[3]MILOSEV I,REMSKAR M.In vivo production of nanosized metal wear debris formed by tribochemical reaction as confirmed by high-resolution TEM and XPS analyses[J].J Biomed Mater Res A,2009,91(4):1100-1110.
[4]MONTEILLER C,TRAN L,MACNEE W,et al.The pro-inflammatory effects of low-toxicity low-solubility particles,nanoparticles and fine particles,on epithelial cells in vitro:the role of surface area[J].Occup Environ Med,2007,64(9):609-615.
[5]LOMBAERT N,DE BOECK M,DECORDIER I,et al.Evaluation of the apoptogenic potential of hard metal dust(WC-Co),Tungsten carbide and metallic Cobalt[J].Toxicol Lett,2004,154(1/2):23-34.
[6]ZHAO J,BOWMAN L,MAGAYE R,et al.Apoptosis induced by Tungsten carbide-cobalt nanoparticles in JB6 cells involves ROS Generation through both extrinsic and intrinsic apoptosis pathways[J].Int J Oncol,2013,42(4):1349-1359.
[7] NYGA A,HART A,TETLEY T D.Importance of the HIF pathway in cobalt nanoparticle-induced cytotoxicity and inflammation in human macrophages[J].Nanotoxicology,2015,9(7):1-13.
[8]CAMPBELL P,SHIMMIN A,WALTER L,et al.Metal sensitivity as a cause of groin pain in metal-on-metal hip resurfacing[J].J Arthroplasty,2008,23(7):1080-1085.
[9]HUANG D C,TATMAN P,MEHLE S,et al.Cumulative revision rate is higher in Metal-on-Metal THA than Metal-on-Polyethylene THA:analysis of survival in a community registry[J].Clin Orthop Relat Res,2013,471(6):1920-1925.
[10]HART A J,QUINN P D,LALI F,et al.Cobalt from metal-on-metal hip replacements May be the clinically relevant active agent responsible for periprosthetic tissue reactions[J].Acta Biomater,2012,8(10):3865-3873.
[11]NEL A,XIA T,MADLER L,et al.Toxic potential of materials at the nanolevel[J].Science,2006,311(5761):622-627.
[12]PAOLICCHI A,DOMINICI S,PIERI L,et al.Glutathione catabolism as a signaling mechanism[J].Biochem Pharmacol,2002,64(5/6):1027-1035.
[13]KIM H P,WANG X,CHEN Z H,et al.Autophagic proteins regulate cigarette smoke-induced apoptosis:protective role of heme oxygenase-1[J].Autophagy,2008,4(7):887-895.
[14]QIAO H,LI L Y,QU Z C,et al.Cobalt-induced oxidant stress in cultured endothelial cells:prevention by ascorbate in relation to HIF-1alpha[J].Biofactors,2009,35(3):306-313.
[15] WAGNER A E,BOESCH-SAADATMANDI C,BRECKWOLDT D,et al.Ascorbic acid partly antagonizes resveratrol mediated heme oxygenase-1 but not paraoxonase-1 induction in cultured hepatocytes - role of the redox-regulated transcription factor Nrf2[J].BMC Complement Altern Med 2011(11):1-10.
[16]BATTAGLIA V,COMPAGNONE A,BANDINO A A,et al.Cobalt induces oxidative stress in isolated liver mitochondria responsible for permeability transition and intrinsic apoptosis in hepatocyte primary cultures[J].Int J Biochem Cell Biol,2009,41(3):586-594.
[17]CAROPPI P,SINIBALDI F,FIORUCCI L,et al.Apoptosis and human diseases:mitochondrion damage and lethal role of released cytochrome C as proapoptotic protein[J].Curr Med Chem,2009,16(31):4058-4065.
[18]LANDSHAMER S,HOEHN M,BARTH N,et al.Bid-induced release of AIF from mitochondria causes immediate neuronal cell death[J].Cell Death Differ,2008,15(10):1553-1563.
[19]GARLAND J M,RUDIN C.Cytochrome c induces caspase-dependent apoptosis in intact hematopoietic cells and overrides apoptosis suppression mediated by bcl-2,growth factor signaling,MAP-kinase-kinase,and malignant change[J].Blood,1998,92(4):1235-1246.
[20]YANG W,SHI L,CHEN L,et al.Protective effects of perindopril on D-galactose and Aluminum trichloride induced neurotoxicity via the apoptosis of mitochondria-mediated intrinsic pathway in the hippocampus of mice[J].Brain Res Bull,2014,109(1):46-53.
