类风湿关节炎患者外周血Treg细胞及其分泌IL-35水平检测与临床意义
2018-03-06熊怡淞
熊怡淞,宋 燕,俞 娟,陈 莉△
(1.成都军区总医院检验科,成都 610083;2南通大学附属医院检验科,江苏南通 226001)
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性破坏性关节病变为特征的全身性自身免疫性疾病,以双手、腕、膝、踝和足关节的对称性多关节炎为主要表现,其病因及发病机制目前尚不明确[1]。研究发现CD4+T 细胞亚群失衡及各种细胞因子和炎症介质的异常表达在RA 发病中起重要作用;CD4+CD25+调节性T细胞(Treg)具有免疫应答负调节和免疫无反应性两大功能,在RA发病和进展中起负调控作用[2],而白细胞介素(IL)-35是Treg细胞发挥最大抑制效应所必需的一种抑制性细胞因子。 IL-35属于IL-12 细胞因子家族,主要由Treg细胞分泌。小鼠体内实验表明,体内IL-35 的表达缺失降低了Treg 细胞的抑制功能,与野生型Treg 相比,IL-35 缺陷的Treg 细胞不能控制效应T细胞的增殖[3]。目前国内对RA患者Treg细胞及其所分泌的IL-35的相关研究和报道较少,因此本研究拟观察RA患者外周血中Treg细胞和IL-35表达及其与临床指标的相关性。
1 资料与方法
1.1一般资料 选择2014年10月至2016年10月在成都军区总医院就诊并确诊为RA的患者45例(RA组),均符合1987年美国风湿病学会诊断标准[4]。其中男9例,女36例,年龄22~78岁,部分患者经过抗风湿药物或激素治疗,根据28关节疾病活动度评分(DAS28)评估目前疾病活动程度:DAS28=0.56×(压痛关节数)1/2+0.28×(肿胀关节数)1/2+0.70×Ln[红细胞沉降率(ERS)]+0.014×(患者健康状况评分)。选择同时期骨关节炎(osteoarthritis,OA)患者22例(OA组),其中男8例,女14例,年龄38~69岁。选择同期健康体检者26例(对照组),其中男8例,女18例,年龄17~65岁。本研究通过该院伦理委员会批准并已获得入选对象的知情同意。排除标准:合并其他自身免疫性疾病及高血压、糖尿病、冠心病、肿瘤性疾病、急慢性感染、传染性疾病,合并严重并发症,孕妇及哺乳期妇女。

A:根据前向角散射光(FSC)和侧向角散射光(SSC)圈出淋巴细胞门LY;B:根据CD4表达圈出CD4+T细胞;C:RA患者CD4+T细胞中foxp3及CD25表达;D:OA患者CD4+T细胞中foxp3及CD25表达;E:健康者CD4+T细胞中foxp3及CD25表达
图1 FCM检测外周血Treg表达
1.2方法
1.2.1仪器与试剂 BD FACSCanto Ⅱ流式细胞检测仪购自美国BD公司;低速离心机(KDC-40 型)购自河北白洋离心机厂;酶标仪购自美国Bio-rad公司;洗板机405LS购自美国Biotek公司;CD4-FITC荧光单克隆抗体、CD25-PE荧光单克隆抗体、Foxp3-Alexa Fluor®647荧光单克隆抗体、破膜剂(BD Cytofix/Cytoperm)购自美国Becton Dickinson 公司;牛血清清蛋白(BSA)购自瑞士Roche公司;人IL-35细胞因子检测试剂盒购自美国MyBioSource公司;人淋巴细胞分离液(Ficoll-Hypaque)购自国药集团化学试剂有限公司。
1.2.2标本采集 采集各组对象空腹静脉外周血标本,用EDTA-K2抗凝处理,于8 h内分析检测,用人淋巴细胞分离液分离外周血单个核细胞(PBMC),PBS清洗重悬,制成浓度为1.0×107/mL细胞悬液用于流式细胞术(FCM)检测。全血标本3 000 r/min离心5 min分离血浆用于细胞因子检测。
1.2.3Treg细胞的检测 (1)取流式上样管,加入各6 μL的CD4和CD25单抗及100 μL PBMC悬液,混匀,室温避光放置20 min;(2)混匀细胞,加入250 μL BD Cytofix/Cytoperm,混匀,4 ℃放置20 min;(3)加入1 mL BD Perm/WashTMbuffer,1 500 r/min水平离心5 min,弃上清液,沾干;(4)重复第3步再洗1遍;(5)将细胞重悬于50 μL BD Perm/WashTMbuffer ,加入foxp3抗体10 μL,混匀,4 ℃放置30~60 min;(6)重复步骤3洗2遍,弃上清液,细胞重悬于500 μL PBS中,用BD FACSCanto ⅡFCM检测,Diva软件分析结果。
1.2.4IL-35的检测 用ELISA方法检测血浆IL-35水平,操作按试剂盒说明书进行。

2 结 果
2.13组对象外周血中Treg细胞水平比较 FCM分析Treg表达,见图1。结果发现,RA组患者外周血中Treg(CD4+CD25+foxp3+T)细胞占CD4+T细胞百分率较对照组明显升高(P<0.05);OA组患者Treg表达比RA患者高,但差异无统计学意义(P=0.086)。3组对象foxp3的荧光强度比较,差异无统计学意义(P>0.05),见表1。
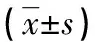
表1 3组对象Treg表达率及foxp3荧光强度的比较
a:P<0.05,与对照组比较
2.2RA患者不同组别外周血Treg细胞水平比较 根据DAS28评分将RA患者分成4组,DAS28评分越高的患者,其外周血Treg细胞数量和foxp3荧光强度越低,Treg百分数在各组间比较差异有统计学意义(P<0.01),而foxp3的荧光强度在各组间比较,差异无统计学意义(P>0.05),见表2。
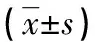
表2 RA患者不同DAS28评分Treg表达及foxp3荧光强度的比较
a:P<0.01,与小于2.6分比较;b:P<0.01,与2.6~<3.2分比较;c:P<0.01,与3.2~5.1分比较
2.3转录因子foxp3表达与CD25表达的相关性 将CD4+T细胞根据CD25表达荧光强度不同分为P3、P4、P5 3群,分别显示每群细胞foxp3表达情况(图2)。foxp3主要表达于高表达CD25的CD4+T细胞,中等程度表达CD25的细胞中也含有少量foxp3阳性细胞。可见foxp3表达与CD25表达呈正相关性。
2.43组对象IL-35水平比较 RA、OA、对照组血浆IL-35分别为(34.22±14.35)、(78.63±24.58)、(67.56±25.43)ng/L,RA组外周血中IL-35水平明显低于OA组及对照组(P<0.05);IL-35在RA患者DAS28<2.6分、2.6~<3.2分、3.2~5.1分、>5.1分组分别为(50.53±16.44)、(42.93±13.53)、(7.97±4.52)、(2.70±1.74)ng/L,DAS28评分越高IL-35水平越低,各组间比较差异有统计学意义(F=30.725,P<0.01),见图3。
2.5RA患者Treg数量与RA实验室指标相关性分析 相关性分析发现,RA患者Treg数量与类风湿因子(RF)、C反应蛋白、抗环瓜氨酸肽(CCP)抗体无相关性,而与ESR、DAS28评分呈负相关(r=-0.223、-0.343,P=0.023、0.011)。IL-35水平与DAS28评分呈负相关(r=-0.368,P=0.008)。
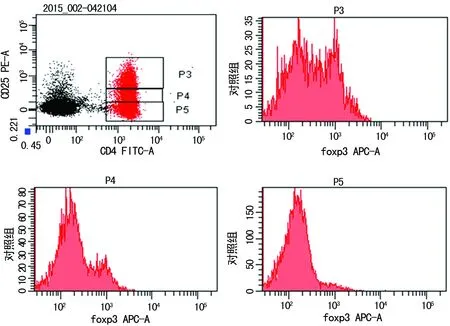
图2 foxp3表达与CD25表达的相关性
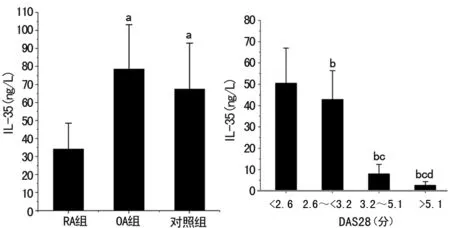
a:P<0.05,与RA组比较;b:P<0.01,与小于2.6分比较;c:P<0.01,与2.6~<3.2分比较;d:P<0.01,与3.2~5.1分比较
图3各组间IL-35水平比较
3 讨 论
目前RA病因和发病机制尚不完全清楚,但一般认为与机体的自身免疫耐受被打破有关[5]。Treg细胞是一群具有免疫负调控作用的T淋巴细胞亚群,健康人外周血Treg细胞占CD4+T细胞的5%~10%,其在维持机体自身免疫耐受方面发挥着极为重要的作用[6]。Treg细胞主要通过以下3个方面发挥免疫抑制作用:(1)细胞直接接触介导抑制;(2)分泌抑制性细胞因子,如IL-10、TGF-β、IL-2等;(3)表达抑制性转录因子foxp3[7-9]。
IL-35是IL-12家族成员之一,主要由Treg细胞产生。IL-35由P35亚基和EBI3亚基构成,其中P35亚基与IL-12 P35亚基相同,EBI3亚基与IL-27 EBI3亚基相同。小鼠体内实验表明,IL-35的表达缺失降低了Treg细胞的抑制功能[3],与野生型Treg细胞相比,IL-35缺陷的Treg细胞不能控制效应T细胞的增殖。NIEDBALA等[10]证明,构建的EBI3-P35-Fc融合蛋白体外能促进CD4+CD25+Treg细胞增殖,抑制CD4+CD25-T细胞增殖,体外和体内均能抑制Th17细胞的分化,抑制IL-17分泌,增强干扰素γ(IFN-γ)的产生,改善胶原性关节炎(CIA)症状。IL-35对CD4+和CD8+T细胞有抑制功能,但仅局限于外周血成熟T细胞。IL-35能诱导CD4+CD39+CD25+T细胞产生IL-10,从而阻止CIA的发生和恶化[11-12]。
本研究发现,RA患者外周血Treg细胞数量增加,但IL-35却明显低于对照组,说明具有负向调控功能的IL-35在RA表达降低,免疫耐受遭到破坏。但Treg细胞数量却增加,有可能其处于免疫“无能”状态,功能与正常Treg细胞不一致,不能发挥有效的免疫负调控功能。由于本研究中部分RA患者经过治疗,不能反映原始的发病状态,因此通过DAS28评分对RA患者进一步分组研究,发现不同组别Treg和IL-35表达存在较大差异,DAS28评分越高,代表疾病活动度越大,其Treg细胞比例和IL-35表达均降低,说明在疾病活动期,外周血中的Treg细胞数量及功能均受一定程度的抑制,负调控能力减弱,机体处于免疫激活状态。而疾病恢复期Treg细胞数量和分泌IL-35功能均增强,甚至超过对照组,使机体处于免疫抑制状态。本研究还发现,Treg细胞与RA病程具有一定相关性,并与ERS和DAS28评分呈负相关,而与RF和C反应蛋白均无相关性。Treg细胞分泌IL-35的水平也与疾病活动度指标DAS28评分呈现负相关关系。
有文献报道RA患者外周血Treg细胞及IL-35减少,关节液中Treg细胞增加[13-16]。也有研究发现RA患者外周血Treg细胞数量与对照组相比无变化或增高[17-18]。造成这些研究结果差异的可能因素有:(1)RA患者的活动度及不同病程的影响,患者处于风湿病的活动期,其Treg细胞的表达可能降低,而处于非活动期的患者其Treg细胞的表达可能跟健康者相同或者高于健康者。(2)用药情况,某些患者用药物治疗后,能部分改善机体免疫功能,重建机体对自身抗原的免疫耐受,其中Treg细胞就是重要的负调控细胞,其表达可能会增加[19]。(3)本研究中RA患者Treg表达虽高于对照组,但其IL-35水平降低,说明其发挥正常的免疫抑制能力减弱,可能属于功能缺陷的Treg细胞。(4)实验样本群及抽样误差造成的影响。
综上所述,Treg细胞及其分泌的IL-35有可能是影响RA发生、发展的重要因素,目前,对于此方面的研究尚待进一步完善,若研究清楚这些将对RA的发病及治疗提供有力的理论依据。
[1]SCHETT G,EMERY P,TANAKA Y,et al.Tapering biologic and conventional DMARD therapy in rheumatoid arthritis:current evidence and future directions[J].Ann Rheum Dis,2016,75(8):1428-1437.
[2]冯家烜,戴生明.调节性T细胞与类风湿关节炎[J].中华风湿病学杂志,2008,12(1):48-51.
[3]COLLISON L W,WORKMAN C J,KUO T T,et al.The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J].Nature,2007,450(7169):566-569.
[4]ARNETT F C,EDWORTHY S M,BLOCH D A,et al.The American rheumatism association 1987 revised criteria for the classification of rheumatoid arthritis[J].Arthritis Rheum,1988,31(3):315-324.
[5]缪怡,胡朝英,钱柳,等.类风湿性关节炎免疫学研究进展[J].上海交通大学学报(医学版),2011,31(7):1035-1040.
[6]GONZALEZ-AMARO R,MARAZUELA M.T regulatory(Treg) and T helper 17(Th17) lymphocytes in thyroid autoimmunity[J].Endocrine,2016,52(1):30-38.
[7]WOLF D,SOPPER S,PIRCHER A,et al.Treg(s) in cancer:friends or foe?[J].J Cell Physiol,2015,230(11):2598-2605.
[8]VON BOEHMER H.Mechanisms of suppression by suppressor T cells[J].Nat Immunol,2005,6(4):338-344.
[9]ROTHSTEIN D M.CAMIRAND G.New insights into the mechanisms of Treg function[J].Curr Opin Organ Transplant,2015,20(4):376-384.
[10]NIEDBALA W,WEI X Q,CAI B E,et al.IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells[J].Eur J Immunol,2007,37(11):3021-3029.
[11]KOCHETKOVA I,GOLDEN S,HOLDERNESS K,et al.IL-35 stimulation of CD39+regulatory T cells confers protection against collagen II-induced arthritis via the production of IL-10[J].J Immunol,2010,184(12):7144-7153.
[12]MCINNES I B,LIEW F Y.Cytokine networks--towards new therapies for rheumatoid arthritis[J].Nat Clin Pract Rheumatol,2005,1(1):31-39.
[13]姚寿林,徐建华,连莉,等.类风湿关节炎患者外周血Th17细胞/调节性T细胞变化及其临床意义[J].中华风湿病学杂志,2011,15(5):309-313.
[14]王伟,杨肃文,张宏娟 等.类风湿关节炎患者Foxp3+CD4+CD25+T细胞的流式细胞术检测及意义[J].中华微生物学和免疫学杂志,2008,28(6)564-564.
[15]SHALINI U P,DEBNATH T,VIDYASAGAR J,et al.A study on FoxP3 and Tregs in paired samples of peripheral blood and synovium in rheumatoid arthritis[J].Central Eur J Immunol,2015,40(4):431-436.
[16]NAKANO S,MORIMOTO S,SUZUKI S,et al.Immunoregulatory role of IL-35 in T cells of patients with rheumatoid arthritis[J].Rheumatology,2015,54(8):1498-1506.
[17]杨蔺,叶勤,袁向亮,等.流式细胞术检测RA患者外周血CD4+CD25+FOXP3+Treg细胞及其GITR表达[J].临床检验杂志,2008,26(4):291-293.
[18]NAKAMURA T,KUMON Y,HIRATA S,et al.Abatacept May be effective and safe in patients with amyloid A amyloidosis secondary to rheumatoid arthritis[J].Clin Exp Rheumatol,2014,32(4):501-508.
[19]KIKUCHI J,HASHIZUME M,KANEKO Y,et al.Peripheral blood CD4+CD25+CD127lowregulatory T cells are significantly increased by tocilizumab treatment in patients with rheumatoid arthritis:increase in regulatory T cells correlates with clinical response[J].Arthritis Res Ther,2015,17(1):1-10.
