西藏地区正常藏族人群心脏形态及瓣膜关闭不全相关因素分析
2018-03-06杨瑛冯斌智光朱庆磊周珊珊陈蒙王增武陈韵岱
杨瑛,冯斌,智光,朱庆磊,周珊珊,陈蒙,王增武,陈韵岱
西藏自治区地处我国西南边陲,平均海拔在4 000米以上,是藏族人群主要聚集地。受多因素影响,该地区人群心脏形态及瓣膜功能相关研究处于相对空白状态。2014年,解放军总医院心血管内科与西藏自治区医学专业人员密切合作,历时3年,在该地区开展慢性心肺疾病流行病学调查,获得大量数据,为研究正常藏族人群心脏形态与瓣膜功能提供了依据。
1 资料与方法
调查对象:本研究以西藏地区常住人口为总体,采用分层四阶段随机抽样方法抽取调查对象,详见图1。以2007 年西藏地区的高血压患病率作为估计值[1],结合冠心病、慢性阻塞性肺疾病、脑卒中患病率的样本需求,考虑实施难度,计划在西藏抽取15 岁以上人群 6 000 人进行调查,每个区/县分配1 000人。以年龄/性别分层,每层数量按照各年龄阶段占西藏总人口的百分比计算,经调整不应答率、男女各半获得。
收集调查对象个人信息、病史;所有调查对象行体格检查、实验室(血尿)检查、心电图、X线胸片及超声心动图检查。超声图像采集:采用Vivid-I机型,M3S探头。由两名有资质医师采集。常规探查各切面、测量心脏各腔室大小、室壁厚度、及左、右心室功能;评价各组瓣膜形态及活动度,有无狭窄及关闭不全。径线测量及瓣膜功能评价按美国超声协会推荐的标准[2-4]。

图1 整体调查抽样及正常藏族人群筛选及分析流程图
入选标准:在所有调查人群中筛选正常藏族人群,符合以下标准:年龄在15岁以上,藏族,体格检查正常。
排除标准:冠状动脉疾病、先天性心脏病、心力衰竭、高血压、卒中、高脂血症(血清总胆固醇≥6.22 mmol/L或甘油三酯≥2.26 mmol/L,或正在服用调脂药物)、糖尿病、急性或慢性呼吸道疾病病史、慢性阻塞性肺疾病评估测试评分<20分、贫血、肝脏疾病、肾功能异常(血清肌酐≥110 µmol/L)、肥胖(体重指数≥28.0 kg/m2)、心电图异常(病理性Q波、心律失常及完全性束支阻滞)、超声心动图检查发现任何程度瓣膜狭窄、瓣膜关闭不全(中-重度、三尖瓣反流速度>2.8 m/s)、室壁运动障碍、心包积液。经X线胸片检查,排除肺气肿、肺原性心脏病、肺炎、支气管扩张、结核、胸腔积液。肺功能检查支气管扩张剂吸入后的1秒率<0.7。图像质量差不能分析需排除。
统计学方法:所有统计分析应用SPSS 24.0统计软件进行。(1)分类变量以数量或百分比表示,正态分布连续变量以均数±标准差表示,偏态分布连续变量以中位数(四分位数)表示。偏态资料两组间或与正态资料两组间相比较采用秩和检验。(2)正常藏族人群心脏形态相关因素分析,采用典型相关方法。按性别分别建立基本生理指标(SET1):年龄、身高、体重、脉搏、血氧饱和度与心脏测量指标(SET2):右心室:主肺动脉宽度、右心室前后径、右心室横径;左心室:左心室横径、左心室舒张末期前后径、左心室收缩末期前后径,一对间接典型相关变量(见下公式)。(3)瓣膜关闭不全相关因素分析:以性别、年龄、身高、体重、脉搏、血氧饱和度为自变量,以三尖瓣、二尖瓣、主动脉瓣关闭不全为应变量,建立逻辑回归方程。双侧P<0.05为差异有统计学意义。
2 结果
2.1 总体基本情况
整体西藏地区共4 688人参加调查,获得正常藏族人群共1 820人,其中拉萨地区694人、那曲地区575人、林芝地区286人、日喀则地区265人。正常藏族人群基本生理学指标及心脏测量指标见表1。表1提示瓣膜关闭不全中轻度三尖瓣关闭不全的检出率最高;男女之间年龄、血氧饱和度无差异,女性脉搏比男性快,而男性心脏测量指标均大于女性,差异均有统计学意义(P均<0.05)。

表1 正常藏族人群基本生理学及心脏测量指标[中位数(四分位数)]
2.2 正常藏族人群心室形态相关因素分析
正常藏族男性右心室典型相关系数及假设检验结果(表2):正常藏族男性右心室三个典型相关系数,经假设检验可以发现第一、第二对典型相关变量之间相关性可以成立,第三对相关性不成立。基本生理学指标与右心室测量指标之间的关系转化为第一、第二对典型相关变量之间的关系。

表2 正常藏族男性右心室典型相关系数及假设检验结果(n=707)
根据标准化典型变量系数,第一对典型变量函数为:

第二对典型变量函数为:

在第一对典型变量中,基本生理学指标中年龄的系数较大,而心脏测量中主肺动脉系数最大,结合回归系数符号相同,可以认为年龄与主肺动脉宽度呈正相关。而第二对典型变量中,生理学指标中体重、血氧饱和度系数较大,右心室测量在右心室横径、右心室前后径上的系数较大。这说明体重与右心室前后径呈正相关,与右心室横径呈负相关;血氧饱和度与右心室横径呈正相关,与右心室前后径呈负相关。
正常藏族女性右心室典型相关系数及假设检验结果(表3):正常藏族女性右心室三个典型相关系数,三对典型相关变量之间的相关性可以成立,但第三对典型变量相关系数非常小,可以忽略不计。

表3 正常藏族女性右心室典型相关系数及假设检验结果(n=1 113)
根据标准化典型变量系数,第一对典型变量函数为:

第二对典型变量函数为:

在第一对典型变量中,基本生理学指标中年龄和血氧饱和度系数较大,而右心室测量中主肺动脉、右心室横径系数较大,结合回归系数符号相同,认为年龄、血氧饱和度与主肺动脉、右心室横径呈正相关。第二对典型变量中,基本生理学指标主要受体重和血氧饱和度影响,右心室测量在右心室前后径系数较大。体重与右心室前后径呈正相关,血氧饱和度与右心室前后径呈负相关。
正常藏族男性左心室典型相关系数及假设检验结果(表4):正常藏族男性左心室三个典型相关系数,经假设检验可以发现第一、第二对典型相关变量之间相关性可以成立,第三对相关性不成立。基本生理学指标与左心室测量指标之间的关系转化为第一、第二对典型相关变量之间的关系。

表4 正常藏族男性左心室典型相关系数及假设检验结果(n=707)
根据标准化典型变量系数,第一对典型变量函数为:

第二对典型变量函数为:

在第一对典型变量中,基本生理学指标中体重系数较大,而左心室测量中左心室舒张末期前后径系数较大,结合回归系数符号相同,可以认为体重与左心室舒张末期前后径呈正相关。而第二对典型变量中,生理学指标中年龄、身高、体重系数均较大,左心室测量在左心室舒张末期前后径、左心室收缩末期前后径上的系数较大。这说明年龄大、身材高的正常藏族男性左心室收缩末期前后径大;体重大的正常藏族男性左心室舒张末期前后径大。
正常藏族女性左心室典型相关系数及假设检验结果(表5):显示正常藏族女性左心室的三个典型相关系数,经假设检验可以看到第一、第二对典型相关变量之间相关性可以成立,而第三对典型变量相关不成立。
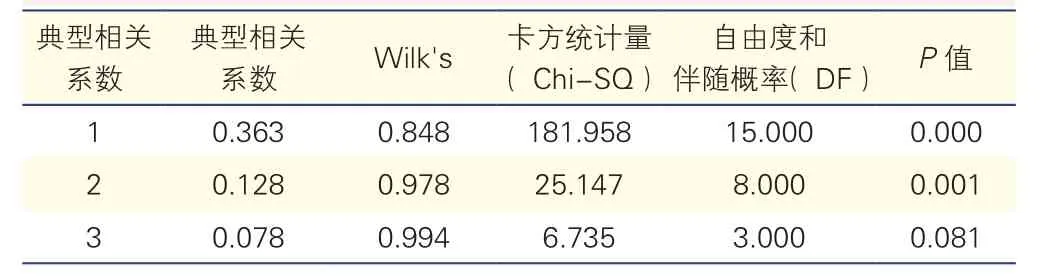
表5 正常藏族女性左心室典型相关系数及假设检验结果(n=1 113)
根据标准化典型变量系数,第一对典型变量函数为:

第二对典型变量函数为:

在第一对典型变量中,生理学指标中体重的系数最大,而左心室测量中左心室横径系数较大,结合回归系数符号相同,认为体重与左心室横径呈正相关。第二对典型变量中,生理指标主要受年龄、身高、体重影响,左心室测量在左心室舒张末期前后径、左心室收缩末期前后径上的系数较大。体重与左心室舒张末期前后径呈正相关,年龄、身高与左心室收缩末期前后径呈正相关。
经以上典型相关分析,可以发现正常藏族人群右心室测量主要相关生理学指标为年龄、血氧饱和度、体重,男女差异不大;左心室测量主要相关生理学指标为:体重、年龄、身高,同样性别差异较小。
2.3 心脏瓣膜关闭不全相关因素分析
因健康人群入选时排除了瓣膜病,应变量为无、轻度瓣膜关闭不全。以性别、年龄、身高、体重、脉搏、血氧饱和度为自变量建立逻辑二分类回归方程。结果如表6所示。体重、脉搏、血氧饱和度为三尖瓣轻度关闭不全的负相关因素。年龄为二尖瓣、主动脉瓣轻度关闭不全的正相关因素。

表6 正常藏族人群轻度瓣膜关闭不全相关因素分析
3 讨论
所谓“正常人”不是指机体任何器官、组织的形态和机能正常的人,而是排除了影响所研究指标的疾病和有关因素的同质人群[5]。本研究借鉴心脏超声研究中关于“正常人群”的定义,对“正常”进行界定[6]。
关于年龄对心脏形态及功能影响,一项全国范围内正常汉族人群超声心动图测量结果[6]提示主肺动脉宽度随年龄增加而增加。同时该研究指出在无论性别差异,左心室舒张末期内径随年龄增长轻度减低;男性人群中左心室收缩末期内径随年龄增长减低,而女性中则不变。本研究结果显示无论性别,年龄与主肺动脉呈正相关,这一点即使存在低氧的环境差异,与正常汉族人群是相符合的。在正常藏族人群中左心室舒张末期前后径与年龄呈负相关,但属于次要相关。本研究结果提示左心室收缩末期内径与年龄呈正相关,这一点与以上研究不符,不能排除与地区民族差异有关,需要进一步研究。另一方面,年龄是左心瓣膜关闭不全的正相关因素。研究发现,随着年龄的增大,瓣环周长在不断增大,这一点在主动脉瓣、肺动脉瓣上表现尤为突出[7]。而主动脉瓣环扩张及升主动脉扩张是导致主动脉瓣关闭不全的主要原因[8]。Framingham研究认为主动脉瓣关闭不全相关因素包括年龄、男性;二尖瓣关闭不全相关因素包括年龄、高血压、体重指数[9]。所以即使存在低氧高原环境,左心瓣膜关闭不全情况符合一般流行病学规律。
体重因素在研究中往往被忽略。事实上,针对健康心脏解剖分析发现[7],体重是心脏重量良好预测指标,在一定程度上代表了心脏的生长发育状态。而且在高原低氧对机体作用中,机体内水、脂肪的代谢会发生改变,从而引起体重明显下降[10]。有研究总结在安第斯山区及藏族人群中出生时体重增加是对高原环境的适应性改变之一[11]。推测在高原特殊环境下,体重是机体适应能力的一个指标,代表机体生长发育营养状态。所以,体重与左、右心室形态均相关,并与三尖瓣轻度关闭不全呈负相关。
高原低氧环境会引起肺血管收缩以达到通气灌注匹配的目的,但这种适应性反应的另一面是肺动脉高压[12]。在高原环境中,低氧导致肺动脉压增高、肺血管阻力增加、右心扩大,并最终导致三尖瓣关闭不全[13]。所以血氧饱和度与右心室形态密切相关。但右心室本身形态不规则,虽然本研究采用了通用的多角度测量以提高对右心室形态的概括能力,但仍存在右心室横径与右心室前后径受血氧饱和度影响而变化不一致的情况,提示右心室受低血氧影响而发生的形态改变可能同样不规则,并非简单线性或平面变化,可能采用最新的右心室三维立体重建测量才能全面反映。本研究也发现高血氧饱和度是轻度三尖瓣关闭不全的负相关因素,这与既往观点认为轻度三尖瓣关闭不全为功能性改变相左,提示在高原环境中应重视轻度三尖瓣关闭不全的发生,并随访其发展变化。
[1] 古桑拉姆, 平措扎西, 蔡玉霞, 等. 西藏农牧区高血压患病率、知晓率、治疗率和控制率的调查[J]. 中国医药指南, 2010, 27(8): 79-81. DOI: 10. 3969/j. issn. 1671-8194. 2010. 27. 050.
[2] Lang RM, Badano LP, Moravi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J]. Eur Heart J Cardiovasc Imag, 2015, 16(3): 233-270. DOI: 10. 1093/ehjci/jev014.
[3] Zoghbi WA, Enriquez-Sarano M, Foster E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography [J]. J Am Soc Echocardiogr, 2003, 16 (7): 777-802. DOI: 10. 1016/S0894-7317(03)00335-3.
[4] Baumgartner H, Hung J, Bermejo J, et al. Echocardiographic assessment of valve stenosis: EAE/ASE recommendations for clinical practice [J]. J Am Soc Echocardiogr, 2009; 22 (1): 1-23. DOI: 10. 1016/j. echo.2008.11. 029.
[5] 田凤调. 医学正常值的统计研究方法[M]. 北京: 人民卫生出版社,1990.
[6] Yao GH, Deng Y, Liu Y, et al. Echocardiographic measurements in normal Chinese adults focusing on cardiac chambers and great arteries: a prospective, nationwide, and multicenter study[J]. J Am Soc Echocardiogr, 2015, 28(1): 570-579. DOI: 10. 1016/j. echo. 2015. 01.022.
[7] Kitzman DW, Scholz DG, Hagen PT, et al. Age-related changes in normal human hearts during the first 10 decades of life. Part II(Maturity): a quantitative anatomic study of 765 specimens from subjects 20 to 99 years old[J]. Mayo Clinic Proceedings, 1988, 63(2):137-146. DOI: 10. 1016/S0025-6196(12)64946-5.
[8] Olson LJ, Subramanian R, Edwards WD. Surgical pathology of pure aortic insufficiency: a Study of 225 Gases[J]. Mayo Clinic Proceedings,1985, 59(12): 835-841. DOI: 10. 1016/S0025-6196(12)65618-3.
[9] Singh JP, Evans JC, Levy D, et al. Prevalence and clinical determinants of mitral, tricuspid, and aortic regurgitation (the Framingham Heart Study)[J]. Am J Cardiol, 1999, 83(6): 897-902. DOI: 10. 1016/S0002-9149(98)01064-9.
[10] Vats P, Ray K, Majumadar D, et al. Changes in cardiovascular functions, lipid profile, and body composition at high altitude in two different ethnic groups[J]. High Alt Med Biol, 2013, 14(1): 45-52.DOI: 10. 1089/ham. 2012. 1071.
[11] Bigham AW. Genetics of human origin and evolution: high-altitude adaptations[J]. Curr Opin Genet Dev, 2016, 41(12): 8-13. DOI: 10.1016/j. gde. 2016. 06. 018.
[12] Naeije R, Dedobbeleer C. Pulmonary hypertension and the right ventricle in hypoxia[J]. Exp Physiol, 2013, 98(8): 1247-1256. DOI: 10.1113/expphysiol. 2012. 069112.
[13] Po JR, Meeran T, Davey R, et al. Tricuspid regurgitation is associated with pulmonary hemodynamics and right ventricular dysfunction in pulmonary arterial hypertension but does not alter the geometry of right ventricular contraction[J]. J Heart Lung Transpl, 2016, 35(4):S356-S356. DOI: 10. 1016/j. healun. 2016. 01. 1024.
