依据腹主动脉与肾动脉解剖关系制定肾动脉支架操作技术策略对介入手术的影响
2018-03-06刘杰董徽车武强邹玉宝蒋雄京
刘杰 ,董徽,车武强,邹玉宝,蒋雄京
随着人口老龄化的进展,尤其是动脉粥样硬化的相关危险因素(高血压、糖尿病、高血脂、吸烟等) 也逐渐增加,粥样硬化性肾动脉狭窄(ARAS)患病率逐渐增加。研究显示,在普通高血压人群中,ARAS的患病率1%~5%[1],而在心力衰竭、肾功能衰竭等高危人群的ARAS患病率可超过40%[2]。动脉粥样硬化是肾动脉狭窄最常见的病因,据阜外医院报道其在肾动脉狭窄中占81.5%[3]。肾动脉狭窄的主要症状为难治性高血压、肾功能衰竭和急性肺水肿。目前,治疗策略包括药物治疗、外科治疗和介入治疗,而介入治疗因为创伤小、并发症少、住院周期短成为需要血运重建的肾动脉狭窄患者的首选[4-6]。在肾动脉介入治疗过程中,肾动脉与腹主动脉的成角、腹主动脉迂曲对介入手术的影响愈加得到临床医师关注。本研究旨在评估依据腹主动脉与肾动脉解剖关系制定肾动脉支架操作技术策略对介入手术的影响。
1 资料与方法
研究对象:选取2012-01至2013-12住院的ARAS患者182例,男性 127例(69.8%)。入选标准[7,8]:(1)肾动脉主干或主要分支直径狭窄≥75%;或直径狭窄仅≥60%但<75%,则必须具备狭窄远、近端压差≥30 mmHg(1 mmHg=0.133 kPa)或卡托普利肾图试验阳性;(2)未服降压药时,收缩压≥180 mm Hg和(或)舒张压 ≥110 mmHg者,或者正规服用三联(包括一种利尿剂)降压药治疗后,收缩压≥140 mmHg和(或)舒张压≥90 mmHg者;(3)患肾长度>7.0 cm;(4)单侧肾动脉狭窄。排除标准: (1)严重的慢性缺血性肾病, 血清肌酐> 265 mmol/L(3.0 mg/dl)或患侧肾小球滤过率 < 10 ml/min;(2)对比剂过敏;(3)病情不稳定,无法耐受介入治疗;(4)预期寿命小于2年。
介入治疗: 常规经股动脉入径介入治疗,如该入径失败或术前影像学检查提示股动脉入径不可行,可选择上肢动脉入径行介入治疗。局麻下,以Seldinger 技术穿刺股动脉,全身肝素化后(普通肝素100 U/kg),建立动脉内压力监测。然后,在0.035英寸导丝引导下,推送5F造影导管到双侧肾动脉开口,行选择性双侧肾动脉造影,明确肾动脉病变解剖情况。股动脉入径更换为6F RDC导引导管(波科公司,美国),肱动脉入径用90 cm, 6F MPA 引导导管(波科公司,美国)、桡动脉入径用125 cm 6F MPA引导导管(强生公司,美国)送指引导管到狭窄侧肾动脉开口,送0.014软头导丝到肾动脉中远段,沿着导丝推送球囊至病变处进行预扩张。扩张后撤出球囊。沿导丝推送球囊扩张金属裸支架(Hippocampus,美敦力公司,美国)至病变处,压力大小视病变对压力的反应,使支架充分膨胀,一般8~15个大气压,加压时间10~15 s。支架放置后残余狭窄<30%,血流通畅,且无手术相关的严重并发症视为手术成功。反之为手术失败。
推送支架成功到位的操作技术定义: 技术1为单纯导丝锚定:导丝锚定,导引导管不需插入肾动脉;技术2为导丝锚定+球囊杆辅助:导丝锚定,引导管需在预扩张球囊杆的辅助支撑下插入肾动脉病变远端;技术3为导丝+球囊共同锚定:导丝锚定,导引导管需在预扩张球囊锚定的支撑下插入肾动脉病变远端。
终点指标及分组: 应用MB-Ruler软件或飞利浦64排计算机断层摄影术(CT)自带软件测量肾下腹主动脉与肾动脉角度,根据肾下腹主动脉与肾动脉开口的不同成角分为3组:开口角度91~120°者为A 组(n=20);61~90°者为 B 组(n=125);30~60°者为C组(n=37)。根据腹主动脉的不同形态[即肾下腹主动脉和(或)髂动脉是否迂曲]分为非迂曲型组(n=146)、迂曲型组(n=36)。记录不同组别采用的操作技术、更换上肢动脉入径比例、X线曝光时间、手术操作时间、对比剂用量和操作相关并发症(包括肾动脉夹层、穿孔、穿刺局部并发症、卒中、心肌梗死、死亡)情况。
统计学方法:使用SPSS 17.0 版软件进行统计分析。计数资料以例(%) 表示,计量资料以表示。多组间计数资料比较使用卡方检验或Fisher检验,计量资料比较使用方差分析。 P<0.05为差异有统计学意义。
2 结果
两种分组患者的基线资料比较: A、B、C 三组患者的基线资料比较差异均无统计学意义(P>0.05,表1)。迂曲型组与非迂曲型组比较,患者年龄较大(P<0.05),两组其余基线资料比较差异均无统计学意义(P均>0.05,表2)。
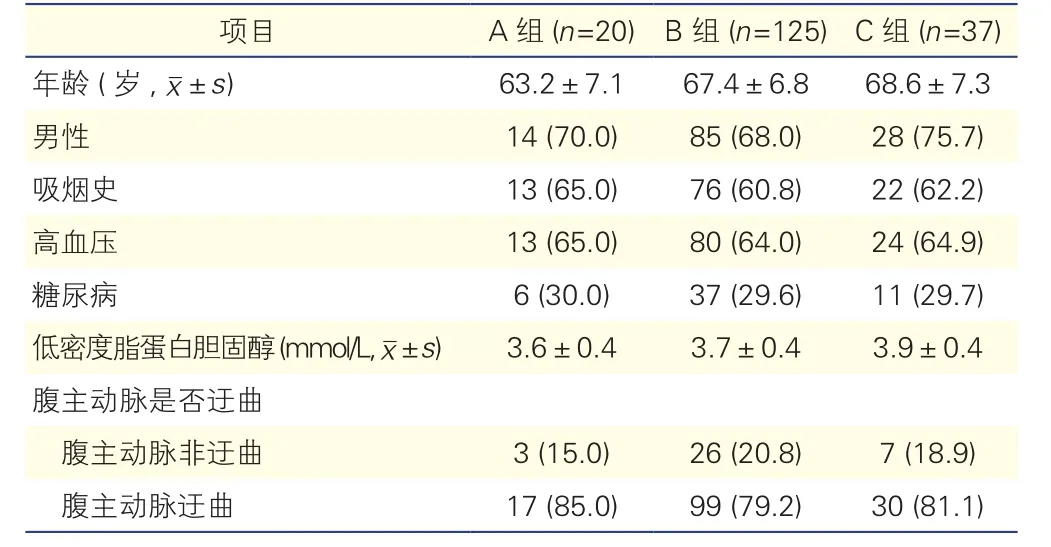
表1 肾下腹主动脉与肾动脉开口不同成角分组患者的基线资料比较[例(%)]
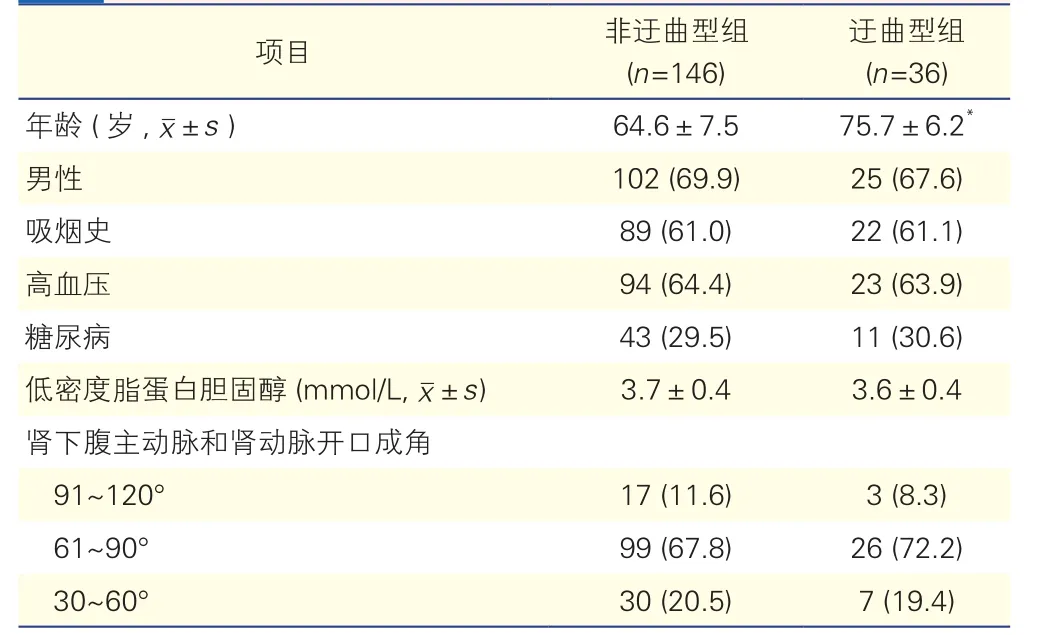
表2 腹主动脉不同形态分组患者的基线资料比较[例(%)]
两种分组患者手术相关参数和手术相关并发症的比较: C组分别与A、B组比较(表3)、迂曲型组与非迂型曲组比较(表4),采用操作技术(3和2+3)的比例、更换上肢动脉入径比例、X线曝光时间、手术操作时间、对比剂用量和手术相关并发症总计发生率均增加,差异均有统计学意义(P均<0.05),而B组与A组比较各项指标均差异无统计学意义。
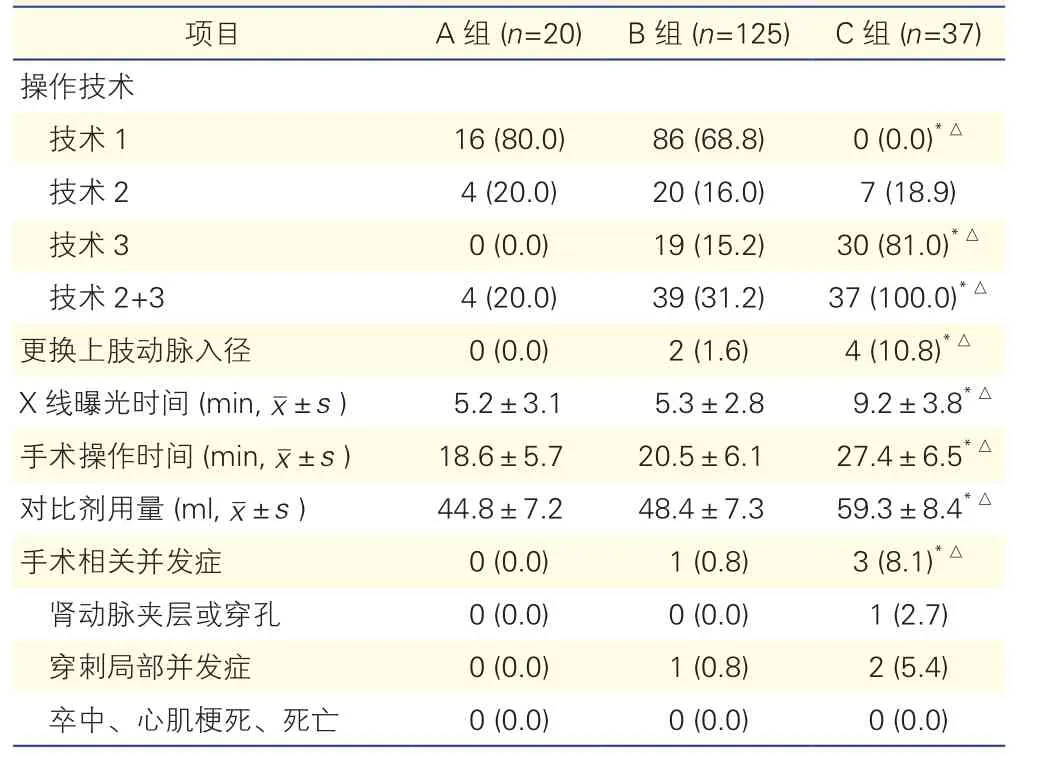
表3 肾下腹主动脉和肾动脉开口不同成角组患者的手术相关参数和并发症比较[例(%)]
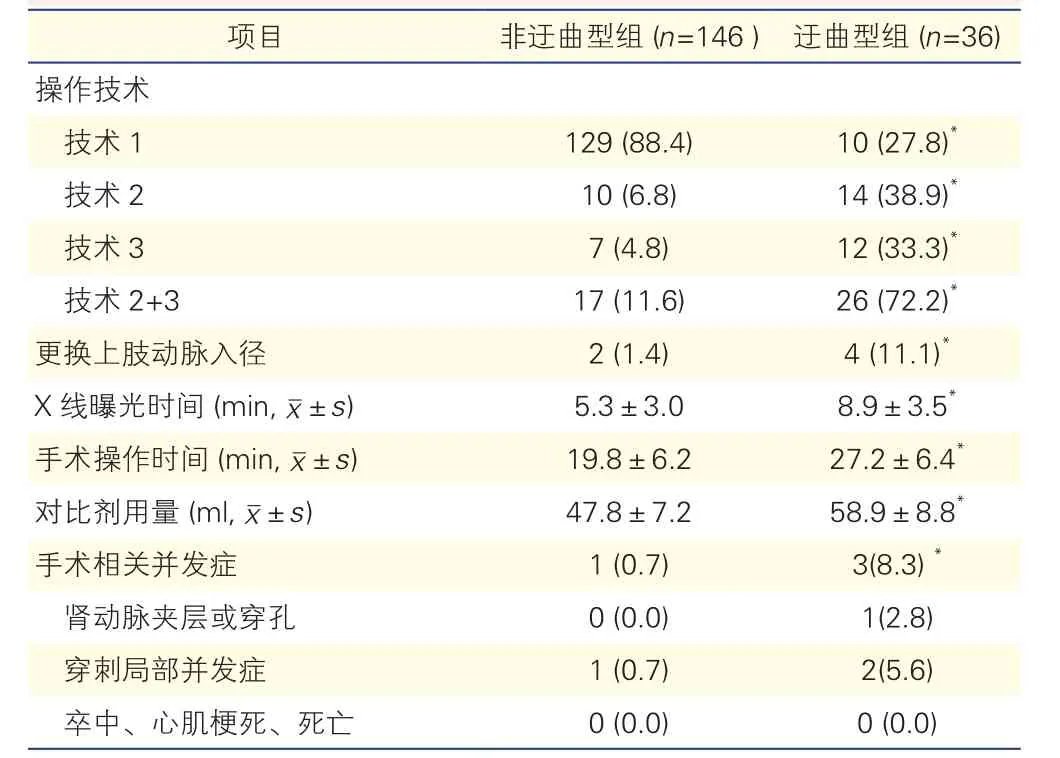
表4 腹主动脉不同形态分组的患者手术相关参数和并发症比较[例(%)]
3 讨论
本研究表明:对于肾下腹主动脉与肾动脉成角较大(A组和B组)及腹主动脉走行较直(非迂曲型组)的患者,选择股动脉入径,导引导管与肾动脉同轴性好,球囊及支架容易送达病变部位,介入手术难度小,成功率高、并发症低。而当患者的肾下腹主动脉与肾动脉的夹角较小(C组)以及腹主动脉迂曲(迂曲型组)时,无论是更换上肢动脉入径比例、X线曝光时间、手术操作时间、对比剂用量、并发症发生风险均明显增加。本研究表明,造成以上差别的主要原因是血管解剖因素(肾动脉急剧开口向上和腹主动脉迂曲)导致肾动脉与导引导管头端同轴性差,肾动脉支架无法受力推送到病变。对于肾动脉成角较少(C组)患者,如选择股动脉入径,可尝试同轴技术来完成手术,即技术3共同锚定病变,在球囊减压排空对比剂过程中推送导引导管头端通过病变,从而达到肾动脉与导引导管头端同轴,这样较硬的支架才能推送到病变释放。这项技术中把导引导管头端推送过病变时,由于导引导管头端受力与肾动脉方向不一致,有可能使导引导管被弹出肾动脉主干,支架不能到位,导致手术失败。因此,如采用这项技术不成功时,要改用上肢动脉入径(常用肱动脉或桡动脉入径),MPA1型导管头端与C组患者肾动脉同轴好,支架很容易到位。在临床实践中,如术前影像学提示为C组类病变,可直接选择上肢动脉入径行介入治疗。对于肾下腹主动脉和(或)髂动脉迂曲,经股动脉入径导引导管的操作难度(推送及旋转)明显增加,同时,导管的支撑力量也会受限,解决的办法可使用股动脉长鞘(克服迂曲)或改用上肢动脉入径避开迂曲的动脉。如果患者存在以上两种血管解剖变异,而术者不采用上肢动脉入径,不仅导致手术操作难度增加,也增加耗材使用、X线曝光时间及并发症等问题。基于文献及本研究的经验,股动脉入径可以适用于大多数肾动脉支架术病例,在合并腹主动脉和(或)迂曲及肾下腹主动脉和肾动脉成角较小的病例中,从上肢动脉入径完成肾动脉介入手术是更好的选择。尽管有一定的办法能够克服肾动脉与腹主动脉的解剖问题给手术带来的影响,但从减低放射损害、手术并发症和手术费用等角度出发,术前明确狭窄肾动脉与肾下腹主动脉的夹角、肾下腹主动脉和(或)髂动脉是否迂曲或是闭塞显得尤为重要。
根据欧洲心脏病学会(ESC)2011推荐的肾动脉狭窄诊断策略,肾动脉彩色超声是一线的筛查手段(Ⅰ类推荐,B级证据),能了解肾动脉狭窄的程度并作功能评估,但是肾动脉超声难以完整地显示肾动脉,更难以了解肾动脉与腹主动脉的解剖关系[9-11]。而计算机断层血管造影有较好的空间分辨率,能较好的明确肾动脉与腹主动脉的关系,同时能显示腹主动脉及髂动脉的迂曲程度[12]。阜外医院已常规对肾动脉狭窄患者术前行腹主动脉及其分支的计算机断层血管造影检查,评估血管解剖特点,以便选择合理的操作技术,从而减少手术操作风险,提高技术成功率,避免手术操作并发症。
本研究存在的不足:本研究评估了改良肾动脉支架操作技术对介入手术的影响。但不同血管解剖特征组组间例数差别较大、导引导管头端形状单一等不足有待于进一步深入研究。
[1] Mancia G, de Bacher G, Dominiczak A, et al. 2007 guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology(ESC)[J]. J Hypertens, 2007, 25(6): 1105-1187. DOI: 10. 1097/HJH.0b013e3281fc975a.
[2] De Mast Q, Beutler JJ. The prevalence of atherosclerotic renal artery stenosis in risk groups: a systematic literature review[J]. J Hypertens,2009, 27 (7): 1333-1340. DOI: 10. 1097/HJH. 0b013e328329bbf4.
[3] Peng M, Jiang XJ, Dong H, et al. Etiology of renal artery stenosis in 2047 patients: a single-center retrospective analysis during a 15-year period in China[J]. J Hum Hypertens, 2016, 30(2): 124-128. DOI: 10.1038/jhh. 2015. 40.
[4] Novick AC, Ziegelbaum M, Vidt DG, et al. Trends in surgical revascularization for renal artery disease. Ten years’ experience[J]. JAMA,1987, 257(4): 498-501. DOI: 10. 1001/jama. 1987. 03390040114028.
[5] Balzer KM, Pfeiffer T, Rossbach S, et al. Prospective randomized trial of operative vs interventional treatment for Renal Artery Ostial Occlusive Disease (RAOOD) [J]. J Vasc Surg, 2009, 49(3): 667-674.DOI: 10. 1016/j. jvs. 2008. 10. 006.
[6] 蒋雄京, 吴海英, 张慧敏, 等. 经皮肾动脉支架术治疗肾血管性高血压的临床结果[J]. 中国循环杂志, 2006, 21(2): 89-92.
[7] Peng M, Jiang XJ, Dong H, et al. Can lercanidipine improve renal function in patients with atherosclerotic renal artery stenosis undergoing renal artery intervention? [J]. Curr Med Res Opin, 2015,31(1): 177-182. DOI: 10. 1185/03007995. 2014. 960071.
[8] Jiang X, Peng M, Li B, et al. The efficacy of renal artery stent combined with optimal medical therapy in patients with severe atherosclerotic renal artery stenosis[J]. Curr Med Res Opin, 2016, 32(sup2): 3-7. DOI:10. 1080/03007995. 2016. 1218833.
[9] White CJ, Jaff MR, Haskal ZJ, et al. Indications for renal arteriography at the time of coronary arteriography: a science advisory from the American Heart Association Committee on Diagnostic and Interventional Cardiac Catheterization, Councilon Clinical Cardiology,and the Councils on Cardiovascular Radiology and Intervention and on Kidney in Cardiovascular Disease[J]. Circulation, 2006, 114(17):1892-1895. DOI: 10. 1161/CIRCULATIONAHA. 106. 178777.
[10] Drieghe B, Madaric J, Sarno G, et al. Assessment of renal artery stenosis: side-by-side comparison of angiography and duplex ultrasound with pressure gradient measurements[J]. Eur Heart J, 2008,29(4): 517-524. DOI: 10. 1093/eurheartj/ehm631.
[11] American Institute of Ultrasound in Medicine; American College of Radiology. AIUM practice guideline for the performance of renal artery duplex sonography[J]. J Ultrasound Med, 2009, 28(1): 120-124. DOI:10. 7863/jum. 2009. 28. 1. 120.
[12] Vasbinder GB, Nelemans PJ, Kessels AG, et al. Accuracy of computed tomographic angiography and magnetic resonance angiography for diagnosing renal artery stenosis[J]. Ann Intern Med, 2004, 141(9):674-682. DOI: 10. 7326/0003-4819-141-9-200411020-00007.
