CuO改性提高镁铝尖晶石脱除FCC烟气NOx性能的研究
2018-03-05沈本贤皮志鹏刘纪昌刘逸锋
沈本贤, 皮志鹏, 刘纪昌, 刘逸锋
(华东理工大学 石油加工研究所, 上海 200237)
氮氧化物(NOx)是主要的大气污染物之一,影响人体健康。在石油化工企业中,NOx主要存在于各类烟气中。其中,催化裂化装置(FCC)再生烟气中的NOx排放占50%以上[1-2]。在FCC工艺过程中,氮元素主要来源于原料;原料中部分含氮化合物随焦炭沉积于催化剂表面,在催化剂烧焦再生过程中燃烧生成NOx进入烟气中;原料中约5%~10%的氮最终转化为NOx(主要为NO)[3]。在FCC再生器出口处的高温烟气中,NOx质量分数通常在50~500 μg/g的范围内,具体浓度取决于原料中氮的含量和再生器的燃烧条件[4]。随着国家对环境保护的日臻重视,针对大气污染物的排放标准也越来越严格。2015年4月,国家环保部颁布了《石油炼制工业污染物排放标准(GB 31570—2015)》,要求现有企业自2017年7月1日起执行。对NOx的排放控制要求从240 mg/m3严格到不大于200 mg/m3;对生态环境脆弱的重点保护区,则NOx的排放控制要求提升至100 mg/m3。石油化工企业面临越来越严峻的NOx等减排挑战。
目前主要有3种技术应对FCC烟气中NOx等污染问题:原料加氢脱氮、烟气洗涤并选择性还原(SCR)脱硝[5-7]和使用脱硝环保助催化剂。3种技术中,使用脱硝助催化剂控制FCC烟气中NOx排放具有设备投资费用少、操作费用低、废物后处理问题少等优点。
在FCC主催化剂烧焦再生过程中,再生器的密相床层,特别是两段再生的第一段再生中,存在大量焦炭不完全燃烧生成的CO;烟气中的NOx可以被CO还原为N2,发生如下反应[8]:
2CO+2NO→N2+2CO2
(1)
CO+2NO→N2O+CO2
(2)
N2O+CO→N2+CO2
(3)
使用环保助催化剂催化这一过程,将有效地降低FCC烟气中的NOx含量。镁铝尖晶石是一种常用的FCC烟气脱硫助催化剂[9-11],本研究中使用CuO对镁铝尖晶石进行改性,提高其对烟气脱硝功能;基于密度泛函理论揭示改性镁铝尖晶石上的NO+CO反应机理;并在中国石化清江石油化工分公司重油催化裂化装置上,考察了改性合成助催化剂的脱硝性能。
1 实验部分
1.1 原料和试剂
尖晶石合成及改性过程中使用的拟薄水铝石、硝酸,上海凌峰化学试剂有限公司产品;Mg(NO3)2、Cu(NO3)2·3H2O,国药集团化学试剂有限公司产品。
1.2 助催化剂制备
采用溶胶凝胶法制备镁铝尖晶石[12]。首先将拟薄水铝石加入去离子水中搅拌成悬浮液,滴加入稀硝酸溶液,形成铝溶胶。然后按所需比例,加入Mg(NO3)2溶液,并于65℃水浴中搅拌2 h。取出于140℃下干燥12 h,得到凝胶,置于马福炉中700℃焙烧4 h,即制得镁铝尖晶石。采用共胶法将CuO引入镁铝尖晶石中,Cu(NO3)2·3H2O配制成水溶液,按需要配比直接加入铝溶胶中。
1.3 助催化剂表征
使用Bruker公司D8 ADVANCE型X射线衍射仪对合成尖晶石进行物相结构分析,X射线为CuKα线,扫描范围为10°~80°,扫描步长0.02°,扫描速率12°/min。采用N2物理吸附-脱附实验测定催化剂的孔结构和比表面积,仪器型号为Micromeritics公司的ASAP2020,采用BET公式计算样品的比表面积,采用BJH方法计算孔径分布。采用Perkin-Elmer公司PHI5000C型X射线光电子能谱进行XPS分析,以C1s的结合能(284.6 eV) 作为校正标准。
1.4 催化剂活性评价
采用实验室自制固定床反应装置进行催化剂活性评价[9-10]。催化剂装填量为2 g,颗粒大小为109~150 μm。实验过程中温度设定为30~700℃,升温速率为10℃/min,反应进气为0.12%NO、1%CO、0~0.6%O2,N2平衡,流量为800 mL/min。使用多功能烟气分析仪(ecom-J2KN,RBR)对反应前后气体中NO含量进行在线分析。
1.5 密度泛函(DFT)计算
计算工作基于Materials Studio软件的Dmol3模块,采用广义梯度近似GGA下的Perdw- Burke-Ernzerhof (PBE) 泛函,使用DFT半核芯赝势(DSPP);采用5×5×1的Monkhorst-Pack型K点网格;轨道截断按照半径最大的原子Cu设定,为0.44 nm,为了避免层间原子的相互作用,真空层厚度设置2.0 nm;勾选Spin unrestrict,多重度选为Auto。能量收敛精度1.0×10-5Ha,力收敛精度0.0002 Ha/nm,热拖尾效应Smearing设置为0.001 Ha。
2 结果与讨论
2.1 改性镁铝尖晶石的脱硝性能
镁铝尖晶石及经不同CuO含量改性后的镁铝尖晶石的脱硝性能如图1所示。由图1可见,未经改性的镁铝尖晶石脱硝性能较差,温度高达700℃的条件下,NO转化率(x(NO)=(win(NO)-wout(NO))/win(NO)×100%)仅约为30%。经CuO改性后尖晶石的脱硝性能大幅度提高;NO+CO起始反应温度降低至约200~250℃,450℃后NO转化率均达到100%。改性镁铝尖晶石的脱硝性能随着CuO添加量的增大而提高;当CuO负载量为4%时,NO+CO起始反应温度降低至约220℃,330℃时NO转化率达到100%;当CuO负载量为8%时,改性镁铝尖晶石的脱硝性能不再提高,因而CuO的最优负载量为4%。

图1 CuO改性镁铝尖晶石的脱硝活性Fig.1 DeNOx activity of Mg-Al spinel modified with CuO Reaction conditions: p=101.325 kPa; w(NO)=0.12%; w(CO)=1%
NO的脱除需要还原氛围,而FCC烟气中还含有一定含量的O2,因此需要考察氧含量对4%CuO /Mg2Al2O5脱硝性能的影响,结果见图2。由图2可知,当O2/CO体积比大于0.2时,改性镁铝尖晶石的脱硝性能大幅下降。O2/CO体积比大于0.3后,NO转化率几乎为零,催化剂完全失效。由于CuO同时可催化CO+O2反应,O2优先于NO占据催化剂的活性中心与CO反应,导致NO不能有效脱除。在FCC再生器中,一段再生器的密相床层和二段再生器中的贫氧操作的第一再生器均存在O2含量较低、CO含量较高的还原性氛围,4%CuO/Mg2Al2O5在此区域内可以有效地将NOx脱除。
2.2 改性镁铝尖晶石的分析与表征
CuO改性前后的镁铝尖晶石的孔道结构及比表面积如表1所示。由表1可以看出,经CuO改性后镁铝尖晶石的孔体积、孔径、比表面积随着CuO负载量的增大均有一定程度的下降;但尖晶石仍含有大量的中孔结构和相当的比表面积。CuO改性对镁铝尖晶石的结构影响不大。
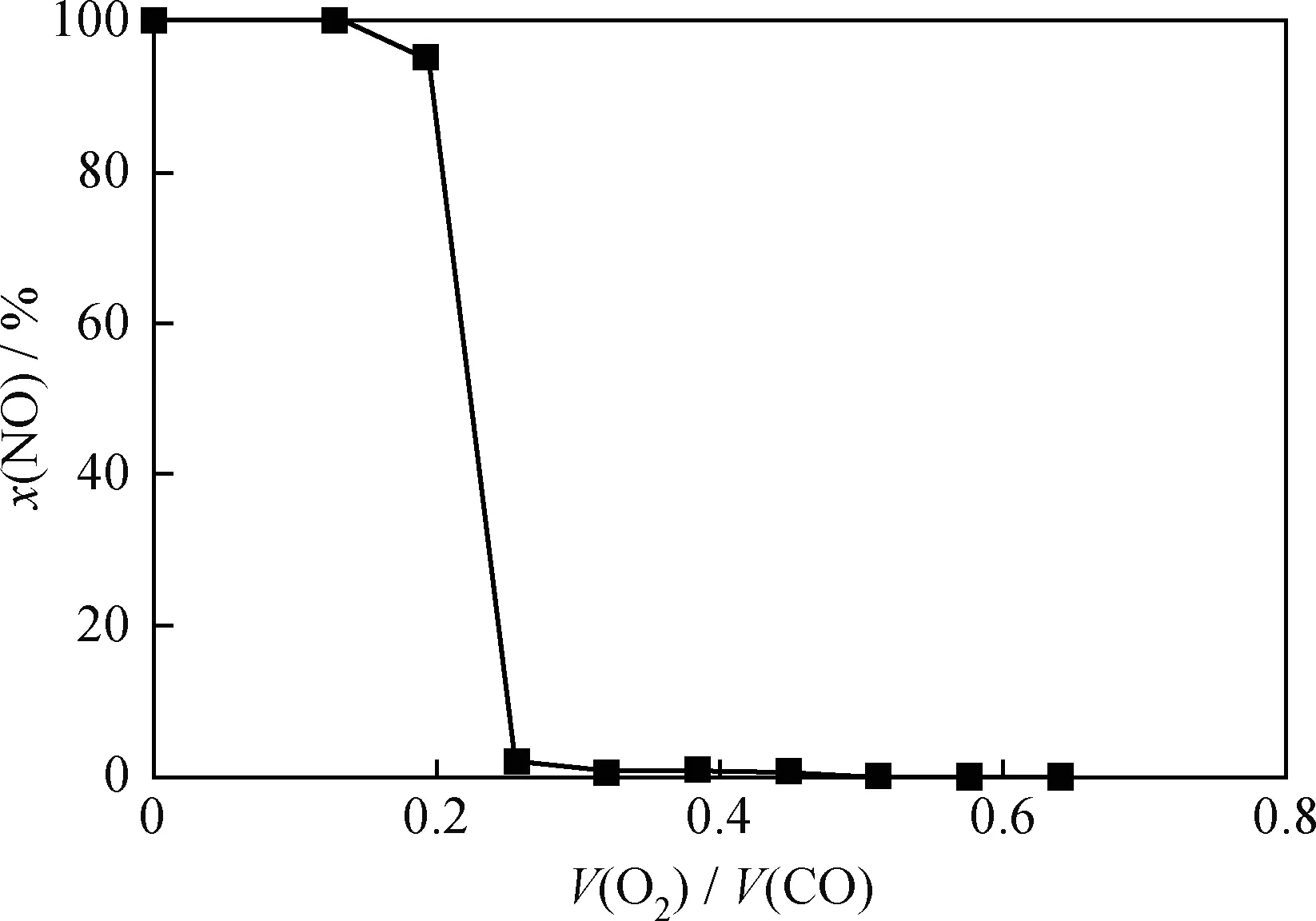
图2 V(O2)/V(CO)对4%CuO/Mg2Al2O5 脱硝性能的影响Fig.2 Effect of V(O2)/V(CO) on DeNOx activity of 4%CuO/Mg2Al2O5 Reaction conditions: T=700℃; p=101.325 kPa; w(NO)=0.12%; w(CO)=1%
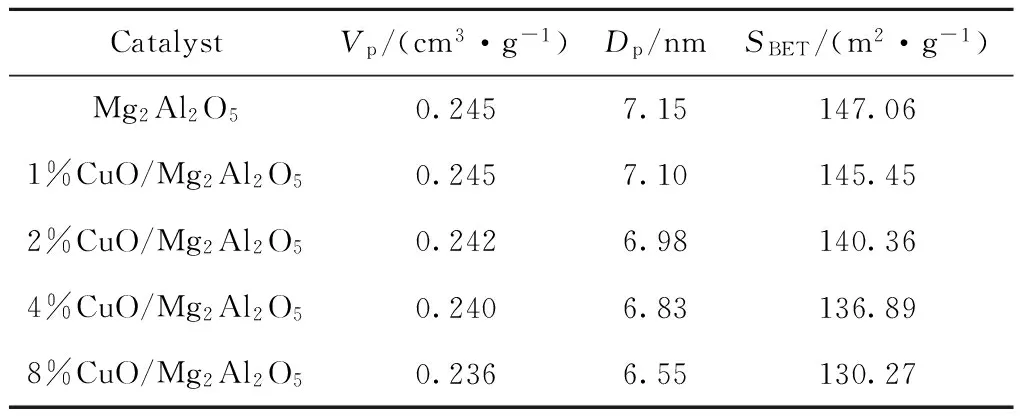
CatalystVp/(cm3·g-1)Dp/nmSBET/(m2·g-1)Mg2Al2O50.2457.15147.061%CuO/Mg2Al2O50.2457.10145.452%CuO/Mg2Al2O50.2426.98140.364%CuO/Mg2Al2O50.2406.83136.898%CuO/Mg2Al2O50.2366.55130.27
CuO改性后的镁铝尖晶石的XRD谱图如图3所示。由图3可以发现,当CuO负载量为2%时,由于CuO良好的分散性,XRD检测不到CuO晶相,CuO高度分散于镁铝尖晶石的表面;当CuO负载量为4%时,镁铝尖晶石中开始能检测到2θ为35.49°、38.69°归属于CuO(002)和(111) 晶面的特征衍射峰;当CuO负载量进一步增加至8%时,CuO的特征衍射峰进一步增强,2θ为48.73°处的CuO(-202)晶面特征衍射峰也能被检测到。CuO负载量为2%时高度分散;当CuO负载量大于4%时,CuO开始团聚烧结成晶体形态;结合脱硝活性来看,当CuO负载量大于4%时,CuO负载量的增加不能使脱硝活性进一步增强;由此可推断,脱硝反应中,起催化作用的主要是高度分散的CuO。
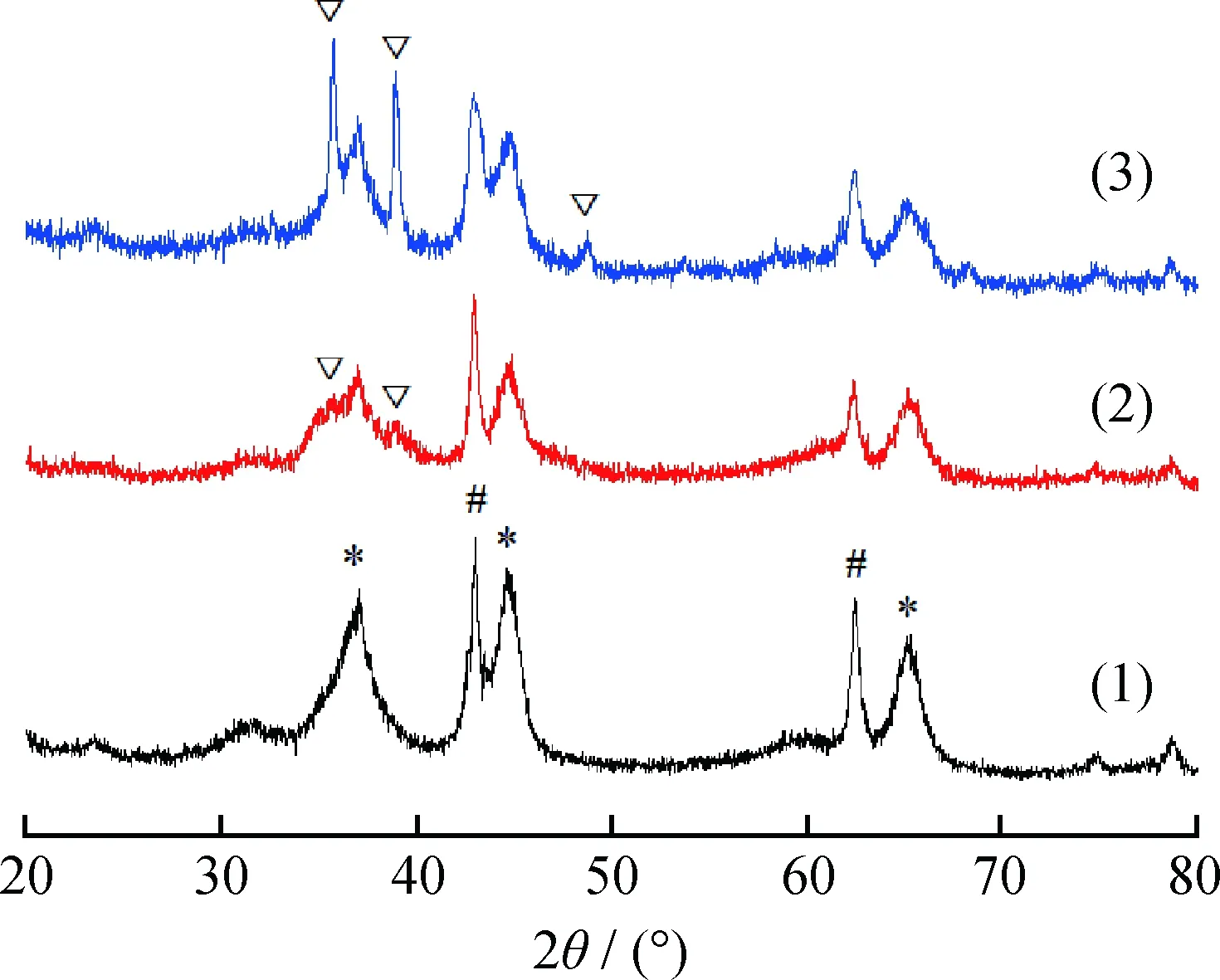
图3 不同CuO负载量镁铝尖晶石的XRD谱图Fig.3 XRD patterns of Mg-Al spinel modified by different contents of CuO (1) 2%CuO/Mg2Al2O5; (2) 4%CuO/Mg2Al2O5; (3) 8%CuO/Mg2Al2O5 Mg-Al spinel; MgO; CuO
为进一步分析高度分散结构CuO中的脱硝活性中心,对不同CuO负载量的镁铝尖晶石中的Cu物种进行了XPS分析,结果如图4所示。由图4可知,Cu2p的XPS信号峰强度随着CuO负载量的增加而增强。Cu2p3/2轨道在结合能933~936 eV处为CuO的特征峰,并伴随约942 eV Cu2p3/2卫星峰,其中结合能在较高的935~936 eV处为八配位的Cu2+(Ⅰ),结合能在934、932.5 eV处分别为四配位的Cu2+(Ⅱ)和一价的Cu+[13]。经空气环境下高温焙烧后,负载的Cu基本上都以CuO的形式存在。但由于与尖晶石载体的相互作用,除常见的四配位的Cu2+(Ⅱ)外,还存在八配位的Cu2+(Ⅰ)和一价的Cu+。其中八配位的 Cu2+(Ⅰ)的存在是由于CuO-MgO固溶体的形成,而Cu+主要存在于尖晶石表面的高度分散结构中。对各样品中归属于不同种类Cu的特征峰进行分峰处理并积分,计算得到各Cu物种的相对含量,结果如表2所示。其中,4%CuO/Mg2Al2O5中一价Cu+的相对含量最高。当CuO负载量超过4%时,过量的CuO团聚烧结成晶体形态,以四配位的Cu2+(Ⅱ)的形式存在。与脱硝活性相对应,说明晶体形态的四配位的Cu2+(Ⅱ)并不是反应的活性中心。改性镁铝尖晶石中Cu+含量越高,镁铝尖晶石脱硝活性越强,由此可推断高度分散结构的Cu+是脱硝反应的活性中心。
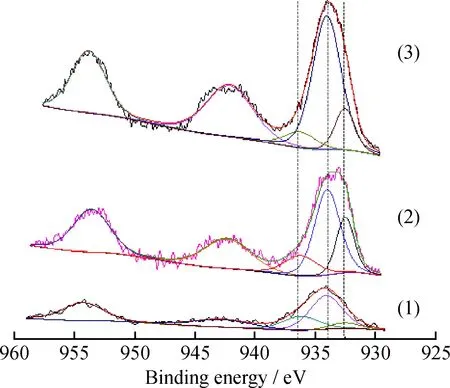
图4 含Cu镁铝尖晶石中Cu的XPS谱图Fig.4 XPS spectras of copper ion in copper-containing Mg-Al spinel (1) 1%CuO/Mg2Al2O5; (2) 4%CuO/Mg2Al2O5; (3) 8%CuO/Mg2Al2O5
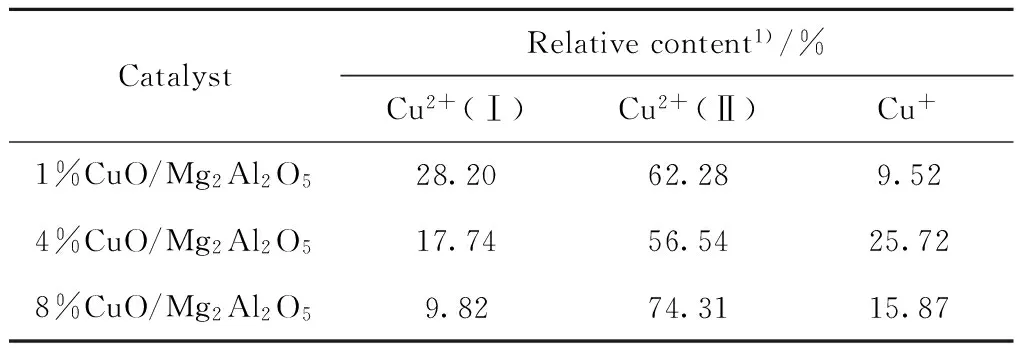
表2 含Cu镁铝尖晶石中不同Cu2p3/2的相对含量Table 2 Relative content of different Cu2p3/2 peaks in copper-containing Mg-Al spinel
1) In CuO
2.3 基于DFT的机理分析
根据2.2节中的表征分析,认为高度分散结构中的Cu+为脱硝反应的活性中心。然而脱硝反应过程活性位Cu+如何发挥作用的机理仍然需进一步分析。因此,基于DFT理论,运用MS软件,对Cu+上的NO+CO过程进行模拟计算。首先,采用广义梯度近似方法研究NO双分子在Cu2O(111)表面吸附的行为,对NO、CO等分子的吸附进行结构优化,并分别对它们的吸附能和Mulliken电荷进行计算,从而得到合理的吸附结构。在此基础上运用Complete LST/QST方法探索反应过渡态。
结合谢海峰[14]根据FCC脱硝助剂反应气体产物分析推断的CO、NO反应方程,并利用Sun等[15]提出的DFT理论计算所得微观吸附模型,推断出NO、CO反应可总结为以下3个反应方程式:
2NO→(NO)2→N2O+Oads
(4)
Oads+CO→CO2
(5)
N2O+CO→N2+CO2
(6)
2.3.1Cu2O模型的构建

图表面结构Fig.5 Surface structure of Cu2O (111)-(2×) (a) Front view; (b) Top view
2.3.2 (NO)2二聚体在Cu2O(111)表面上的吸附和N2O的脱附
Cu2O(111)表面不饱和Cu(图5中Cua)对NO分子的吸附最强,属于潜在的吸附位,因此主要考虑NO双分子在该处吸附的稳定结构,分别计算了Cua+(NO)(NO)、Cua+(NO)(ON)和Cua+(ON)(ON) 3种可能的吸附结构(见图6)。在上述结构中,N—O 键长与自由NO分子(0.1164 nm)相比均有不同程度的增长,表明NO在上述吸附下都发生了一定程度的活化,有利于发生反应。对比这些吸附结构中N—O键长的增加情况和吸附能的大小, (NO)2在以N端吸附时吸附能最大,说明该结构最稳定,这与Sun等[15]的研究结论相一致。
表3为(NO)2在Cu2O(111)表面上吸附的键长、Mulliken电荷传递及吸附能。表3计算数据表明,随着吸附结构变化,N—O键长均有一定的延伸,电荷传递数据也表明(NO)2得到了吸附表面的负电荷,说明(NO)2在Cu2O(111)表面得到活化。随后(NO)2在Cu2O(111)表面发生分解反应,形成吸附态N2O和残余O原子,反应能垒分别为1.067、2.054、0.704 eV,在此过程之后,N2O分子脱附并进入气相中;而残余O原子则吸附在Cu2O(111)表面上,Bogicevic等[19]推断吸附态下的O原子是Cu2O表面氧化失活的重要原因之一,但是体系中的CO会进一步与O原子反应,形成CO2脱离表面,使催化活性得以恢复。通过对O原子在Cu2O(111)表面吸附结构优化,结果显示O原子停留在Cua附近,处于Cua—Ob的桥位或者Cua—Cub的桥位上,吸附能均在2 eV左右,说明表面吸附作用很强,使O原子保持相对稳定的状态。
2.3.3 CO与Cu2O(111)表面上的吸附态O原子反应
在O原子吸附在Cu2O(111)基础上,进一步探讨CO被该O原子氧化的反应过程,首先对CO吸附在Cu2O(111)上的构型进行结构优化,可得到如图7所示的优化构型。表4为CO在Cu2O(111)上吸附的键长、Mulliken电荷传递及吸附能。
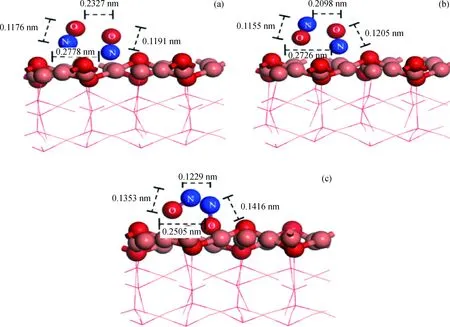
图6 (NO)2二聚体在Cu2O(111) Cua上的吸附构型Fig.6 The adsorption configuration of (NO)2 on Cu2O(111) Cua (a) Cua+(NO)(NO); (b) Cua+(NO)(ON); (c) Cua+(ON)(ON)
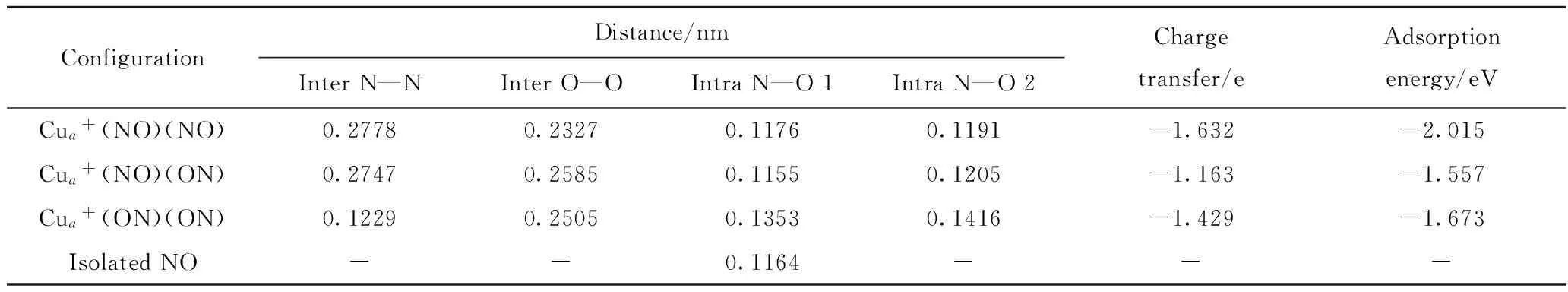
ConfigurationDistance/nmInterN—NInterO—OIntraN—O1IntraN—O2Chargetransfer/eAdsorptionenergy/eVCua+(NO)(NO)0.27780.23270.11760.1191-1.632-2.015Cua+(NO)(ON)0.27470.25850.11550.1205-1.163-1.557Cua+(ON)(ON)0.12290.25050.13530.1416-1.429-1.673IsolatedNO--0.1164---

图7 CO在Cu2O(111)表面的吸附构型Fig.7 Adsorption configuration of CO on Cu2O(111) surface Odis—Surface residual O; (a) CO with Odis on Cua—Ob bridge; (b) CO with Odis on Cua—Cub bridge

ConfigurationDistance/nmInterC—OdisIntraC—OIntraO—OdisChargetransfer/eAdsorptionenergy/eVCOwithOdisonCua—Obbridge0.36750.11420.4165-0.213-0.975COwithOdisonCua—Cubbridge0.38170.11510.4467-0.271-0.843IsolatedCO-0.1142---
由图7以及表4中数据可以看到,CO更倾向于以物理吸附(0.3~0.4 nm)的形式存在于Cu2O(111)上,吸附能也较低。同时由于弱作用,CO倾向于以C端朝向残余O原子,便于带正电的C端进攻带负电的O端。
2.3.4 N2O与CO发生氧化还原气相反应
由于N2O在Cu2O(111)表面的吸附强度并不大,一般认为N2O倾向于在气相中与CO发生反应。因此,计算了多种N2O与CO可能的相互作用结构,并分别进行过渡态搜索。
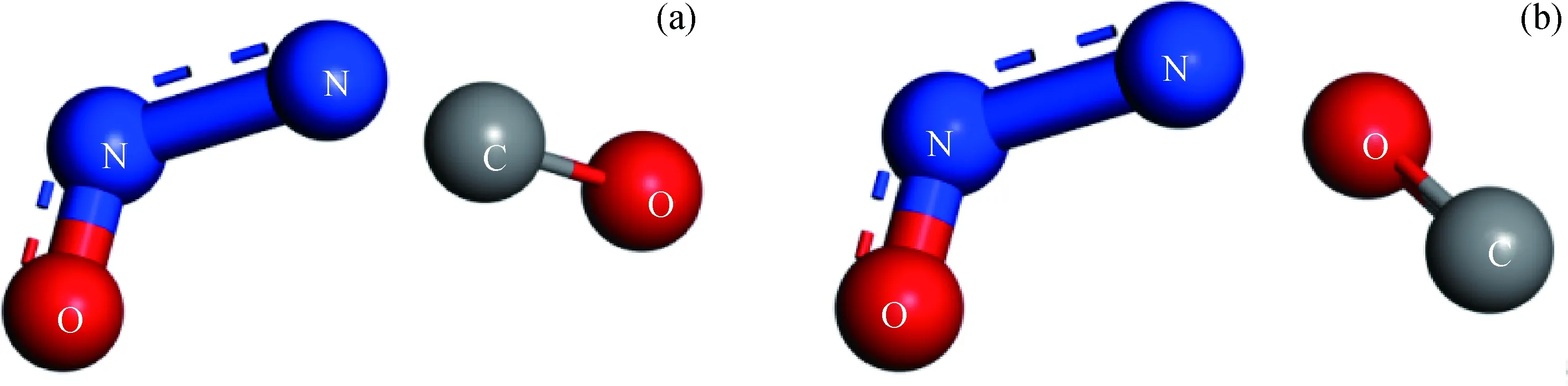
图8 CO、N2O相互作用结构Fig.8 Interaction structure of CO and N2O (a) N of N2O pointing to C of CO; (b) N of N2O pointing to O of CO
计算结果表明,N2O和CO之间存在多种物理吸附结构,分子距离均在0.35 nm以上,2个分子间并没有强烈的相互作用。但是,当N2O的N端正对CO的C端,或N2O的N端正对CO的O端时,则可形成较强的吸附形态,N2O分子发生剧烈扭曲,N—N—O键键角为116.576°,与CO分子一同形成梯形结构,如图8所示。此时N2O分子中N与CO分子的C或O原子距离分别为0.1441和0.1543 nm,通过这2种结构产生的N2和CO2反应能垒分别为0.342和0.760 eV,说明N2O和CO的反应是较容易发生的。
2.3.5 (NO)2、CO在Cu2O(111)表面的反应路径
根据上述提出的反应过程,使用Complete LST/QST方法进行反应过渡态搜索,将所得结果汇总作图如图9所示,图9中短横线表示反应过程中的各个过渡态,各过渡态间的反应能垒也相应标注。图9中横坐标将总反应分解为区间;纵坐标为能量坐标,单位为eV,图9中标记数据均为对应体系下原子间结合能的能位值。
下文所述能垒计算公式如下:
ΔE=E2-E1
其中,ΔE为反应能垒,eV;E1、E2为反应前、后体系能位值,eV。
过程以Cu2O(111)完整表面和2个NO分子能量之和为能量零点,在图9中2NO→(NO)2过程,NO分子在Cu2O上形成稳定吸附下的(NO)2二聚体,分别为Cua+(NO)(NO)、Cua+(NO)(ON)和Cua+(ON)(ON),吸附能分别为-2.015、-1.557和-1.673 eV,随后发生(NO)2在Cu2O(111)表面分解的反应,即(NO)2→N2O+Oads,生成吸附态下的N2O分子和1个残余O原子,反应能垒分别为1.067、2.054、0.704 eV,生成的吸附态残余O原子可以较稳定地吸附在Cua周围Cua—Obbridge位上。随即CO以物理吸附的形式吸附在该残余O原子上方,吸附能分别为-0.975和-0.843 eV。随后如Oads+CO→CO2的反应,CO分子在Cu2O(111)表面反应,生成CO2后脱附,并重新形成了Cu2O(111)清洁表面,该步反应的能垒根据残余Odis位置不同稍有变化,分别为0.944、1.038 eV。脱附的N2O分子在气相中与CO反应生产N2和CO2的过程如2.3.4节所述,反应能垒分别为0.342、0.760 eV。
综上所述,通过DFT结合周期性平板模型的方法,系统研究了在Cu2O(111)表面上NO、CO的反应过程。讨论了相关的反应能垒、反应热以及每一基元反应中过渡态的构型。根据计算结果,将整个反应路径分成吸附、反应和脱附区段,分别计算能量最高点与每阶段起始能量差值。结果表明,如果以Cua+(NO)(NO)为起点,则CO氧化为CO2过程能量差值最大为1.406 eV,应为速率控制步骤;若以Cua+(NO)(ON)或Cua+(ON)(ON)为起点,则(NO)2分解成N2O的过程能量差值最大为1.708 eV,为速率控制步骤。
分析NO和CO在无催化剂条件下发生孤立分子气相反应。可以认为NO和CO在气相中反应如下所示:
2NO→(NO)2
(7)
(NO)2+CO→N2O+CO2
(8)
通过模拟(NO)2与CO的反应,可以得到反应能垒约为2.143eV。将NO与CO分子反应在Cu2O(111)表面和在气相中的反应对比,可以看出,NO、CO在Cu2O(111)上的表面催化反应相比气相反应,由于发生(NO)2在Cu2O(111)表面解离出O原子以及CO分子与表面吸附的O原子反应而产生2个反应过渡态,同时气相反应由于没有表面作用,因此形成的(NO)2二聚体很难发生自分解,导致CO只能直接进攻(NO)2分子,会产生较大的空间位阻作用,导致反应活化能的升高。因此可以认为,Cu2O(111)表面的作用为促进(NO)2解离O原子的过程,从而减弱了CO进攻该O原子时的空间位阻效应。
2.4 CuO改性镁铝尖晶石助催化剂的工业应用考察
在中国石化清江石油化工分公司500 kt/a重油催化裂化装置上,考察了CuO改性镁铝尖晶石助催化剂的脱硝效果。该装置在2010年进行了MIP技术改造;使用中国石化齐鲁催化剂公司GOR-Ⅱ型催化剂,装置系统催化剂藏量105 t,单耗平均1.03 kg/t;装置进料为江苏油田原油与海洋油混炼的常减压渣油,原料硫质量分数0.42%,氮质量分数0.37%。使用CuO改性镁铝尖晶石助催化剂在不影响装置处理量的前提条件下提高烟气的脱硝效果,委托江苏常青树新材料科技有限公司进行工业放大,助催化剂添加量定为5%。
2.4.1 烟气中NOx含量的变化
试用助催化剂前,首先对装置烟气中NOx含量进行了空白标定。在7 d时间内,烟气NOx质量分数在630~690 μg/g范围波动,平均NOx质量分数为656 μg/g。然后分2个阶段开始注入CuO改性镁铝尖晶石助催化剂。第一阶段7月15日至7月29日,为快速加入期。快速注入阶段计划为15 d,助催化剂加入量为180 kg/d,与催化剂混加。快速加入期结束后进入第二阶段平稳加入期,即保持平稳小量加入助催化剂,从7月30日开始至9月25日结束,助催化剂加入量为75 kg/d,装置工况不变,运行平稳。
图10为使用CuO改性镁铝尖晶石助催化剂后烟气中NOx含量。由图10可知,在助催化剂快速注入阶段(7-15至7-30),烟气中NOx质量分数显著下降至200 μg/g左右;此后,由于进料含氮的波动变化,烟气中NOx质量分数在200 μg/g左右波动。总体来说,使用CuO改性镁铝尖晶石助催化剂前后再生烟气中的NOx含量变化明显,NOx质量分数从约650 μg/g降低到190 μg/g左右,脱除率达到约70%。
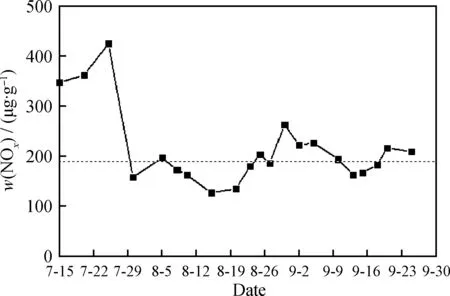
图10 使用CuO改性镁铝尖晶石助 催化剂后烟气中NOx含量Fig.10 NOx content in FCC fuel gas after using co-catalyst
2.4.2 产物分布及质量分析
使用CuO改性镁铝尖晶石作为FCC烟气脱硝助催化剂前后,中国石化清江石油化工分公司重油FCC装置的产物分布如表5所示,各产物收率均在正常范围内波动,使用该助催化剂对产物分布无不良影响。

表5 CuO改性镁铝尖晶石助催化剂对产物分布的影响Table 5 Effect of CuO modified Mg-Al spinel co-catalyst on product distribution
使用CuO改性镁铝尖晶石助催化剂对FCC主要产品质量的影响如表6~8所示。可以看出,使用CuO改性镁铝尖晶石助催化剂后,中国石化清江石油化工分公司FCC汽油的烯烃质量分数为 39%~42%,芳烃质量分数为15%~16%,研究法辛烷值为90~91,均在正常生产范围内波动;柴油馏程、液化气组成也均在正常范围内波动。使用CuO改性镁铝尖晶石助催化剂对FCC主要产品质量无不良影响。
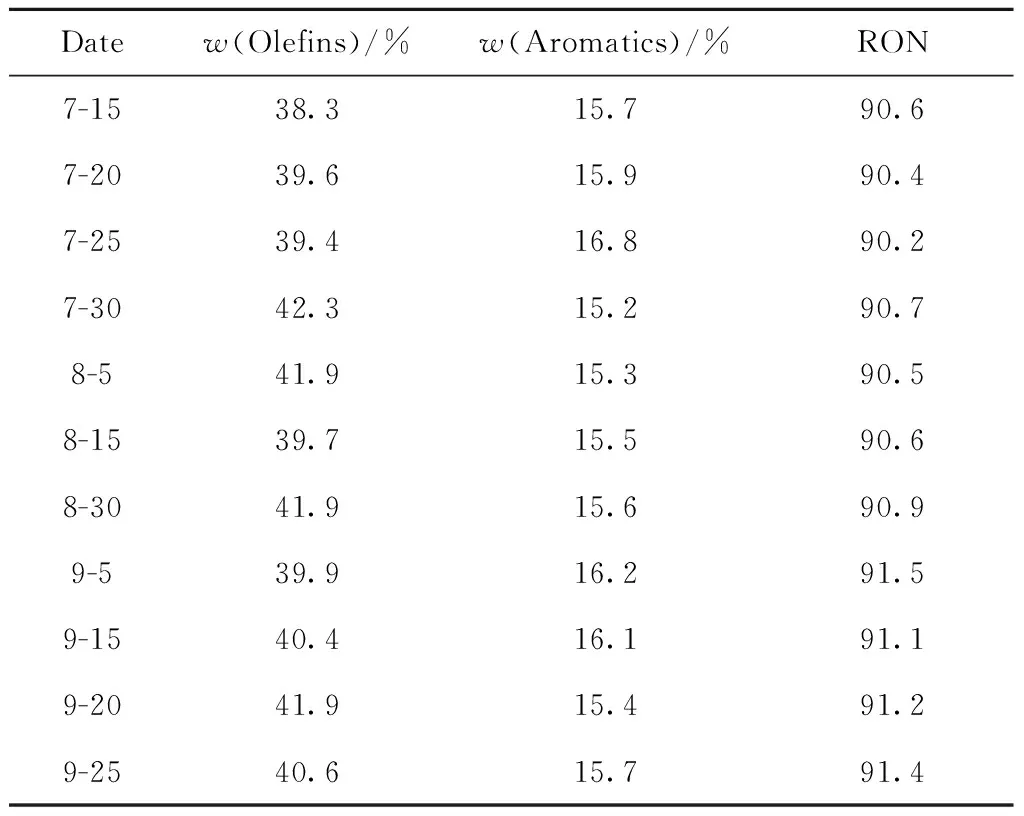
表6 使用CuO改性镁铝尖晶石助催化剂对 FCC汽油性质的影响Table 6 Effect of CuO modified Mg-Al spinel co-catalyst on FCC gasoline properties
2.4.3 助催化剂对FCC平衡催化剂颗粒分布的影响
使用CuO改性镁铝尖晶石助催化剂对FCC平衡催化剂颗粒分布的影响如表9所示。由表9数据可以发现,使用CuO改性镁铝尖晶石脱硝助剂后,对装置平衡剂颗粒分布没有影响,装置在操作过程中也没有引起流化异常等不良情况。此外,再生后催化剂中碳质量分数在0.05%左右(正常范围内)波动,使用CuO改性镁铝尖晶石助催化剂也不会对主催化剂的再生产生不良影响。
3 结 论
(1)使用CuO对镁铝尖晶石进行改性以提高其脱硝性能,CuO负载量(质量分数)为4%时效果最优,330℃时NO转化率达到100%。通过表征分析发现,CuO负载量超过4%时开始发生烧结成晶体形态,高度分散态的Cu+是还原反应的活性中心。
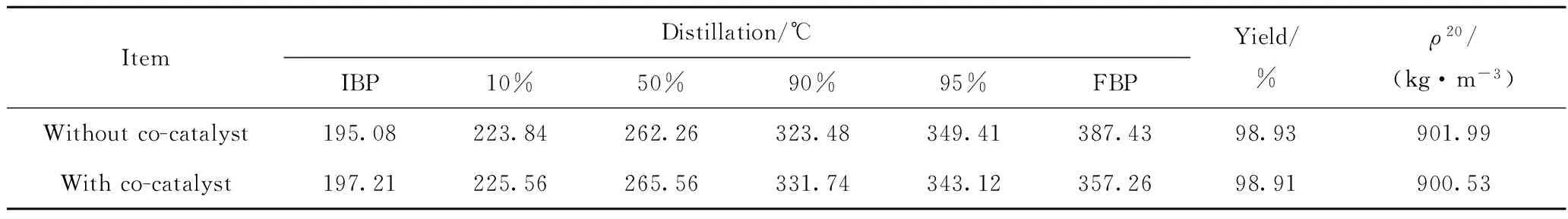
表7 使用CuO改性镁铝尖晶石助催化剂对FCC柴油性质的影响Table 7 Effect of CuO modified Mg-Al spinel co-catalyst on FCC diesel properties

表8 使用CuO改性镁铝尖晶石助催化剂对FCC液化气组成的影响Table 8 Effect of CuO modified Mg-Al spinel co-catalyst on FCC liquefied gas composition

表9 使用CuO改性镁铝尖晶石助催化剂对FCC平衡催化剂颗粒分布及碳含量的影响Table 9 Effect of CuO modified Mg-Al spinel co-catalyst on particle size distribution and C contents of FCC equilibrium-catalyst
(2)基于密度泛函理论的模拟研究表明,Cu+活性中心促进了(NO)2解离O原子的过程,从而减弱了CO进攻该O原子时的空间位阻效应。NO在Cu+上的双分子吸附和分解降低了还原反应的反应能垒,是催化CO还原NO的关键。
(3)CuO改性镁铝尖晶石助催化剂在中国石化清江石油化工分公司500 kt/a重油催化裂化装置上使用结果表明,烟气中的NOx脱除率达到约70%。
[1] BABICH I V, SESHAN K, LEFFERTS L. Nature of nitrogen specie in coke and their role in NOxformation during FCC catalyst regeneration[J].Applied Catalysis B:Environmental, 2005, 59: 205-211.
[2] 王龙延, 朱建华, 焦云, 等. FCC再生烟气中NOx生成的热力学[J].石油学报(石油加工), 2003, 19(6): 8-15. (WANG Longyan, ZHU Jianhua, JIAO Yun, et al. Thermodynamic analysis on NOxformation in FCC regeneration flue gas[J].Acta Petrolei Sinica (Petroleum Processing Section), 2003, 19(6): 8-15.)
[3] LI Jun, LUO Guohua, WEI Fei. A multistage NOxreduction process for a FCC regenerator[J].Chemical Engineering Journal, 2011, 173(2): 296-302.
[4] LI Teng, YANG Chaohe, CHEN Xiaobo, et al. The correlation between nitrogen species in coke and NOxformation during regeneration[J].Chinese Journal of Chemical Engineering, 2016, 24(5): 606-611.
[5] USBERTI N, JABLONSKA M, BLASI M D, et al. Design of a “high-efficiency” NH3-SCR reactor for stationary applications—A kinetic study of NH3oxidation and NH3-SCR over V-based catalysts[J].Applied Catalysis B: Environmental, 2015, 179: 185-195.
[6] JAVED M T, IRFAN N, GIBBS B M. Gibbs control of combustion-generated nitrogen oxides by selective non-catalytic reduction[J].Journal of Environ Manage, 2007, 83(3): 251-289.
[7] 郭大为, 张久顺, 梁彬, 等. 催化裂化烟气脱硫、脱氮吸附剂的初步研究[J].石油学报(石油加工), 2011, 27(2):192-197. (GUO Dawei, ZHANG Jiushun, LIANG Bin, et al. Primary investigations of adsorbents for removal of sulfur oxides and nitrogen oxides from catalytic cracking flue gas[J].Acta Petrolei Sinica (Petroleum Processing Section), 2011, 27(2): 192-197.)
[8] ILIEVA L, PANTALEO G, VELINOV N, et al. NO reduction by CO over gold catalysts supported on Fe-loaded ceria[J].Applied Catalysis B: Environmental, 2015, 174-175: 176-184.
[9] PI Zhipeng, SHEN Benxian, ZHAO Jigang, et al. CuO, CeO2modified Mg-Al spinel for removal of SO2from FCC flue gas[J].Industrial & Engineering Chemistry Research, 2015, 54(43): 10622-10628.
[10] 皮志鹏, 沈本贤, 刘纪昌, 等. 铜铈改性提高催化裂化烟气脱硫助催化剂性能研究[J].石油炼制与化工, 2016, 47(3): 36-41. (PI Zhipeng, SHEN Benxian, LIU Jichang, et al. Cu/Ce modified catalyst additive for removal of SO2from FCC flue gas[J].Petroleum Processing and Petrochemicals, 2016, 47(3): 36-41.)
[11] 许孝玲, 冉晓利, 崔秋凯, 等. 催化裂化增产丙烯和烟气脱硫双功能助剂的热和水热稳定性[J].石油学报(石油加工), 2010, 26(6): 852-858. (XU Xiaoling, RAN Xiaoli, CUI Qiukai, et al. Thermal and hydrothermal stability of bifunctional additives for improving propylene yield and SOxremoval of FCC flue gas[J].Acta Petrolei Sinica (Petroleum Processing Section), 2010, 26(6): 852-858.)
[12] ZHANG Haijun, JIA Xiaolin, YAN Yongjie, et al. The effect of the concentration of citric acid and pH values on the preparation of MgAl2O4ultrafine powder by citrate sol-gel process[J].Materials Research Bulletin, 2004, 39(6): 839-850.
[13] CONTARINI S, KEVAN L. X-ray photoelectron spectroscopic study of copper-exchanged X- and Y-type sodium zeolites: Resolution of two cupric ion components and dependence on dehydration and X-irradiation[J].Journal of Physics Chemical, 1986, 17(32): 1630-1632.
[14] 谢海峰. 烟气脱硝助剂在催化裂化装置上的应用[J].石油炼制与化工, 2014, 45(6): 59-62. (XIE Haifeng. Appilication of denitrification additive for reduction of NOxin FCC regenerated flue gas[J].Petroleum Processing and Petrochemicals, 2014, 45(6): 59-62.)
[15] SUN B Z, CHEN W K, WANG X, et al. A density functional theory study on the adsorption and dissociation of N2O on Cu2O(111) surface[J].Applied Surface Science, 2007, 253(18): 7501-7505.
[16] LIU D, ZHU Y F, JIANG Q. DFT study of CO oxidation on Cu2O-Au interfaces at Au-Cu alloy surfaces[J].Rsc Advances, 2015, 5(2): 1587-1597.
[17] 吴欢文. Cu2O(111)表面电子结构性质及CO2在此表面的吸附与活化的量子化学研究[D].南昌: 南昌大学, 2012.
[18] ZHANG R, LIU H, LI J, et al. A mechanistic study of H2S adsorption and dissociation on Cu2O(111) surfaces: Thermochemistry, reaction barrier[J].Applied Surface Science, 2012, 258(24): 9932-9943.
[19] BOGICEVIC A, HASS K C. NO pairing and transformation to N2O on Cu(111) and Pt(111) from first principles[J].Surface Science, 2002, 506(1-2): 237-242.
