过碳酰胺促进土壤中有机氯农药的降解
2018-03-05王鸿显胡兰萍
曹 文,郁 伟,王鸿显,胡兰萍
(1.南通大学图书馆,江苏南通 226019;2.江苏省南通市土壤肥料站,江苏南通 226006;3.南通大学化学化工学院,江苏南通 226019)
我国是农业大国,农药使用量大,应用广泛,从20世纪50年代开始使用有机氯农药(OCPs),70年代达到了使用高峰期,1985年开始我国禁止使用OCPs,OCPs在我国连续使用了30多年[1-3]。据统计,地上部喷施农药时仅有10%~15%的农药真正作用于有害生物,其余大部分农药残留于土壤中,直接造成土壤污染[4]。OCPs是被斯德哥尔摩公约列入黑名单的一类持久性有机污染物(POPs),由于OCPs性质稳定、难以降解、高毒性、脂溶性大、能够长期残留在土壤中、一些新的OCPs污染源又不断产生[5],因此,OCPs不可能短时间内在土壤中完全降解。在植物生长过程中,OCPs可以在植物体中富集[6],很多地区的粮食和油料中六六六(HCHs)和滴滴涕(DDTs)的检出率较高,这就是OCPs污染的特征[7]。受到污染的农作物最终会通过食物链对人类产生“三致”(致癌、致畸、致突变)作用[8],因此,治理土壤中持久性有机污染已成为研究的热点问题之一。根据已有报道,治理OCPs污染的方法可分为三大类:生物降解、物理降解和化学降解[9],但这些治理技术还处在试验研究阶段,应用于大面积农田土壤中降解OCPs还很困难。在土壤中施入化学肥料,既能降解有机污染物,同时还能改良土壤并促进农作物的生长,这是人们共同的愿望。
过碳酰胺[CO(NH2)2·H2O]兼具尿素和过氧化氢的性质,能溶于水,无毒无污染,是一种新型氮肥[10]。过碳酰胺施入土壤能释放出单质氧、原子氧、自由基等,具有良好的氧化作用,它不仅可为农作物提供丰富的氮肥(含氮量为 25.5%),还可为植物的根部提供氧[10],而且氧化降解土壤中有机污染物具有独特的优越性。已有研究报道,过碳酰胺可以降解土壤中有机污染物[11],但室外自然条件下应用Fe2+作为催化剂氧化降解土壤中OCPs的研究鲜见报道。因此,研究过碳酰胺在室外自然条件下降解土壤中OCPs污染物的影响因素和效率具有较好的现实意义和应用前景。本试验通过模拟自然环境条件,应用自制的新型氮肥(过碳酰胺)降解土壤中持久性的OCPs污染物,以期为农田土壤中去除OCPs的应用研究提供参考。
1 材料与方法
1.1 试验材料
1.1.1 主要仪器 Agilent 6890N气相色谱仪,购自安捷伦科技(中国)有限公司;SHB-D(Ⅲ)不锈钢型真空泵,购自河南宇科自动化仪器仪表设备有限公司;SJB-S450电动搅拌机,购自上海世赫机电设备有限公司;GL-21MC湘仪台式高速离心机,购自湖南湘仪离心机仪器有限公司;UH600超声波萃取仪,购自上海欧河机械设备有限公司;N150-1氮吹浓缩仪,购自上海博翎仪器设备有限公司。
1.1.2 试验试剂 过碳酰胺[CO(NH2)2·H2O2],自制;二氯甲烷、丙酮、正己烷,均为分析纯,均购自广东省汕头市西陇化工有限公司;硫酸亚铁铵(分析纯),购自山东济宁恒泰化工有限公司;无水乙醇(分析纯),购自上海振兴化工一厂;六六六、滴滴涕、七氯、艾氏剂、狄氏剂、硫丹等有机氯农药标准物质,均购自德国Dr.Ehrenstofer公司。
1.2 试验方法
1.2.1 试验土壤的采集和污染土壤样品的制备 试验土壤采集于江苏省南通市所属的5个县(市、区)的20世纪70、80年代长期种植棉花的田块,每个取土区采用多点取样法,采集0~30 cm 的土壤。把采集到的土壤在实验室冷冻干燥后,研磨成粉状过40目筛后装入密封袋保存备用。
通过多次气相色谱法分析,采集的土壤样品中有机氯农药七氯、艾氏剂、狄氏剂、硫丹等的检出率不高,且残留量较低,低于国家一级土壤标准(GB 15618—2008《土壤环境质量标准(修订)》),HCHs、DDTs的检出率分别是50%、100%,因为这2类有机氯农药使用时间长,性质稳定,较难降解,可以长期残留在土壤中。因此在进行降解试验时,为了简化试验,只制备了被DDTs、HCHs污染的土壤样品。
称取一定量已冷冻干燥的过40目筛的土壤样品放入试验用搪瓷托盘中,准确加入一定量的含有机氯农药标准物质(异构体混合物)的丙酮溶液,使土壤样品中有机氯农药浓度为0.02 g/kg,充分搅拌均匀并铺开成薄层,于通风厨中自然干燥24 h。取出干燥后的样品反复研磨后,在搪瓷托盘中铺开成薄层放入真空干燥箱低温干燥12 h,取出后研磨再干燥,直至恒质量,除尽丙酮,然后过60目筛封装备用。
1.2.2 新型氮肥过碳酰胺的制备 应用湿法工艺制备过碳酰胺[12-13],即采用30%过氧化氢与饱和的尿素溶液反应,添加1.5%(相对于30%过氧化氢溶液)稳定剂,反应温度控制为(10±1)℃,反应50 min后减压过滤、真空干燥得到产品过碳酰胺,母液循环使用。应用化学分析法测定过氧化氢含量,所制备产品达到了优级标准。
1.2.3 土壤样品中有机氯农药的降解试验
1.2.3.1 过碳酰胺在不同时间内对有机氯农药降解的试验 取8个已编号的250 mL锥形瓶,各放入10 g受污染土壤样品,加入5 mL 24 g/L新型氮肥溶液,适当加入一定量蒸馏水充分拌匀,使土壤的湿度为90%。将锥形瓶置于自然通风的试验棚中,每天注意观察并适当补充水分,放置5、10、15、20、25、30、35、40 d后取出测定有机氯农药的降解率。为了使试验研究的重现性和数据的准确性更好,做空白对照试验,每个处理3次重复。
1.2.3.2 加入Fe2+降解土壤样品中有机氯农药 在降解试验中加入Fe2+可以提高有机氯农药的降解速率和效率,为了研究不同用量的Fe2+对降解率的影响,设置2种不同条件的试验[14-15]。(1)取6个已编号的250 mL锥形瓶,各放入10 g含有机氯农药的污染土壤样品,加入一定体积24 g/L新型氮肥过碳酰胺溶液,再分别加入6、5、4、3、2、1 mL 2 mmol/L硫酸亚铁铵溶液,加入蒸馏水使土壤的湿度达到100%。做空白对照试验,每个处理3次重复,在通风的试验棚中分别放置1、2、3、4、5、6 d后取出土壤样品测定有机氯农药的降解率。(2)应用上述完全相同的试验方法,且使土水质量比分别为 1 ∶1、1 ∶2、1 ∶3、1 ∶4、1 ∶5、1 ∶6,制成泥浆形式,充分搅拌后,降解1、2、3、4、5、6 d后测定有机氯农药的降解率。
1.2.3.3 土壤中有机氯农药的提取和测定 取出在试验棚中放置一定时间盛有土壤样品的锥形瓶,加入60 mL正己烷,在电动搅拌机上快速搅拌40 min,然后应用超声波萃取仪恒温30 ℃超声萃取15 min,倒入100 mL离心管中,4 500 r/min离心5 min,取上层清液。同样方法对残渣再萃取2次,合并萃取液转移至250 mL分液漏斗中,静置20 min后去除下层少量水分,萃取液经过无水Na2SO4层重复2次除水,使用氮吹仪浓缩至0.5 mL,用正己烷定容至1 mL。用一定体积的正己烷丙酮(体积比为9 ∶1)溶液洗涤Florisil固相萃取小柱,将浓缩液过小柱净化。再用正己烷丙酮(体积比为9 ∶1)溶液淋洗Florisil小柱,接收10 mL淋洗液,使用氮吹仪浓缩至1.0 mL待测。
应用气相色谱仪测定污染土壤样品中有机氯农药的残留量[16-17],色谱条件:DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm),进样口温度为280 ℃,载气(氦气)恒流量为 1.0 mL/min,柱初始温度为120 ℃,保持2 min,以10 ℃/min升温至270 ℃,再以5 ℃/min升温至290 ℃,保持10 min,自动进样器进样量1 μL,采用外标法定量测定。
为了检验该测定方法的准确性,进行加标回收试验,回收率在87%~106%范围内,根据试验数据计算线性范围在 0.005~0.100 mg/kg之间,满足残留分析的要求。
1.2.4 自然农田土壤中有机氯农药的降解试验 采用“1.2.3.1”“1.2.3.2”节中的试验方法,不同的是试验土壤中不再加入有机氯农药标准物质,研究不同浓度的过碳酰胺在Fe2+的催化作用下对自然农田土壤中残留的有机氯农药的降解效率。
2 结果与分析
2.1 不同过碳酰胺加入量在不同降解时间内对降解率的影响
不同过碳酰胺加入量对土壤中有机氯农药的降解率有明显的影响。为了探讨过碳酰胺的加入量对土壤中有机氯农药降解率的影响,本试验研究了在50 d后不同过碳酰胺加入量对有机氯农药降解率的影响。由表1可知,随着过碳酰胺加入量的增加土壤中有机氯农药的降解率增大,当过碳酰胺加入量超过一定值时,降解率几乎没有增加。因此,过碳酰胺的最适加入量为12 g/kg。在此基础上重点研究了污染土壤样品的降解时间对土壤中有机氯农药降解率的影响。由图1和图2可知,达到最高降解率的时间约为25 d。过碳酰胺的施入对土壤中2种有机氯农药有不同程度的降解作用。过碳酰胺是尿素和过氧化氢的加合物,施入土壤后,其中的过氧化氢会逐渐分解,并释放出单质氧和氧原子,少部分过氧化氢在土壤中微量金属离子的作用下还会产生氧化性较强的自由基(·OH)[17],因此,过碳酰胺对土壤中的有机氯农药有一定的降解作用。分析2种有机氯农药的降解率发现,过碳酰胺对DDTs的降解率较高。从DDTs和HCHs的分子结构分析,HCHs是六氯环己烷,性质稳定,不易被氧化。DDTs是三氯乙烷基和2个氯苯对位相连,氯原子的诱导效应可能会使DDTs的化学反应活性高于HCHs,因此,在相同条件下DDTs的降解率较高。但总的看来,2种有机氯农药的降解率都不高,欲提高有机氯农药的降解率,必须改变过碳酰胺的施用方法,提高过碳酰胺中过氧化氢的反应活性。
2.2 不同Fe2+加入量对降解率的影响
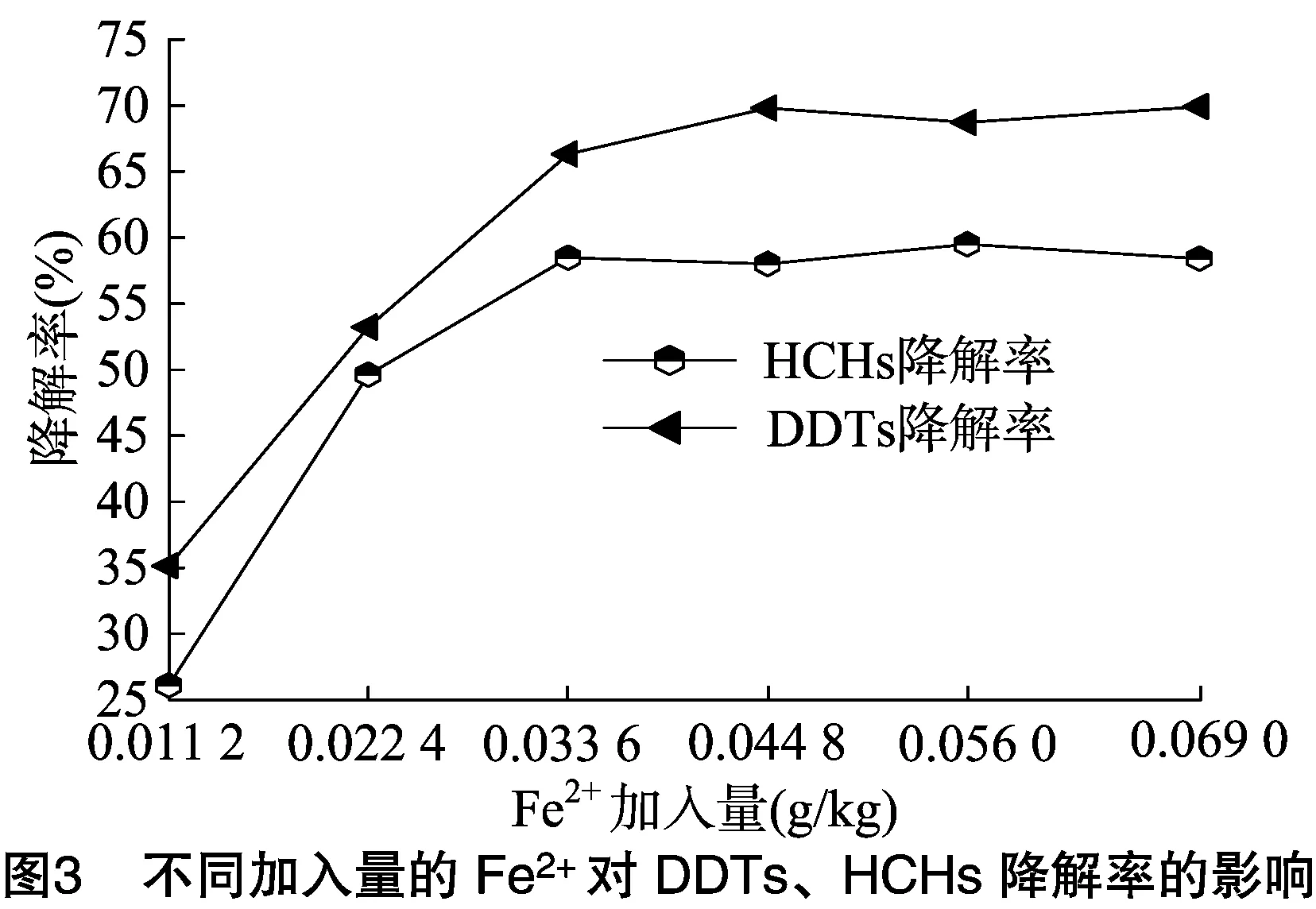
根据文献[18]所述过氧化氢和金属离子的作用特征,在试验中作了加入Fe2+的对比试验,发现加入少量Fe2+作催化剂明显提高了HCHs、DDTs的降解率,因此对Fe2+的加入量作进一步的研究。过碳酰胺施入土壤后,会平缓地释放出过氧化氢,加入一定量的Fe2+后,可以使过碳酰胺中过氧化氢的释放和分解速度加快,重要的是过碳酰胺释放出的过氧化氢可以与Fe2+组成类似Fenton的体系[19]。由于Fe2+的催化作用,过氧化氢在分解过程中会产生氧化性更强的自由基(·OH、·O2H、·O2等)。这些自由基氧化性较强,如·OH的电极电势为·OH+H++e-=H2O,φθ=2.80 V,其氧化能力与氟相当,而且反应后不会带来新的杂质。因此,新型氮肥在Fe2+的催化作用下产生的多种自由基可以使土壤中有机氯农药或持久性有机污染物逐级氧化降解成为CO2、H2O等无毒的小分子化合物[20]。Valderrama等用过氧化氢与一定浓度的Fe2+组成混合体系降解土壤中持久性有机污染物多环芳烃,并取得了成效[21]。研究发现,相同浓度的过氧化氢与不同浓度的Fe2+组成的混合体系对有机氯农药的降解率是不同的,因为Fe2+是催化剂又参与化学反应,不同的有机物氧化降解机理不同,所需的Fe2+浓度也不相同[14-15]。根据“2.1”节中确定的降解DDTs、HCHs所需的最适过碳酰胺浓度,对土壤中Fe2+的使用量及不同的土水质量比例进行研究。
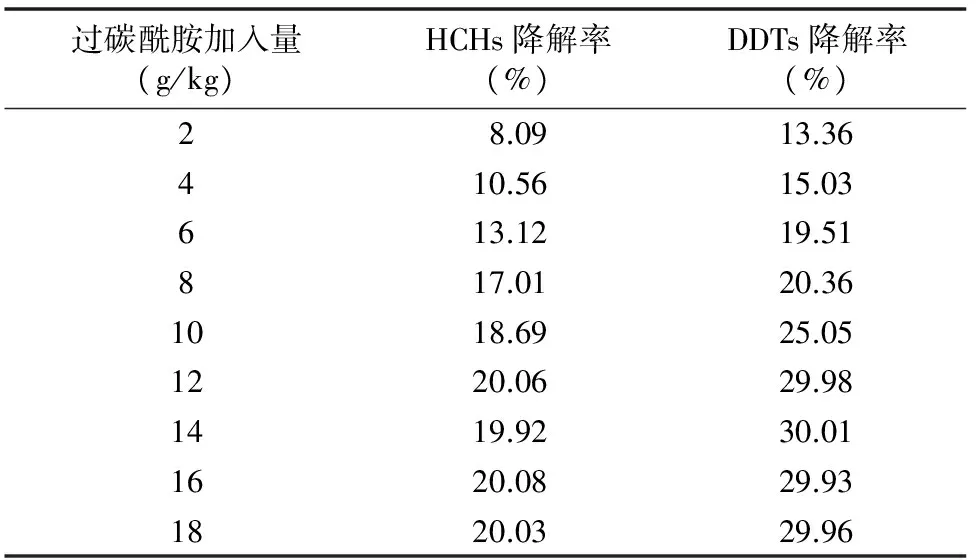
表1 不同过碳酰胺加入量对HCHs、DDTs降解率的影响


过碳酰胺浓度为12 g/kg、土壤湿度达到100%时,污染土壤样品中DDTs、HCHs降解超过3 d时,降解率几乎没有增加,因此,3 d为降解过程的最适时间。由图3可知,Fe2+的加入量增大,DDTs、HCHs的降解率明显升高,当Fe2+的加入量超过0.044 8 g/kg时,DDTs、HCHs的降解率几乎没有增加,因此,Fe2+的最优加入量是0.044 8 g/kg,在此条件下DDTs的降解率比HCHs的降解率高11.5%。由于DDTs属于含有苯环和三氯乙基的烯烃类分子,降解率高于HCHs是符合分子结构特征的。
在确定了过碳酰胺和Fe2+最优加入量的基础上,在不同土水质量比的条件下,DDTs、HCHs降解3 d的试验结果如图4所示,随着土水质量比的增大,DDTs、HCHs的降解率升高,原因是土水质量比增大,污染土壤样品成为泥浆形式更有利于Fenton体系的形成,·OH等自由基与有机氯分子接触的机会增加,氧化降解率明显提高。在土水质量比达到1 ∶3、1 ∶4,过碳酰胺和Fe2+为最优加入量的条件下,DDTs、HCHs的降解率高出图3过碳酰胺和Fe2+为最优条件下约10%,继续增加水土质量比其降解率提高不大。虽然增大土水质量比有利于提高DDTs、HCHs的降解率,但在实际应用过程中会受到限制,因为过碳酰胺作为氮肥施入农田土壤时很难达到土水质量比在1 ∶3及以上的泥浆形式。但在土壤湿度为100%的条件下,虽然降解率偏低,作为底肥多次施用过碳酰胺并进行灌溉可以去除土壤中有机氯农药。
Fe2+是有机氯农药降解的有效催化剂,不仅可以明显提高其降解率,还能使降解时间大幅度缩短。少量的Fe2+留在土壤中形成氧化物具有一定的表面活性,对有毒有害的无机污染物具有较好的净化功能,对有机污染物也具有降解作用,起到了修复土壤的作用[22-23]。但Fe2+浓度不能过大,试验结果表明,过多的Fe2+起不到催化作用,大量的Fe2+留在土壤中不仅形成浪费,对土壤也有可能产生不良的影响。

2.3 不同条件对农田土壤中残留的DDTs降解率的影响
通过对江苏省南通市的原棉田土壤采集分析,HCHs的检出率为50%,而DDTs的检出率高达100%。HCHs的残留范围为ND~0.021 03 mg/kg,仅个别农田土壤中HCHs的残留量略高于一级标准,其测定值都低于国家土壤环境质量二级标准,HCHs的残留量对土壤环境质量影响不大。但DDTs的检出率较高、残留量也较高,在采集分析土壤中,约50%被检测土壤中DDTs的残留量超出国家二级标准,最高残留量高出国家二级标准的3倍以上。这些有机氯农药残留量虽然没有达到严重的污染程度,但由于农作物生长过程中的富集作用,最终还会对人体产生一定的“三致”威胁[6],清除农田土壤中有机氯农药的残留量是本次试验研究的重点内容。由于HCHs的残留量较低,基本符合国家土壤环境质量标准(GB 15618—2008《土壤环境标准(修订)》),在试验中主要研究了自然农田土壤中残留量较大的DDTs的降解率。
由表2和表3可知,随着过碳酰胺加入量的增加,DDTs的降解率升高,当过碳酰胺的加入量超过一定量时,DDTs的降解率增加较少,原因是CO(NH2)2·H2O2的加入量增大,H2O2的浓度也随着增大,H2O2的浓度过大时会部分淬灭羟基自由基(·OH)致使氧化反应速率变慢,出现降解率不增加甚至降低的现象[19]。H2O2的浓度较大时分解产生的原子氧之间也会发生碰撞自动消除[19],这也是影响DDTs降解的因素之一。因此,降解自然农田土壤中的DDTs,CO(NH2)2·H2O2的最适加入量是13 g/kg,这与“2.1”节中的试验结果相近。
与“2.2”节中的试验结果相比,在土壤湿度为100%、土水质量比为1 ∶4,同样保持过碳酰胺和Fe2+为最优条件下,DDTs的最高降解率明显降低了。因为自然农田土壤中DDTs的残留量较低,在试验条件相同的情况下,DDTs和过氧化氢中分解出来的·OH、·O2H等强氧化性自由基作用的概率会大幅度降低,因此DDTs的降解率会明显降低。虽然对自然农田土壤中DDTs的降解率不高,但过碳酰胺作为新型氮肥可以重复利用,多次降解的叠加效应可以达到清除农田土壤中有机氯农药污染的效果。

表2 不同处理对自然农田土壤中DDTs降解率的影响
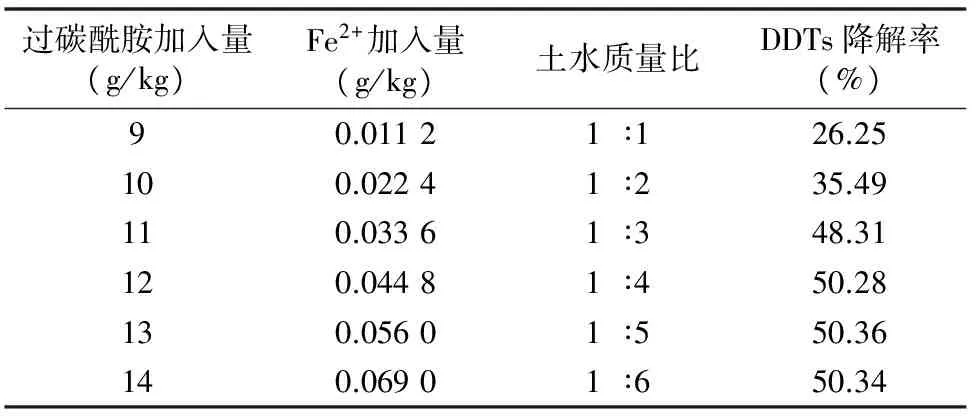
表3 土水质量比对自然农田土壤中DDTs降解率的影响
3 讨论与结论
不同过碳酰胺加入量对土壤中的HCHs、DDTs均有一定的降解作用,过碳酰胺的加入量对降解率有明显影响,多次试验确定过碳酰胺的最适加入量为12 g/kg。
降解时间对降解率的影响也是一个主要因素,降解率在初期阶段增大较快,约25 d后趋于平缓。适量的Fe2+和过碳酰胺同时施入土壤能明显提高HCHs、DDTs的降解率,Fe2+对有机氯农药的降解具有良好的催化作用,少量的Fe2+留在土壤中还有修复土壤的作用,Fe2+的最适加入量为 0.044 8 g/kg。
相同条件下DDTs的降解率比HCHs的高,在过碳酰胺和Fe2+的最优加入量的条件下,DDTs的降解率比HCHs的降解率高11.5%。
保持一定的土水质量比,可以提高HCHs、DDTs的降解率,在土水质量比达到1 ∶4时,过碳酰胺和Fe2+为最优加入量的条件下,DDTs的降解率约达80%,所以过碳酰胺作为氮肥施入土壤用水灌溉是有益的。
虽然过碳酰胺对自然农田土壤中DDTs的降解率不高,达不到一次去除的目的,但多次施用产生的降解叠加效应最终会使土壤中的HCHs、DDTs降解。另一方面,新型氮肥施入土壤还是土质的改良剂[10],在土壤底层施入少量的过碳酰胺,土壤的透气性会增加,还可以减小土壤的黏结力,可使农作物增产,减少黄沙的流动。我国农业种植面积大,很多农田在20世纪长期种植棉花,大量使用DDTs、HCHs等有机氯农药,农田土壤受到了严重的污染,至今在所选择的原棉田土壤中,DDTs的检出率高达100%。虽然有些有机氯农药残留量不高,但由于农作物的生长富集作用,对人体健康仍产生一定的威胁。因此,过碳酰胺施入土壤不仅能降解残留的有机氯农药,对其他的持久性有机污染物也具有较好的降解作用,推广过碳酰胺在农业方面的应用,有着较好的潜在市场和现实意义。
[1]余 刚,黄 俊,张彭义.持久性有机污染物:倍受关注的全球性环境问题[J].环境保护,2001(4):37-39.
[2]陈 菊,周 青.土壤农药污染的现状与生物修复[J].生物学教学,2006,31(11):3-6.
[3]李仲华.试述土壤污染对人类健康的侵害[J].环境科学与管理,2009,34(7):192-194.
[4]郭荣君,李世东,章力建,等.土壤农药污染与生物修复研究进展[J].中国生物防治,2005,21(3):129-135.
[5]Qiu X,Zhu T,Yao B,et al.Contribution of dicofol to the current DDT pollution in China[J].Environmental Science and Technology,2005,39(12):4385-4390.
[6]Mclachlan M S.Bioaccumulation of hydrophobic chemicals in agricultural food chains[J].Environmental Science and Technology,1996,30(1):252-259.
[7]魏 峰,董元华,安 琼,等.油料作物和粮食作物种子中有机氯农药残留分析[J].土壤,2008,40(4):647-652.
[8]王力敏,姜永海,张进保,等.某典型农业活动区土壤与地下水有机氯农药污染健康风险评价[J].环境科学学报,2013,33(7):2004-2011.
[9]曹启民,王 华,张黎明,等.中国持久性有机污染物污染现状及治理技术进展[J].中国农学通报,2006,22(2):361-365.
[10]李乐舜.过碳酸胺开发应用前景广阔[J].小氮肥设计技术,2004,25(1):46-48.
[11]钟 宁,曾清如,李顺兴,等.过碳酰胺对土壤中非离子表面活性剂的修复研究[J].土壤,2009,41(6):947-951.
[12]乔秀丽,田 军.二次逐步回归优化制备过碳酰胺工艺[J].应用化工,2012,41(11):1980-1982.
[13]王鸿显,任保增,刘 瑛,等.湿法生产过碳酰胺原料配比的理论分析和实验研究[J].化学通报(网络版),2002,65(1):864-868.
[14]Okano T,Tamura T,Abe Y,et al.Micellization and adsorbed film formation of a binary mixed system of anionic/nonionic surfactants[J].Langmuir,2000,16(4):1508-1514.
[15]Yang K,Zhu L,Xing B.Enhanced soil washing of phenanthrene by mixed solutions of TX100 and SDBS[J].Environmental Science & Technology,2006,40(13):4274-4280.
[16]宋春满,方敦煌,邓云龙,等.土壤中17种有机氯农药残留量的毛细管气相色谱测定法[J].分析试验室,2007,26(6):41-43.
[17]董冀川,杨 琼.气相色谱法同时分析测定土壤中15种有机氯农药残留[J].中国环境监测,2009,25(4):7-10.
[18]曹梦华,王琳玲,陈 静,等.有机氯农药污染土壤的Fenton氧化修复研究[J].环境工程,2012,30(5):127-130.
[19]李 莹,李方敏.Fenton氧化法修复多环芳烃污染土壤的研究进展[C]//2014中国环境科学学会学术年会论文集.北京:中国环境科学学会,2014:6228-6229.
[20]Ferrarese E,Andreottola G,Oprea I A.Remediation of PAH-contaminated sediments by chemical oxidation[J].Journal of Hazardous Materials,2008,152(1):128-139.
[21]Valderrama C,Alessandri R,Aunola T,et al.Oxidation by fenton’s reagent combined with biological treatment applied to a creosote-comtaminated soil[J].Journal of Hazardous Materials,2009,166(2/3):594-602.
[22]汤艳杰,贾建业,谢先德.铁锰氧化物在污染土壤修复中的作用[J].地球科学进展,2002,17(4):557-564.
[23]任丽英,马家恒,徐 振,等.铁铝复合氧化物对土壤Mn、Pb和Cd有效性的影响[J].矿物学报,2014,34(3):396-400.
