腐秆剂快速分解的水稻秸秆活性成分分析与红外光谱表征
2018-03-05刘峙嵘刘大前王长福
刘峙嵘,刘大前,王长福,王 云,陈 帅
(1.东华理工大学省部共建核资源与环境国家重点实验室培育基地,江西南昌 330013;2.东华理工大学核科学与工程学院,江西南昌 330013)
秸秆通常指的是农作物在收获籽实后剩余的茎叶部分,数量巨大,并随着粮食产量的加大而逐年增长。由于秸秆数量巨大,腐解速率缓慢,携带病菌,而且秸秆难消化、蛋白质含量低、木质素和硅含量较高,不适合做动物饲料,因此如何处理这些数量巨大的秸秆成为目前一大难题。很多国家通常直接将秸秆进行焚烧处理,这又产生了严重的环境污染问题,并且对公众健康产生了威胁。因此,作为丰富的可再生资源,秸秆的合理开发和利用对全球能源危机的缓解和环境污染的改善有着重要的意义。秸秆中含有大量的有机质和微量元素,将其作为还田肥料可以有效地提高土壤肥力,对改善我国养分失调的土壤有着深远的意义。目前,秸秆还田技术在发达国家已经十分成熟,普及率相对较高,并且获得了不错的效果[1]。正常条件下,秸秆腐解速率缓慢,养分释放量低。还田时施用腐秆剂可以有效增加微生物数量,加速秸秆腐解,提高养分释放量,并且对农作物产量的增加有显著促进效果[2]。
秸秆主要由植物的细胞壁物质即木质素、纤维素和半纤维素构成,这3种物质通过化学键相互紧贴在一起,形成一种稳定的结构,导致秸秆很难被降解。自然界中的微生物种类繁多,其中不乏一些能将纤维素、半纤维素和木质素降解的种类,这些微生物代谢所产生的一系列酶能将秸秆粗纤维中的纤维素、半纤维素和木质素等大分子碳水化合物降解为低分子的单糖或多糖[3]。但是单一菌种分泌的酶系有限,秸秆很难在1种菌种下完全降解,需要多种微生物产生多种酶系来协同完成降解[4]。腐秆剂是一种高效的微生物制剂[5],其中富含各种能分解细胞壁木质纤维素结构的微生物[6],能很好地对秸秆进行降解。傅里叶变换红外光谱法(FTIR)具有无损、快速、灵敏度高等特点,近年来被广泛用于农作物秸秆腐解研究。本试验采用傅里叶变换红外光谱法,通过测定添加腐秆剂后水稻秸秆样品中纤维素酶、半纤维素酶的活性,微生物的数量以及木质纤维素三组分的含量,探讨了腐秆剂快速分解水稻秸秆的生物化学机制。
1 材料与方法
1.1 试验材料
试验所选取的秸秆来自江西省南昌市新建县某稻田,属于第二季水稻的秸秆,采用抽选的方法从一片稻田的水稻中抽取适量作为研究对象。将新鲜水稻秸秆放置在阳光下自然风干半个月,风干后将秸秆剪至5 cm左右,用多功能粉碎机将其粉碎,过40目筛,放置在干燥箱中,105 ℃下烘干备用。试验所用腐秆剂包括特定的细菌、真菌和放线菌组合,由上海联业农业科技有限公司提供。
主要试剂:无水醋酸钠、冰醋酸、3,5-二硝基水杨酸、木糖、四水合酒石酸钾钠、重蒸苯酚、无水亚硫酸钠、木聚糖、无水葡萄糖、羧甲基纤维素钠、二水合乙二胺四乙酸二钠、十水合硼酸钠、十二烷基硫酸钠、乙二醇乙醚、无水磷酸氢二钠,分析纯,均由国药集团化学股份有限公司提供。
主要仪器:DZ-2BCⅡ型真空干燥箱(天津泰斯特仪器有限公司)、Nicolet IS5型傅里叶变换红外光谱仪(赛默飞世尔科技有限公司)、SXL-1216型程控箱式电炉(马弗炉)(杭州市卓驰仪器有限公司)、721型分光光度计(天津冠泽科技有限公司)、SHA-B型恒温水浴振荡器(常州国华电器有限公司)。
1.2 试验设计
试验通过测定被腐秆剂腐解的水稻秸秆中纤维素酶活性和半纤维素酶活性,细菌、真菌和放线菌数量的变化和木质纤维素三组分含量的变化,再加以空白对照,分析腐秆剂在加速水稻秸秆腐解过程中的影响和作用途径。在一系列容量为250 mL的锥形瓶中加入5 g秸秆样品,然后加入0.05 g腐秆剂、1 mL尿素溶液(50 g/L)和pH值为7的水。用保鲜膜封口,放入恒温箱中,30 ℃下培养。每隔3 d取出1个样品,1 g用于酶活力的测定,1 g用于微生物数量的测定。剩下的样品在105 ℃下干燥,测含水量,用于样品干质量计算,干燥后的样品用于木质纤维素三组分的测定和红外光谱分析。
1.3 分析方法
1.3.1 纤维素酶活力的测定 纤维素酶活力的测定采用DNS(3,5-二硝基水杨酸)显色法[7],主要检测内切葡聚糖酶。
待测酶液的制备:准确称取1 g秸秆样品于100 mL锥形瓶中,加醋酸-醋酸钠缓冲液20 mL,放入摇床中200 r/min浸提1 h。浸提完毕后略静置,将上清液置于离心管中,在 10 000 r/min 下离心10 min。离心后的上清液根据酶活力大小,稀释至适当浓度,即为待测酶液。
样品的测定:取1% CMC溶液3 mL和待测酶液1 mL于试管中,置于恒温水浴锅中50 ℃下糖化30 min;空白样取1% CMC溶液3 mL和待测酶液1 mL于试管中,沸水浴 10 min 使酶失活,再置于恒温水浴锅中50 ℃下糖化30 min。糖化后立即沸水浴煮10 min使酶失活,得糖化液,冷却后加入3 mL DNS试剂,再沸水浴10 min,冷却后用25 mL容量瓶加水定容。空白样用于调零,用分光光度计测样品在波长为550 nm下的吸光度。本试验以1 min内生成1 μg葡萄糖量所需的酶量定义为1个酶活单位(U),计算公式如下:
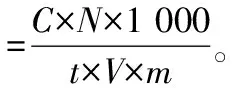
(1)
式中:C表示测得的葡萄糖浓度,mg/mL;N表示酶液稀释总倍数;t表示反应时间,min;V表示样品的体积,mL;m表示样品干质量,g。
1.3.2 半纤维素酶活力的测定 半纤维素酶活力的测定同样采用DNS(3,5-二硝基水杨酸)显色法,主要检测木聚糖酶活力。取1%木聚糖溶液3 mL和待测酶液1 mL于试管中,置于恒温水浴锅中50 ℃下糖化60 min;空白样取1%木聚糖溶液3 mL和待测酶液1 mL于试管中,沸水浴10 min使酶失活,再置于恒温水浴锅中50 ℃下糖化30 min。糖化后立即于沸水浴中煮10 min使酶失活,得糖化液,冷却后加入 3 mL DNS试剂,再沸水浴10 min,冷却后用25 mL容量瓶加水定容。空白样用于调零,用分光光度计测样品在波长为550 nm下的吸光度。本试验以1 min内生成1 μg木糖量所需的酶量定义为1个酶活单位(U),计算公式如下:
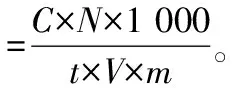
(2)
式中:C表示测得的木糖浓度,mg/mL;N表示酶液稀释总倍数;t表示反应时间,min;V表示样品的体积,mL;m表示样品干质量,g。
1.3.3 微生物群落的演替 用稀释平板计数方法[6]分别计算细菌、真菌和放线菌的数量。称取1 g秸秆样品置于 250 mL 锥形瓶中,加入99 mL水,置于摇床中振荡5 min使秸秆样品均匀分散在稀释液中成为稻秆粉末悬液。将悬浊液逐级稀释得到不同稀释度的溶液,待测。
1.3.4 木质纤维素三组分的测定 秸秆样品中纤维素、半纤维素和木质素的测定采用差重法[8]。准确称取1 g干燥后的秸秆样品于250 mL锥形瓶中,加入100 mL中性洗涤剂,置于恒温锅中100 ℃下油浴1 h,用热水洗涤至无中性洗涤剂,再用丙酮洗涤2次,将残渣置于干燥箱内105 ℃干燥至恒质量m1(g);将残渣转移至250 mL锥形瓶内,加入70 mL 2 mol/L盐酸,置于恒温锅中100 ℃下油浴1 h,用水洗涤至中性,再依次用适量的95%乙醇、无水乙醇、丙酮洗涤2次,将残渣于干燥箱中105 ℃下干燥至恒质量m2(g);将残渣转移至250 mL锥形瓶内,加入10 mL质量分数为72%的冷硫酸,室温降解 4 h 后加90 mL水,24 h后用水洗涤残渣至pH值为6.5,105 ℃干燥至恒质量m3;将残渣置于坩埚中,于马弗炉中550 ℃下灼烧4 h,剩余质量m4。计算三组分含量,公式如下:
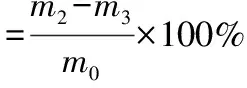
(3)
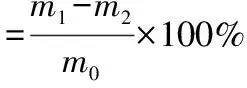
(4)

(5)
式中:m0表示秸秆初始质量,g。
2 结果与讨论
2.1 腐解前后秸秆样品红外光谱分析
秸秆样品腐解前后的红外谱图如图1所示。

对比秸秆样品腐解前后的红外谱图可知,腐解后的秸秆样品在3 300~3 500 cm-1处的吸收峰强度比腐解前的明显减弱,这表明秸秆腐解后所含酚羟基或者醇羟基有所减少,根据吸收峰的归属分析,这主要是秸秆中纤维素被降解,其中的羟基含量降低;2 920 cm-1处吸收峰减弱,说明腐解后秸秆中的碳水化合物和脂肪族化合物被降解,导致部分甲基和亚甲基被降解;1 610 cm-1处吸收峰强度减弱,表示有机羧酸被降解,含量减少;1 520 cm-1处吸收峰强度略有减弱,说明酰胺中的N—H键被破坏,这表示氨基酸被分解;1 430 cm-1处吸收峰的强度有所减弱,这表明秸秆中的脂肪族化合物、木质素以及碳水化合物被降解[9]。1 380 cm-1处吸收峰强度减弱,说明脂肪类化合物被大量分解,氨基的含量大量减少;1 320 cm-1处吸收峰的强度减弱,说明木质素被降解,C—O键减少;1 230 cm-1处吸收峰强度减弱,说明纤维素被降解,含量降低,C—O键、Si—O键减少。
2.2 腐秆剂对水稻秸秆腐解过程中酶的影响
腐解过程是微生物将复杂有机化合物转化成简单有机化合物和无机物的过程,其中的关键物质就是微生物产生的水解酶,腐解反应矿化进程和强度都由酶的活性直接反映[10]。CMC酶和木聚糖酶都是水解酶的一种,在腐解过程中起着重要的作用。试验所得腐解过程中CMC酶和木聚糖酶的变化曲线见图2、图3。
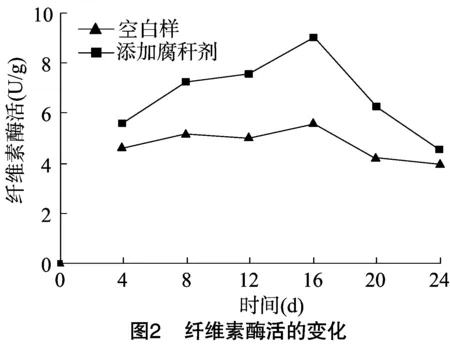
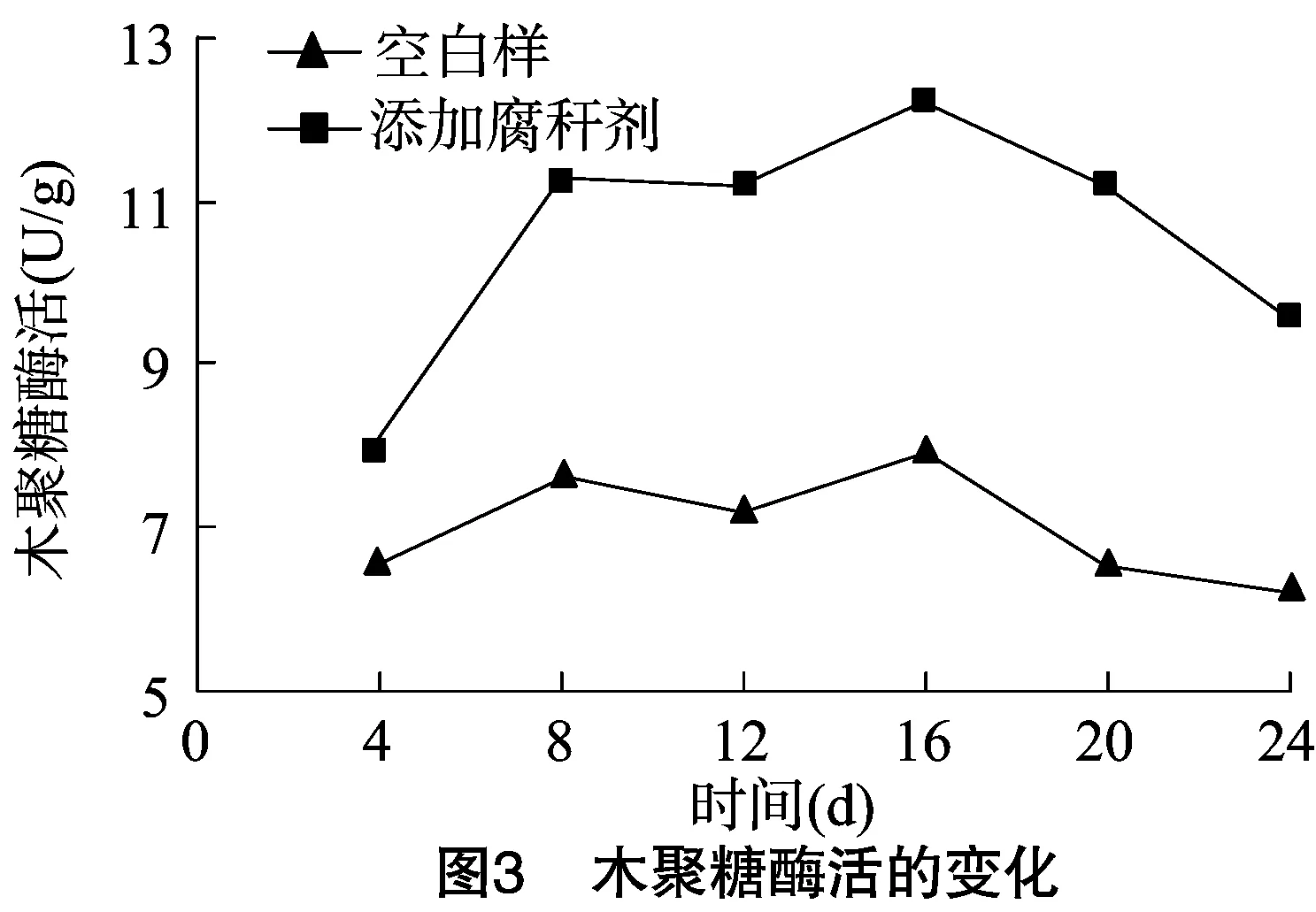
从图2可以看出,添加腐秆剂的秸秆样品中CMC酶活在腐解前期上升迅速,16 d出现最高酶活9.01 U/g,之后酶活开始急速降低。空白样中的酶活上升缓慢,16 d出现最高酶活5.62 U/g,之后酶活缓慢下降。由图3可知,添加腐秆剂的秸秆样品中木聚糖酶的活性变化趋势与CMC酶相似,为先升高后下降,最高酶活出现在16 d,为12.25 U/g。空白样中木聚糖酶活的变化趋势较缓慢,最高酶活出现在16 d,为 7.96 U/g。因此,无论是CMC酶活还是木聚糖酶活都随着腐解进程先升高后下降,造成这样的原因可能是腐解前期营养物质充足,微生物代谢旺盛,产酶能力强;而随着时间增长,营养物质开始供应不足,微生物产酶能力降低。添加腐秆剂后的样品中CMC酶和木聚糖酶的最高酶活和平均酶活都明显高于空白样,说明添加腐秆剂能够显著提高水稻秸秆腐解各个阶段的CMC酶活和木聚糖酶活[11],从而促进纤维素和半纤维素的快速降解。
2.3 腐秆剂对水稻秸秆腐解过程中微生物数量的影响
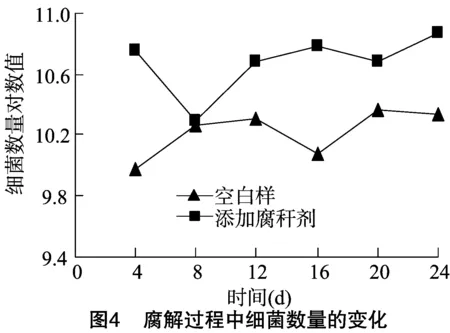
微生物代谢在水稻秸秆腐解过程中起着重要作用,因此,对腐解过程中微生物数量变化进行分析十分必要。本试验测得的腐解过程中微生物变化曲线见图4、图5、图6。
从图4可以看出,添加腐秆剂的秸秆样品在整个腐解阶段的细菌数量都高于空白样,这说明腐秆剂在整个腐解过程中都促进了细菌生长。从图5可以看出,添加腐秆剂的秸秆样品的真菌数量在腐解开始时略高于空白样,12 d后数量优势开始变得越来越明显,这说明了腐秆剂对腐解过程中真菌数量的提升主要体现在腐解后期。从图6可以看出,添加腐秆剂的样品中放线菌数量在腐解前期就有一定的优势,虽然在4~8 d优势开始缩小,但8 d后优势又开始扩大,并持续保持一定优势,这说明腐秆剂对整个腐解过程中放线菌的数量有一定的促进作用[12]。


2.4 腐秆剂对水稻秸秆腐解过程中木质纤维素三组分降解的影响
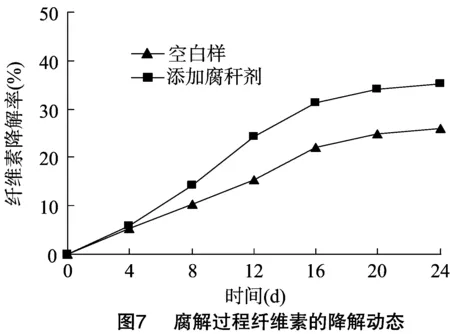
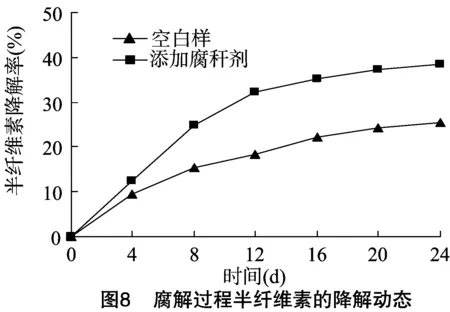
纤维素、半纤维素和木质素是水稻秸秆的主要成分,对腐解过程中纤维素、半纤维素和木质素的降解进行分析是很有必要的。本试验所得腐解过程中木质纤维素三组分降解动态见图7、图8、图9。
从图7可以看出,无论是否添加腐秆剂,秸秆样品腐解过程中纤维素的降解速率都是先慢后加快再变慢。这是因为在细胞壁结构中,纤维素被木质素和半纤维素紧紧缠绕,很难降解;但随着腐解的进行,半纤维素和木质素被部分降解,被包裹的纤维素渐渐裸露出来,降解速度开始加快;腐解后期由于营养物质不足导致微生物产酶下降[13],导致降解速率下降。这与腐解过程中CMC酶动态反映的结果基本一致。添加腐秆剂的样品腐解24 d纤维素的降解率为35.24%,比空白样高出了9.4百分点,说明了腐秆剂的添加在一定程度上促进了纤维素的降解。从图8可以看出,腐解过程中半纤维素在腐解前期就表现出了较快的降解速率,但随着时间增长腐解速率开始下降,这与腐解过程中木聚糖酶动态变化反映的情况基本一致。腐解24 d,添加腐秆剂的样品半纤维素降解率为 38.36%,比空白样高出了12.88百分点,说明腐秆剂的添加在一定程度上促进了半纤维素的降解。从图9可以看出,在腐解前8 d添加腐秆剂的样品中木质素降解率与空白样之间并没有明显差异,8 d后才表现出更强的降解能力。腐解24 d添加腐秆剂的样品中木质素降解率仅为14.35%,但比空白样高出了5.14百分点,这说明了虽然腐秆剂的添加促进了木质素的降解,但降解率还是相对较低。

3 结论
本试验通过测定被腐秆剂腐解的水稻秸秆中纤维素酶、半纤维素酶的活性,微生物的数量以及木质纤维素三组分的含量,并对比腐解前后秸秆样品的红外光谱图,探究了腐秆剂快速分解水稻秸秆的机制,所得结果有:对比腐解前后秸秆的红外谱图发现,腐解后的秸秆中纤维素、半纤维素和木质素等碳水化合物发生分解,使羟基和亚甲基基团减少,同时也表明酚类化合物被氧化成醌类物质;秸秆中的蛋白质和氨基酸分解后生成酰胺类化合物、硝酸盐和铵盐。腐秆剂的添加能显著提升水稻秸秆腐解过程中CMC酶和木聚糖酶的活性,并且酶的活性都随着时间的增长先升高后降低。腐秆剂中的微生物组合能根据水稻秸秆腐解的不同阶段起到不同的作用来影响降解过程。腐秆剂的添加能促进水稻秸秆腐解过程中纤维素、半纤维素和木质素的降解,但木质素降解率相对较低。此外,秸秆中各活性成分的降解速率和降解百分比还有待提高,腐秆剂的最佳腐解条件还需进一步研究。
[1]Bessou C,Ferchaud F,Gabrielle B,et al.Biofuels,greenhouse gases and climate change:a review[J].Agronomy for Sustainable Development,2011,31(1):1-79.
[2]杨振兴,周怀平,关春林,等.秸秆腐熟剂在玉米秸秆还田中的效果[J].山西农业科学,2013,41(4):354-357.
[3]Lv Y C,Li N,Gong D C,et al.The effect of temperature on the structure and function of a cellulose-degrading microbial community[J].Applied Biochemistry and Biotechnology,2012,168(2):219-223.
[4]Sharma A,Sharma R,Arora A,et al.Insights into rapid composting of paddy straw augmented with efficient microorganism consortium[J].International Journal of Recycling of Organic Waste in Agriculture,2014(3):54.
[5]刘 刚,庄义庆,杨敬辉,等.腐秆剂与秸秆配施对稻田N2O排放的影响[J].环境科学学报,2014,34(3):736-741.
[6]Simmons C W,Reddy A P,D’Haeseleer P,et al.Metatranscriptomic analysis of lignocellulolytic microbial communities involved in high-solids decomposition of rice straw[J].Biotechnology for Biofuels,2014(7):495.
[7]张全国,张志萍,赵民善,等.秸秆制氢过程中纤维素酶酶活测定方法研究[J].热科学与技术,2011,10(2):128-132.
[8]Rose M T,Deaker R,Potard S,et al.The survival of plant growth promoting microorganisms in peat inoculant as measured by selective plate counting and enzyme-linked immunoassay[J].World Journal of Microbiology and Biotechnology,2011,27(7):1649-1659.
[9]张红漫,郑荣平,陈敬文,等.NREL法测定木质纤维素原料组分的含量[J].分析试验室,2010,29(11):15-18.
[10]陶 军,张树杰,焦加国,等.蚯蚓对秸秆还田土壤细菌生理菌群数量和酶活性的影响[J].生态学报,2010,30(5):1306-1311.
[11]Yeasmin S,Kim C H,Park H J,et al.Cell surface display of cellulase activity-free xylanase enzyme on saccharomyces cerevisiae EBY100[J].Applied Biochemistry and Biotechnology,2011,164(3):294-304.
[12]张 红,吕家珑,曹莹菲,等.不同植物秸秆腐解特性与土壤微生物功能多样性研究[J].土壤学报,2014,51(4):743-752.
[13]Haft R J,Gardner J G,Keating D H.Quantitative colorimetric measurement of cellulose degradation under microbial culture conditions[J].Applied Microbiology and Biotechnology,2012,94(1):223-229.
