榆耳发酵产物的体外抑菌及免疫增强作用
2018-03-05邢效瑞崔京春郭海勇钱爱东杨闽楠
邢效瑞,崔京春,郭海勇,钱爱东,杨闽楠
(1.西南医科大学基础医学院,四川泸州 646000;2.大连民族大学生命科学学院,辽宁大连 116600;3.吉林师范大学生命科学学院,吉林四平 136000;4.吉林农业大学动物科学技术学院,吉林长春 130118)
榆耳为肉红胶韧革菌(Gloeostereumincarnatum)的子实体,又称榆蘑[1-2],是我国传统的药食兼用真菌,多生长在榆树的枯树干或树洞处,主要分布于我国东北部地区及日本的北海道地区,在《本草纲目》[3]等书中多有记载,民间流传使用榆耳水煎液治疗红白痢疾、腹泻、肠炎等疾病。我国关于榆耳的研究起步较晚,主要集中在榆耳的分类分布、理化特性和生物学特征等方面。目前,液体深层发酵技术已成为药用真菌资源开发的重要手段,具有广泛的应用价值。目前,国内外的研究认为,榆耳发酵上清液具有抑菌[4]、抗炎、抗氧化性、抗肿瘤、免疫增强[5]等多种生物学活性。本试验对榆耳G930菌种的发酵上清液体外抑菌效果及抑菌效果稳定性、榆耳发酵液多糖的免疫增强作用进行初步研究,以期为榆耳发酵产物的市场化应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌种 榆耳G930菌种,由吉林农业大学菌物研究中心提供;指示菌金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌标准株(EscherichiacoliATCC 25922)、枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母杆菌(Saccharomycescerevisiae)、嗜酸乳杆菌(Lactobacillusacidophilus),均由大连吉翔农业科技有限公司研究中心提供;指示菌沙门氏菌(Salmonella)、肺炎克雷伯菌(Klebsiellapneumoniae)、多杀性巴氏杆菌(Pasteurellamultocida)、大肠杆菌O24(EscherichiacoliO24),均由西南医科大学微生物实验室提供。
1.1.2 试验动物 6~8周龄SPF级BALB/c健康雌鼠、2~3 kg 成年健康豚鼠,均购自西南医科大学实验动物中心。
1.1.3 培养基
1.1.3.1 榆耳发酵培养基 榆耳发酵培养基由4.600%玉米淀粉、1.600%黄豆粉、0.010%磷酸氢二钾、0.030%磷酸二氢钾、0.001%硫酸锰、0.001%硫酸锌、0.03%硫酸镁、0.100 mg/mL 维生素B1组成,pH值为5.0~5.5,高压蒸汽灭菌后,4 ℃分装保存备用。
1.1.3.2 各指示菌培养基 各指示菌培养基参照文献[6]中所述方法及市场在售的培养基使用说明进行配制,高压蒸汽灭菌后,4 ℃分装保存备用。
1.1.3.3 马铃薯液体培养基 马铃薯液体培养基由20.00%马铃薯、2.00%葡萄糖、0.03%硫酸镁、0.20%磷酸二氢钾、10.00 mg/100 mL 维生素B1组成,pH值自然,高压蒸汽灭菌后,4 ℃分装保存备用。
1.1.4 主要试验试剂 注射用氨苄西林钠(AMP),购自哈尔滨制药三厂;刀豆蛋白A(ConA),购自美国Sigma公司;RPMI-1640培养液,购自美国Gibco公司;鸡红细胞悬液、豚鼠血清、灵芝多糖溶液,由笔者所在实验室自制。
1.1.5 主要试验仪器 紫外分光光度计,购自美国Unico公司;微量移液器,购自美国Thermo公司;超净工作台,购自北京东联哈尔仪器制造有限公司;恒温培养箱,购自上海智诚分析仪器制造公司;光学显微镜,购自日本Olympus公司;台式高速离心机,购自德国Osterode公司。
1.2 试验方法
1.2.1 榆耳发酵上清液的制备 将4 ℃保藏的榆耳G930斜面菌种接入已灭菌的马铃薯液体培养基中活化,于26 ℃、120 r/min摇床中恒温培养10 d。活化后的榆耳菌种再按 10 % 的接种量接入已灭菌的发酵培养基中,于26 ℃、120 r/min 摇床中发酵培养7 d,制备得到榆耳发酵上清液。无菌条件下过滤后得到榆耳发酵上清液,4 ℃保存备用。
1.2.2 榆耳发酵上清液抑菌谱的测定及理化因素对其体外抑菌作用的影响
1.2.2.1 榆耳发酵上清液抑菌谱的测定 榆耳发酵上清液抑菌谱的测定试验采用杯碟法,将已经制备好的指示菌悬液稀释为1×106CFU/mL。制作指示菌培养基平板,将牛津杯(10 mm×8 mm×6 mm)平放在培养基上,在牛津杯中加入100 μL/孔试验样品,同时设置AMP(10 μg/孔)和空白发酵培养基为对照组。37 ℃培养24 h后取出,测定抑菌圈的直径。
1.2.2.2 榆耳发酵上清液的体外抑菌活性的热稳定性检测 取适量的榆耳发酵上清液,分别测定其在-20、4、37、60、100、121 ℃及室温(20~25 ℃)等温度时的抑菌活性,发酵上清液在-20、4 ℃及室温的条件下分别保存1周,其余温度下保存10 min。采用杯碟法,以金黄色葡萄球菌为指示菌,以AMP(10 μg/孔)和空白发酵培养基作为对照组进行试验并记录数据。
1.2.2.3 榆耳发酵上清液的体外抑菌活性的pH值稳定性检测 取适量榆耳发酵上清液,用1 mol/L磷酸和 1 mol/L 氢氧化钠将榆耳发酵上清液的pH值分别调至1~9。采用杯碟法,以金黄色葡萄球菌作为指示菌,以AMP(10 μg/孔)和不同pH值的空白发酵培养基为对照组进行试验并记录数据。
1.3 榆耳发酵液多糖的免疫增强作用
1.3.1 榆耳发酵液多糖的粗提 将榆耳发酵上清液在60 ℃减压蒸馏,10倍体积浓缩;使用乙醇沉淀法提取粗多糖后,再应用Sevage法除蛋白,得到发酵液多糖溶液,采用苯酚硫酸法测定榆耳发酵液的多糖含量。
1.3.2 试验分组及给药方式 6~8周龄SPF级BALB/c雌鼠小鼠100只,体质量为(17±2)g,口服给药,每天给药1次,每次灌服剂量为0.2 mL/只,连续给药21 d,禁食2 h开始试验。试验分组的详细信息如表1所示。

表1 榆耳发酵液多糖的免疫增强作用试验分组
1.3.3 小鼠脾脏指数的测定 从各试验组中随机选取5只小鼠,称质量,处死小鼠,无菌取脾脏后称脾的质量,计算脾脏指数,单位mg/g。脾脏指数=小鼠脾的质量/小鼠体质量。
1.3.4 小鼠腹腔巨噬细胞吞噬鸡红细胞的试验 从各试验组中随机选取5只供试小鼠,腹腔注射1 mL 20%压积鸡红细胞悬液,轻揉腹部。30 min后处死小鼠,向腹腔注射2 mL无菌生理盐水,吸取1 mL腹腔洗液,滴3~4滴于载玻片上,37 ℃ 保湿温育30 min后,瑞氏染液染色,油镜下计数并计算腹腔巨噬细胞的吞噬率和吞噬指数。吞噬率=吞噬红细胞的巨噬细胞数量/100×100%;吞噬指数=被100个巨噬细胞吞噬的红细胞数量/100。
1.3.5 小鼠血清溶血素试验 在各试验组内随机选取10只小鼠,腹腔皮下注射1 mL 10%鸡红细胞悬液,3 d后眼球采血,制备小鼠血清;取1 mL稀释100倍的小鼠血清加入5%鸡红细胞悬液中,再加0.1 mL 10%补体,以不加补体作空白对照,于37 ℃反应30 min,冰水内终止反应,1 000 r/min离心5 min,在540 nm波长处测定吸光度并计算血清样品的溶血素水平。样品溶血素水平=样品吸光度÷鸡红细胞半数溶血时的吸光度×稀释倍数。
1.3.6 ConA诱导小鼠淋巴细胞转化试验(体内法) 在各试验组内随机选取5只小鼠,每只小鼠腹腔注射0.3 mg ConA,正常饲养3 d后,尾部取血法采集外周血,加入抗凝剂。取1小滴抗凝血涂片,自然干燥。瑞氏染液染色后,油镜下观察并计算淋巴细胞的转化率:转化率=转化的淋巴细胞数量/血液中总的淋巴细胞数量×100%。
1.4 数据分析
所有试验数据均用“平均数±标准差”表示,利用SPSS 19.0软件对结果进行统计分析,组间比较采用t检验平均值的成对二样本分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 榆耳发酵上清液抑菌谱的测定及理化因素对其体外抑菌作用的影响
2.1.1 榆耳发酵上清液的抑菌谱 由表2可知,榆耳发酵上清液对金黄色葡萄球菌的体外抑菌活性最强,抑菌直径为18.5 mm;榆耳发酵上清液对枯草芽孢杆菌和嗜酸乳杆菌的抑菌直径分别为13.2、10.5 mm,对大肠杆菌标准株、大肠杆菌O24和沙门氏菌的抑菌直径分别为11.7、9.5、11.0 mm,对肺炎克雷伯菌和多杀性巴氏杆菌的抑菌直径分别为9.0、8.5 mm;榆耳发酵上清液对酿酒酵母菌无抑制作用。以上试验结果表明,榆耳G930菌种的发酵上清液对革兰氏阳性菌敏感,对革兰氏阴性菌不敏感,对肠道致病菌的体外抑制作用强于对呼吸系统致病菌的体外抑制作用。
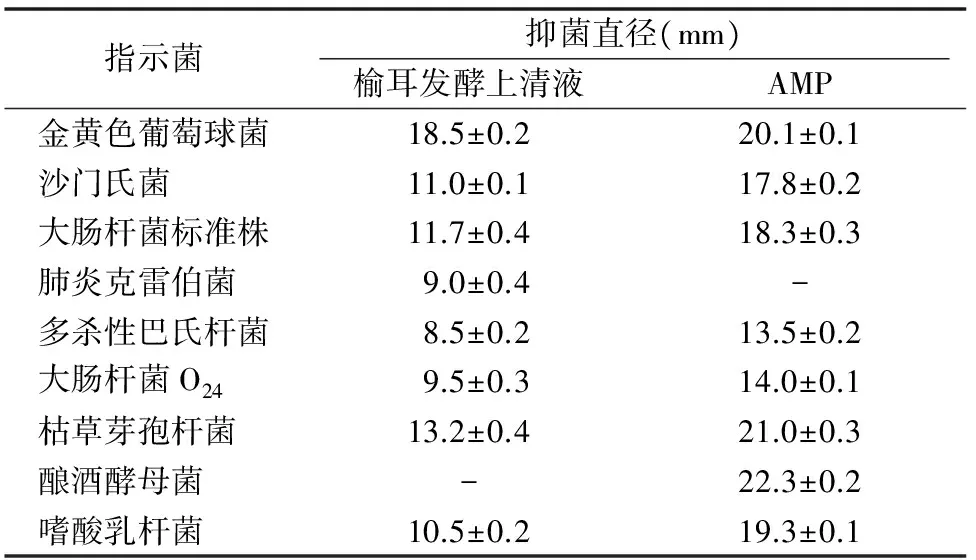
表2 榆耳发酵上清液体外抑菌试验结果
注:牛津杯外径为8.0 mm,“-”表示样品对指示菌无抑制作用;空白对照培养基对指示菌均无抑制作用。
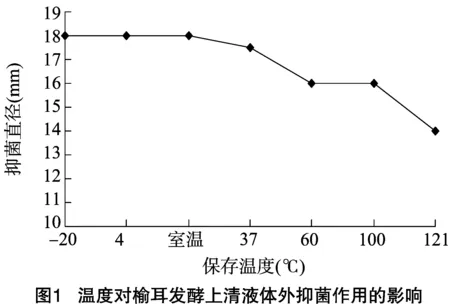
2.1.2 温度对榆耳发酵上清液体外抑菌作用的影响 AMP处理组的抑菌直径为20.0 mm。由图1可知,-20、4 ℃保存的榆耳发酵上清液与常温保存的榆耳发酵上清液的体外抑菌活性没有明显差异,抑菌直径均为18.0 mm。37 ℃保存的榆耳发酵上清液的抑菌直径为17.5 mm。60、100 ℃保存的榆耳发酵上清液的抑菌直径均为16.0 mm。经过121 ℃高压处理10 min的发酵上清液的抑菌活性稍有下降。结果表明,榆耳G930菌种的发酵上清液具有良好的热稳定性,易于保存。
2.1.3 pH值对榆耳发酵上清液体外抑菌作用的影响 当pH值为1时,阴性对照组的抑菌直径为14.0 mm,阳性对照组的抑菌直径为20.5 mm。由图2可知,当榆耳发酵上清液的pH值为1时,其体外抑菌直径最大,为26.0 mm;榆耳发酵上清液的pH值为2~7时,其抑菌直径无明显差异,为17.0~19.0 mm;当榆耳发酵上清液的pH值为8时,其抑菌直径为11.0 mm;当榆耳发酵上清液的pH值为9时,其抑菌直径为0,体外抑菌活性丧失。结果表明,榆耳G930菌种的发酵上清液在碱性环境中会失去体外抑菌活性。

2.2 榆耳发酵液多糖的免疫增强作用
2.2.1 小鼠脾脏指数 由表3可知,组2、组3小鼠的脾脏指数与阴性对照组小鼠的脾脏指数差异显著(P<0.05);组1小鼠的脾脏指数与阴性对照组小鼠的脾脏指数无显著性差异,组2、组3小鼠的脾脏指数与阳性对照组小鼠的脾脏指数无显著性差异。综合考虑,饲喂小鼠榆耳G930菌种发酵上清液多糖的最佳剂量为5 mg/d,此时可以明显增加小鼠的脾脏指数。
2.2.2 小鼠腹腔巨噬细胞吞噬鸡红细胞试验 由表4可知,组1的吞噬率与阴性对照组的吞噬率差异显著(P<0.05),组2、组3的吞噬率与阴性对照组的吞噬率差异极显著(P<0.01)。组1的吞噬指数与阴性对照组的吞噬指数差异显著(P<0.05),组2、组3的吞噬指数与阴性对照组的吞噬指数差异极显著(P<0.01)。就吞噬率和吞噬指数而言,试验组与阳性对照组无显著性差异,组2与组3无显著性差异。综合考虑,饲喂小鼠榆耳G930菌种发酵上清液多糖的最佳剂量为 5 mg/d,此时可以提高小鼠腹腔巨噬细胞吞噬鸡红细胞的能力,进而提高机体的非特异性免疫水平。

表3 小鼠脾脏指数
注:“*”“**”分别表示与阴性对照组相比差异显著(P<0.05)、差异极显著(P<0.01)。下表同。

表4 巨噬细胞吞噬鸡红细胞的试验结果
2.2.3 血清溶血素试验 由表5可知,3个试验组的溶血素水平与阴性对照组的溶血素水平相比均差异极显著(P<0.01),组2、组3的溶血素水平与阳性对照组的溶血素水平相比差异显著(P<0.05),试验组1与试验组2、组3差异显著(P<0.05),试验组2与试验组3无显著性差异。结果表明,榆耳G930菌种发酵上清液多糖可以提高小鼠血清溶血素水平,进而提高机体体液免疫水平。综合考虑,确定榆耳发酵上清液多糖的最佳饲喂剂量为5 mg/d。

表5 血清溶血素试验
2.2.4 ConA诱导小鼠淋巴细胞转化试验(体内法) 由表6可知,组1小鼠的淋巴细胞转化率与阴性对照组的无显著性差异,组2、组3小鼠的淋巴细胞转化率与阴性对照组的差异显著(P<0.05),组2、组3小鼠的淋巴细胞转化率与阳性对照组的差异显著(P<0.05),组2与组3小鼠的淋巴细胞转化率无显著性差异。结果表明,当饲喂小鼠榆耳G930菌种发酵液多糖的剂量为5、10 mg/d时,可以提高小鼠细胞的免疫水平。综合考虑,确定榆耳发酵上清液多糖的最佳饲喂剂量为5 mg/d。
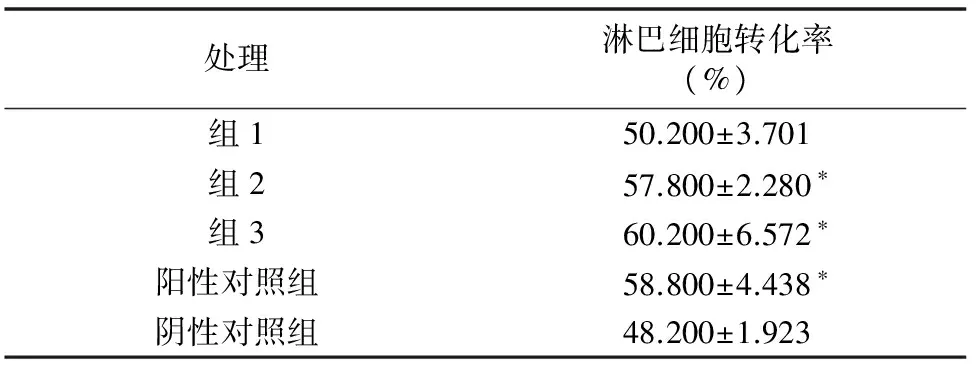
表6 ConA诱导淋巴细胞转化试验
3 结论与讨论
3.1 榆耳发酵上清液抑菌谱的测定及理化因素对其体外抑菌作用的影响
人们一直认为榆耳在治疗腹泻方面有其独特的药用价值,针对榆耳发酵上清液抑菌谱的研究一直不够深入和系统。本研究选用畜禽生产中常见的致病菌及肠道益生菌作为指示菌,研究榆耳G930菌种液体发酵上清液的抑菌谱。结果表明,榆耳发酵上清液对革兰氏阳性菌的体外抑制作用强于对革兰氏阴性菌的体外抑制作用,与崔京春等的研究结果[7]一致,表明榆耳发酵上清液的体外抑菌作用在不同种属之间差异不明显。同时也发现,榆耳发酵上清液对肠道致病菌的抑制作用强于对呼吸系统致病菌的抑制作用,民间常用榆耳水煎液治疗痢疾,其发酵上清液中可能含有作用于肠道致病菌的抑菌物质。对榆耳发酵上清液进行理化处理后发现,榆耳发酵上清液中的抑菌物质具有良好的热稳定性和耐酸性,表明其易于保存并可以通过动物的消化系统到达机体作用的部位。以上结论充分表明,榆耳发酵产物具有作为治疗动物腹泻药物进行开发的巨大潜力。本试验仅对榆耳发酵产物的体外抑菌作用进行了初步研究,未来可以从发酵产物中抑菌物质的分子结构、作用位点及抑菌机制等方面进行深入研究。
3.2 榆耳发酵液多糖对小鼠免疫器官及免疫功能的影响
脾脏是人和脊椎动物体内最大的免疫器官,是免疫系统产生致敏淋巴细胞和抗体的重要场所。试验结果表明,饲喂小鼠榆耳发酵液多糖的剂量为5、10 mg/d,并连续饲喂21 d,可显著增加正常小鼠的脾脏指数。刘瑞君等研究认为,榆耳多糖可增加小鼠中枢免疫器官胸腺与脾脏指数[8],本试验的结果与之基本一致,但这与崔京春等的研究结果[9]不一致。榆耳发酵液多糖对小鼠免疫器官的影响程度可能与饲喂时间的长短有关。本试验通过腹腔巨噬细胞吞噬鸡红细胞试验、血清中溶血素水平测定试验及ConA诱导淋巴细胞转化试验,分别评价榆耳发酵液多糖对小鼠非特异性免疫、体液免疫及细胞免疫功能[10]的影响。结果表明,榆耳发酵液多糖溶液对腹腔巨噬细胞吞噬功能和淋巴细胞转化率的影响呈一定的量效关系,榆耳发酵液多糖中、高剂量组的作用明显高于低剂量组,表明榆耳发酵上清液多糖对巨噬细胞吞噬功能和淋巴细胞转化率的影响可随浓度的升高而增强,但中、高剂量组之间无显著性差异,表明榆耳发酵上清液多糖的最佳剂量在为5 mg/d。同时试验结果表明,榆耳发酵上清液多糖可显著提高小鼠外周血中血清溶血素水平,增加特异性抗体含量,继而增强小鼠体液免疫功能,无明显的量效关系,榆耳发酵上清液多糖的最适剂量为5 mg/d,小鼠平均体质量按20 g计算,榆耳发酵上清液多糖对小鼠免疫增强作用的有效作用剂量为 250 mg/(kg·d)。侯建明等研究发现,银耳多糖的剂量在500~2 000 mg/(kg·d)范围内可显著提高小鼠血清溶血素水平[11],本试验结果与之相似。根据文献报道,桑叶多糖等可以促进ConA诱导淋巴细胞转化反应[12]。综上所述,榆耳发酵上清液多糖可以提高小鼠细胞免疫功能。
本研究以榆耳G930菌种发酵上清液及发酵上清液多糖为研究对象,对榆耳发酵产物的体外抑菌及免疫增强作用进行研究。结果表明,榆耳发酵上清液具有较宽的抑菌谱和良好的耐酸性、耐热性;榆耳发酵上清液多糖饲喂量为250 mg/(kg·d)时,可以提高小鼠的非特异性免疫功能、体液免疫功能和细胞免疫功能。表明榆耳发酵产物可作为动物疾病治疗药物及动物保健产品,发挥抗菌和增强动物机体免疫力的功效,具有广阔的应用前景。
[1]徐锦堂.中国药用真菌学[M].北京:北京医科大学中国协和医科大学联合出版社,1997:699-700.
[2]王 云,谢支锡,田希文,等.榆耳高产栽培要点[J].中国食用菌,1990,9(2):14-15.
[3]李时珍.本草纲目[M].长春:吉林大学出版社,2009:1716.
[4]张亚楠.榆耳子实体和发酵液的抑菌活性的研究[D].长春:东北师范大学,2010.
[5]翁丽丽,翁 砚,邱金文.榆耳多糖对动物免疫功能的影响[J].吉林中医药,2009,29(7):626-627.
[6]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995:235-243.
[7]崔京春,郭海勇,邢效瑞,等.榆耳发酵液抑菌谱及抑菌作用稳定性研究[J].黑龙江畜牧兽医,2013(13):105-107.
[8]刘瑞君,李凤珍.榆耳多糖的分离及其性质的研究[J].微生物学杂志,1992(1):17-22,28.
[9]崔京春,郭海勇,邢效瑞,等.榆耳发酵液多糖对小鼠免疫功能的影响[J].食品工业科技,2013,34(16):342-346,350.
[10]何昭阳,胡桂学,王春凤.动物免疫学实验技术[M].长春:吉林科学技术出版社,2002:210-213.
[11]侯建明,王爱东,雷清新,等.银耳多糖对免疫功能影响的实验报告[J].中国疗养医学,2007,16(11):641-643.
[12]侯瑞宏,廖森泰,刘 凡,等.桑叶多糖对小鼠免疫调节作用的影响[J].食品科学,2011,32(13):280-283.
