大蒜鳞茎水浸提液的化感作用评价
2018-03-05王薇薇郑佳秋祖艳侠樊继德吴永成
王薇薇,郭 军,郑佳秋,祖艳侠,梅 燚,樊继德,吴永成
(江苏沿海地区农业科学研究所,江苏盐城 224002)
化感作用是指一种植物(包括微生物)通过本身产生并释放到周围环境中的化学物质对另一种植物(或微生物)产生直接或间接的相互排斥和促进的作用[1],具有化感作用的物质称为化感物质(allelochemicals)。植物化感作用是以向环境释放化感物质实现的,化感物质释放是化感作用的重要环节,化感物质的释放途径主要有挥发、淋溶、分泌、腐解[2-6]和花粉直感[7]等。植物化感作用广泛存在于自然界中,对植物群落的形成、演替,农业生产中轮作、间作、套作的合理安排及农作物病虫草害的防治等方面均有重大影响[8-10]。因此,研究化感植物对自身或其他生物生理生态过程的化感效应对保持生态系统平衡、保护生物多样性有着重要的科学意义。
随着农业科学技术的迅速发展和蔬菜种植面积的扩大,选择合理的蔬菜栽培制度(间作、套作、混作、轮作),不仅可以提高土地利用率、增加蔬菜产量,还可以有效改善土壤理化性状和微生态环境,避免或减轻土壤连作障碍。但是在制定耕作制度时,一定要把化感因素考虑在内,许多蔬菜作物都能表现出一定的化感作用,应该充分利用不同蔬菜间的化感促进作用,避免化感抑制作用。胡葱挥发物对番茄幼苗生长在 80株/3.83 m2处理下表现为促进作用最强,120株/3.83 m2处理下表现为抑制;胡葱根系分泌物在60株/盆处理下对番茄的促进作用最强,在80株/盆处理下对番茄的抑制作用最强[11]。马铃薯与菜豆、洋葱和甜菜间作可以提高产量[12],番茄和黄瓜、葱与菜豆相克则不宜种在一起[13]。
大蒜(AlliumsativumL.)属于百合科葱属2年生草本植物,是深受世界各国人民喜爱的保健蔬菜,又是重要的调味品和医药原料,具有良好的杀菌效果和药用价值。大蒜在我国已有2 000多年的栽培历史,栽培面积和产量均居世界第一。在农业生产中大蒜是公认的良好前茬作物[14],可以促进植物根际土壤中真菌、细菌和放线菌的繁殖,提高根际土壤中磷酸酶、脲酶和过氧化氢酶的活性,从而促进土壤中N、P等营养元素的循环,为其他植物根系的生长创造良好的微生态环境[15]。金扬秀等发现大蒜与瓜类轮作并辅以适时休闲能够将瓜类枯萎病发病率由连作时的50%降至10%[16]。大蒜根系分泌物对黄瓜枯萎病菌和西瓜枯萎病菌菌丝生长及孢子萌发表现出抑制作用[17]。质量分数0.625%的大蒜鳞茎浸提液处理黄瓜种子4 h后,黄瓜镰刀菌枯萎病和黄瓜猝倒病的发生率均为0,防治效果达到100%[18]。大蒜多数品种的秸秆水浸液对番茄幼苗的生物量表现低促高抑的效果,品种G604效果最为显著[19]。目前几乎所有的化感作用研究报道均涉及生物测定法,生物测定是化感作用研究中非常重要的一个环节,此方法得到的结果快速直观,可行性较强,因此,本试验采用浸提法收集大蒜鳞茎浸提液,通过测定不同浓度大蒜鳞茎浸提液对空心菜种子萌发和幼苗生长的影响来研究大蒜鳞茎浸提液的化感作用,明确大蒜鳞茎浸提液对空心菜的化感效应,以期为今后大蒜和空心菜的合理配置提供理论基础。
1 材料与方法
1.1 试验材料
试验所用的供试材料为市售普通大蒜。受试作物为泰国柳绿空心菜(IpomoeaaquaticForsk.),购于安徽省合肥市合丰种业有限公司。
1.2 大蒜浸提液制备
将蒜瓣用蒸馏水冲洗干净并表面消毒,晾干后磨碎,称取20 g放入三角瓶中,加入蒸馏水,定容至500 mL封口,常温下置摇床160 r/min浸提24 h,过滤后制得浸提液母液,浓度为0.04 g/mL,将母液用蒸馏水稀释成0.040、0.020、0.010、0.005 g/mL 4种浓度的浸提液。所有浸提液放置于4 ℃冰箱中备用。
1.3 大蒜浸提液对空心菜种子萌芽的影响
挑选均匀饱满的空心菜种子,用70%乙醇消毒1 min,蒸馏水冲洗3次。在铺有2张滤纸的培养皿里做发芽试验,每个培养皿加入浸提液5 mL,对照(CK)加入等量蒸馏水。供试材料种子播入培养皿中,每皿30粒,重复3次,放置25 ℃光照培养箱中培养,光暗周期为12 h—12 h,每隔1 d加2 mL相应浓度的浸提液或蒸馏水,每天记录种子的发芽情况。
1.4 大蒜浸提液对空心菜幼苗的影响
种子催芽后播于穴盘中,待长至3叶1心时,用不同浓度大蒜鳞茎浸提液灌根处理,蒸馏水处理作为对照,每个处理各重复3次,每隔3 d处理1次,每次5 mL,处理20 d后对空心菜幼苗的各个指标进行测定分析。
1.5 测定指标与方法
1.5.1 发芽率、发芽指数测定 自播种当天起统计萌发种子数,第4天计算发芽指数,第7天计算发芽率、胚轴长、胚根长。重复3次。种子发芽标准为种子发芽长度的1/2。
1.5.2 株高、根长、鲜质量、干质量的测定 株高、根长测定采用直尺直接量取法;鲜质量测定采用直接洗净称量法;干质量测定采用烘干称量法。
1.5.3 叶片电导率测定 将采集的叶片用去离子水冲洗干净,剪成大小相近的正方形(避开主脉)。每份称量0.1 g放入装有10 mL去离子水的注射器中,不断抽气放气,直至叶片完全沉入水底,将抽真空后的叶片在离子水中处理3 h,用电导仪测定浸提液电导率(R1),然后沸水水浴30 min,冷却后再测定浸提液电导率(R2),每份重复3次,相对电导率=R1/R2×100%。
1.5.4 生理生化指标测定 超氧化物歧化酶(SOD)活性采用NBT光化还原法测定;过氧化物酶(POD)活性采用愈创木酚氧化法测定;过氧化氢酶(CAT)活性采用紫外分光光度法测定;丙二醛(MDA)含量采用硫代巴比妥酸比色法[20]测定。
1.6 数据统计及分析方法
用Excel 2010对数据进行预处理,采用SPSS 19.0对数据进行分析,对差异显著的数据用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 大蒜鳞茎浸提液对空心菜种子萌发的影响
由表1可知,大蒜鳞茎浸提液质量浓度为0.005 g/mL时空心菜种子的发芽率最高,0.010 g/mL浓度时发芽率与对照一致,之后随着处理浓度升高,发芽率呈逐渐降低趋势,但各处理与对照差异均不显著。低质量浓度(0.005 g/mL)处理下,种子的发芽指数较对照有所增加,但差异不显著。其余质量浓度下空心菜种子的发芽指数均降低,高质量浓度(0.020、0.040 g/mL)处理种子的发芽指数与对照差异显著。大蒜鳞茎浸提液对空心菜种子胚根的影响表现为低质量浓度(0.005、0.010 g/mL)促进,高质量浓度(0.020、0.040 g/mL)抑制,各处理与对照差异不显著。除 0.005 g/mL 浓度处理时胚轴较对照增长,其余处理随着大蒜鳞茎浸提液浓度的升高对胚轴增长的抑制作用显著增强。
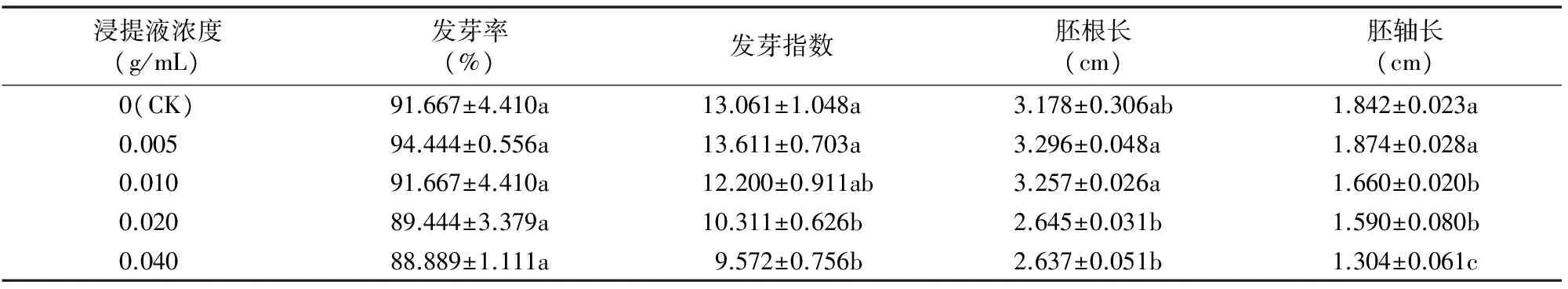
表1 大蒜鳞茎浸提液对空心菜种子萌发的影响
注:同列数据后不同小写字母表示处理间差异显著(P<0.05)。下表同。
2.2 大蒜鳞茎浸提液对空心菜幼苗生长的影响
2.2.1 大蒜鳞茎浸提液对空心菜形态指标的影响 由表2可知,大蒜鳞茎浸提液对空心菜幼苗生长主要表现为低质量浓度促进、高质量浓度抑制。在0.005、0.010 g/mL浓度处理条件下幼苗株高较对照显著增加;0.020、0.040 g/mL浓度处理下株高较对照有所减少,但差异未达显著水平。在0.005、0.010 g/mL 浓度处理下根长增加;0.020、0.040 g/mL浓度处理下的根长较对照显著减少。在低质量浓度(0.005、0.010 g/mL)大蒜鳞茎浸提液处理下能够促进空心菜的鲜质量、干质量的增加,但在高质量浓度(0.020、0.040 g/mL)处理后这些指标受到抑制。其中,0.005、0.010 g/mL浓度处理下鲜质量与对照差异显著;0.010、0.040 g/mL浓度处理下干质量与对照差异显著。
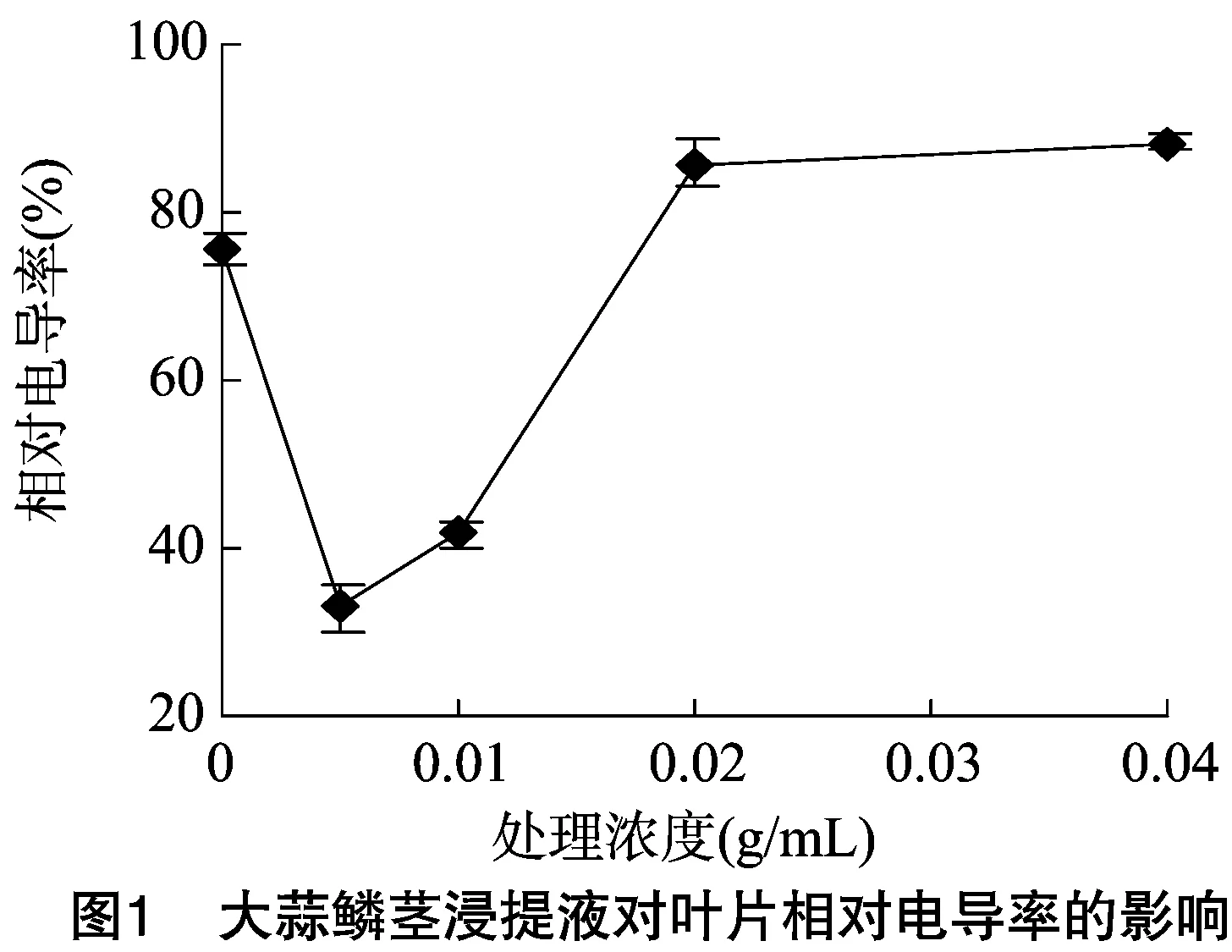
2.2.2 大蒜鳞茎浸提液对空心菜相对电导率的影响 由图1可知,幼苗叶片相对电导率随着处理浓度的上升,表现为先降低再上升。0.005g/mL浓度的大蒜鳞茎浸提液处理后空心菜幼苗叶片的相对电导率较对照降幅最大,达56.5%;其次是0.010 g/mL处理,下降44.7%。0.020、0.040 g/mL处理条件下分别上升13.7%、17.2%。
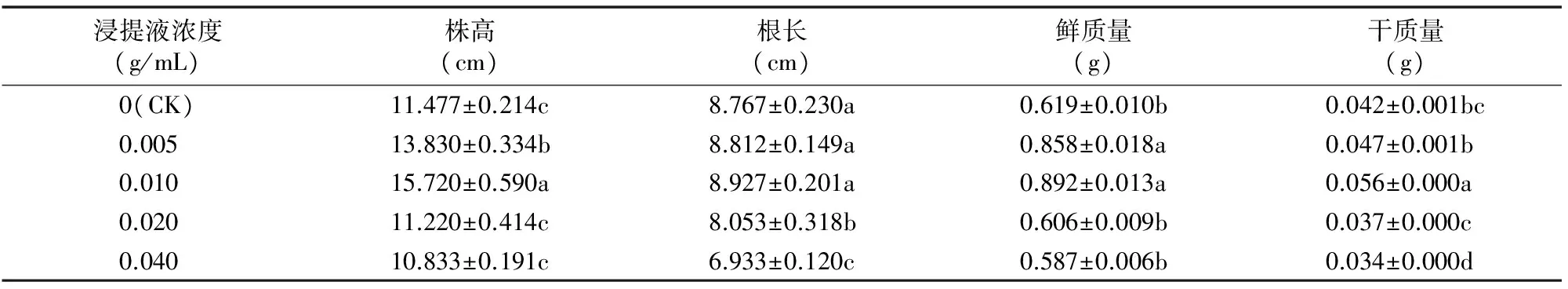
表2 大蒜鳞茎浸提液对空心菜幼苗生长的影响
2.2.3 大蒜鳞茎浸提液对空心菜幼苗体内保护酶活性和MDA含量的影响 由表3可知,空心菜幼苗中SOD活性随着浸提液浓度升高呈先升高后降低的趋势。处理浓度 0.005 g/mL 时幼苗SOD活性与对照差异显著,其他浓度处理与对照相比差异不显著。0.005、0.010 g/mL 处理条件下POD活性较对照上升,0.020、0.040 g/mL 处理条件下POD活性较对照降低。除0.040 g/mL处理条件下CAT活性较对照降低,其余浓度处理条件下CAT活性上升,其中0.005、0.010 g/mL处理与对照差异显著。随着处理浓度的升高,幼苗叶片MDA含量先减少后增加,各处理与对照差异不显著。
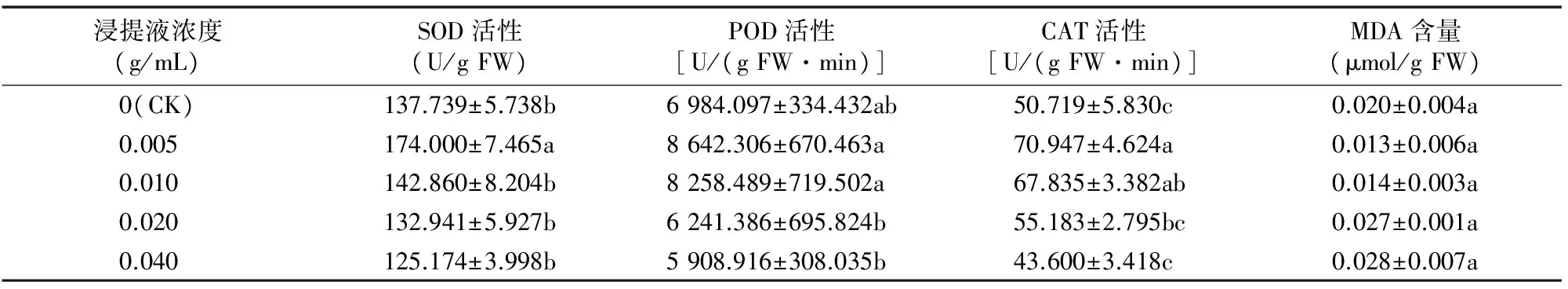
表3 大蒜鳞茎浸提液对空心菜幼苗保护酶活性和MDA含量的影响
3 讨论与结论
化感作用除了依赖于受试物种、品种、化感物质成分等,还与其浓度密切相关。一定浓度条件下抑制某些植物生长的化感物质在更低浓度条件下会促进同种植物或其他植物的生长[21-23]。番茄植株水浸提液对几种受试作物表现明显的低浓度促进和高浓度抑制的双重质量浓度效应[24]。周艳丽等也发现大蒜根系浸提液对番茄、辣椒幼苗生长同样具有高抑低促现象[25]。郑丽等发现不同浓度紫茎泽兰叶片提取液对10种受试植物种子的化感强度不同,低浓度时较弱,高浓度时能降低种子的发芽率、发芽速率、 胚轴长和胚根长[26]。该试验研究也表明,大蒜鳞茎浸提液对空心菜种子萌发和幼苗生长表现为低浓度促进、高浓度抑制的双重浓度效应。
从本质上来讲,一种植物通过化感物质来影响另一种植物的生长发育,就是化感物质对植物生理生化过程的影响。化感物质通过影响细胞膜的透性,改变细胞的分裂、伸长和亚显微结构,影响矿质离子和水分的吸收,影响光合、呼吸作用,影响蛋白质合成,改变核酸的代谢,抑制或刺激某些酶的活性等生命活动,进而影响植物的生长发育。研究发现,鼠尾草叶片中的挥发性物质能够损伤黄瓜细胞膜系统,抑制黄瓜种子胚根和下胚轴细胞的分裂和伸长[27]。水稻浸提液能显著抑制靶标杂草幼苗的SOD、POD活性,提高杂草根部自由基含量,导致膜脂过氧化物MDA含量增加[28]。连慧达等发现红小豆根系水浸液能够增强萝卜、小麦幼苗的SOD、POD活性,减少MDA含量;显著降低白菜的SOD、POD活性,MDA含量大幅度增加[29]。本试验结果表明,大蒜鳞茎浸提液在适当浓度时,幼苗相对电导率下降,SOD、POD、CAT活性增强,MDA含量减少,可能是因为大蒜鳞茎中某些化感物质提高了空心菜保护酶活性,减少自由基含量,降低膜脂过氧化程度,提高植株的抗逆能力,促进幼苗的生长。当浸提液浓度升高,幼苗相对电导率上升,SOD、POD、CAT活性降低,MDA含量增加,植株的长势变弱,株高、根长、鲜质量、干质量都较对照有所减少。
该试验通过室内生物测定法较好地反映了不同质量浓度大蒜鳞茎浸提液对空心菜种子萌发和幼苗生长化感作用差异,但是在自然环境下,化感物质的释放与积累受到诸多环境条件的制约,如光照、养分、水分、土壤微生物等都会对化感物质产生作用。因此,今后还需要紧密结合田间试验,研究大蒜的化感作用及相关的化感物质鉴定,并对其作用机理进一步研究。
[1]Rice E L.Allelopathy[M].2nd ed.New York:Academy Press,1984:130-180.
[2]王大力.水稻化感作用研究综述[J].生态学报,1998,18(3):326-334.
[3]王 峰,张 琪,蔡崇法.生化他感物质的收集与分离[J].科技进步与对策,2000,17(12):198-199.
[4]韩丽梅,沈其荣,鞠会艳,等.大豆地上部水浸液的化感作用及化感物质的鉴定[J].生态学报,2002,22(9):1425-1432.
[5]Patterson D T.Effects of allelopathic chemicals on growth and physiological responses of soybean(Glycinemax)[J].Weed Science,1981,29(1):53-59.
[6]阎 飞.大豆连作障碍中的生化互作作用[J].大豆科学,1998,17(2):147-151.
[7]Jiménez J J,Schultz K,Anaya A L,et al.Allelopathic potential of corn pollen[J].Journal of Chemical Ecology,1983,9(8):1011-1025.
[8]朱 峰,何永福,叶照春.大叶芥菜对眼子菜化感作用潜力的初步评价[J].杂草学报,2016,34(2):49-52.
[9]杨 阳,刘守伟,潘 凯,等.分蘖洋葱根系分泌物对黄瓜幼苗生长及根际土壤微生物的影响[J].应用生态学报,2013,24(4):1109-1117.
[10]李 轩,卢海博,黄智鸿.刺果瓜甲醇提取物对植物化感作用的研究[J].杂草学报,2016,34(4):23-27.
[11]韩小燕.胡葱对番茄幼苗化感作用的研究[D].重庆:西南大学,2009.
[12]宋 君.植物间的他感作用[J].生态学杂志,1990,9(6):43-47.
[13]韩 路,王海珍,曹新川.植物化感作用及其在农业生产中的应用[J].新疆环境保护,2000,22(2):88-92.
[14]丁海燕,程智慧.大蒜化感作用及其利用研究进展[J].中国蔬菜,2014(9):11-16.
[15]周艳丽.大蒜根系分泌物的化感作用研究及化感物质鉴定[D].杨凌:西北农林科技大学,2007.
[16]金扬秀,谢关林,孙祥良,等.大蒜轮作与瓜类枯萎病发病的关系[J].上海交通大学学报(农业科学版),2003,21(1):9-12.
[17]周艳丽,王 艳,李金英,等.大蒜根系分泌物的化感作用[J].应用生态学报,2011,22(5):1368-1372.
[18]林辰壹,郑成锐,程智慧.大蒜鳞茎提取液对黄瓜2种种传病害的抑制及化感作用研究[J].西北农林科技大学学报(自然科学版),2009,37(10):140-144.
[19]魏 玲,程智慧,张 亮.不同品种大蒜秸秆水浸液对番茄的化感效应[J].西北农林科技大学学报(自然科学版),2008,36(10):139-145.
[20]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:210-218.
[21]杨期和,叶万辉,廖富林,等.植物化感物质对种子萌发的影响[J].生态学杂志,2005,24(12):1459-1465.
[22]佟 飞,程智慧,金 瑞,等.大蒜秸秆水浸液醇溶成分的化感作用[J].西北农林科技大学学报(自然科学版),2007,35(6):119-124.
[23]程智慧,耿广东,张素勤,等.辣椒对莴苣的化感作用及其成分分析[J].园艺学报,2005,32(1):100-100.
[24]周志红,骆世明,牟子平.番茄的化感作用研究[J].应用生态学报,1997,8(4):445-449.
[25]周艳丽,程智慧,孟焕文,等.大蒜根系水浸液及根系分泌物的化感作用评价[J].西北农林科技大学学报(自然科学版),2007,35(10):87-92.
[26]郑 丽,冯玉龙.紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J].生态学报,2005,25(10):2782-2787.
[27]余叔文.植物生理与分子生物学[M].北京:科学出版社,1992:376-393.
[28]林文雄,何华勤,郭玉春,等.水稻化感作用及其生理生化特性的研究[J].应用生态学报,2001,12(6):871-875.
[29]连慧达,裴红宾,张永清,等.红小豆根系水浸提液对4种受体作物的化感作用[J].中国农学通报,2014,30(30):65-70.
