喷施吲哚乙酸对铝胁迫下东方百合的生理效应
2018-03-05刘国娟刘殿红孙晓慧
刘国娟,徐 宁,刘殿红,王 闯,刘 敏,孙晓慧
(聊城职业技术学院,山东聊城 252000)
土壤酸化引起的植物铝毒已成为全球生物学和环境科学关注的热点[1]。铝胁迫是酸性土壤限制作物生长的主要原因,目前世界上超过40%的农用耕地受到的危害[2],铝主要抑制植物的根系生长,影响水分及养分吸收,从而影响植物生长和发育[3]。自20世纪初以来,许多研究者们一直致力于铝对植物毒害影响的研究。近年来,人们对植物铝胁迫的研究,尤其是对耐铝植物研究的兴趣有增无减。有些学者提出,外源施加激素可以增强植物的抗铝能力。
吲哚乙酸(IAA)是人类最早发现的一类植物激素,不仅在植物的正常生长中起重要作用,而且还参与调节多种胁迫下植物根系的生长和发育[4]。大量研究表明,IAA可能作为一种化学信号分子,广泛作用于组织培养[5]、基因表达[6]、干旱[7]、水渍[8]等方面。植物激素在环境胁迫下作为正负信号,对细胞内各种代谢进行有效的调控。近年来,IAA被发现与植物的抗逆性有密切联系,可以提高植物抵抗盐、重金属等胁迫的能力,促进逆境胁迫下植物的生长[9]。在镉胁迫下,能够显著增加芥菜型油菜和甘蓝型油菜的株高和生物量,提高油菜茎和叶中的镉含量[10]。IAA可减轻铜毒害对向日葵主根生长的抑制作用,并促进侧根生长[11]。杨野等报道了IAA能够促进耐铝型小麦品种根系苹果酸的分泌,从而提高小麦的耐铝毒能力[12];闫雯等报道了外源施用IAA可促进铝胁迫下紫花苜蓿根系和地上部的生长,能明显缓解紫花苜蓿铝毒害[13]。添加外源IAA可以显著增加丹波黑大豆(RB)的抗铝胁迫能力[4],然而,有关IAA对铝胁迫观赏植物生长影响的研究报道非常少。
百合(Liliumbrowmivar.viridumu)为百合科(Liliaceae)百合属(Lilium)的多年生草本球根花卉[14],是当今世界最著名的四大切花之一,其生产和消费逐年递增。百合原产于北半球温带,少数产于南半球寒带及热带,适宜在排水良好的微酸性环境中生长[15]。目前,以观赏植物作为试验材料来研究不同种、品种对铝胁迫生理响应和耐铝胁迫机理的研究少见报道。本研究通过对百合植物耐铝的生理响应,以期明确铝胁迫下百合的生长反应,特别是对根系生长发育有明显促进作用的植物生长调节剂IAA对铝胁迫下百合的生理效应,为进一步开展百合耐铝的分子和生理机制的研究,培育耐铝的百合新品种奠定理论基础。
1 材料与方法
1.1 材料
选定东方百合索邦品种为试验材料。由周径14~16 cm 鳞茎作为定植材料。
1.2 方法
将经过低温处理的种球栽于营养钵并置于人工气候箱中,设置光—暗周期为14 h—10 h,光照度为10 000 lx,昼—夜温度为25 ℃—16 ℃,相对湿度为70%。设置0、2、4、6、8 mg/L 等5个IAA浓度,采用叶面喷施的方法。
选取生长势一致的幼苗进行酸性环境处理。将百合幼苗放置在pH值为4.5、含100 μmol/L Al3+(铝源用AlCl3·6H2O)的营养液中分别进行为期5、10、15 d的胁迫,其间每隔2 d分别用不同浓度的IAA对铝胁迫百合幼苗进行喷施处理,喷施量为2 mL。同时设置1个无Al3+胁迫处理(pH值4.5)作为对照,喷施等量蒸馏水。全部试验共6个处理,即无铝和Al3++IAA(0、2、4、6、8 mg/L),每个处理3次重复。
1.3 测定指标和方法
1.3.1 丙二醛(MDA)含量测定 采用硫代巴比妥酸(TBA)法[16]测定。
1.3.2 电导率测定 采用张志良介绍的方法[17]测定。
1.3.3 过氧化物酶(POD)含量的测定 采用愈创木酚法[18]测定。
1.3.4 超氧化物歧化酶(SOD)含量的测定 依据SOD抑制NBT(氮蓝四哩)在光下的还原程度来确定SOD活性,活性单位以抑制NBT光化还原的50%为1个酶活性单位(U)[18]。
2 结果与分析
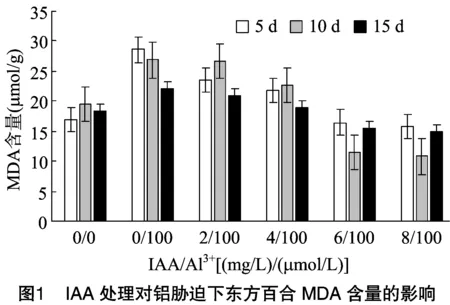
2.1 IAA对铝胁迫下丙二醛的影响
丙二醛(MDA)是膜脂过氧化的产物,也是细胞膜受损伤程度的标志物。如图1所示,与对照相比,添加铝后,MDA含量均有不同程度的提高,说明铝胁迫明显引起了细胞膜的过氧化反应。东方百合的MDA含量在添加铝后分别比对照增高68.6%、38.1%、2.09%。
IAA缓解了铝毒对东方百合的胁迫。添加IAA后,除喷施5 d表现为MDA含量比对照的高外,其余的MDA含量都比添加IAA前低,呈现下降趋势,并且随着IAA浓度的升高,MDA含量越低。其中,6 mg/L IAA处理的丙二醛含量显著低于未喷施IAA的对照。
2.2 IAA对铝胁迫下电导率的影响
由图2可以看出,在铝胁迫下,东方百合的电导率均有所增加,比对照分别增加27.9%、25.7%、30.2%,说明在铝胁迫下,电导率的增加与膜功能损伤成正相关,能作为逆境胁迫的有效指标。此外,IAA的增加,对膜损伤起到了一定的恢复作用,随着IAA浓度的提高,电导率也基本呈现降低的趋势,在6 mg/L处理下,电导率达到了最低点,差异最明显。

2.3 IAA对铝胁迫下过氧化物酶(POD)活性的影响
从图3可以看出,东方百合的POD活性随着铝胁迫时间的延长,呈现持续增高的趋势,并均高于无铝胁迫,增幅分别达13.1%、25.8%、26.0%,增高幅度也是逐渐上升。此试验结果说明铝胁迫促进了东方百合POD酶的形成和活性。
在铝胁迫5 d时加入IAA,不同程度地增加了东方百合的POD活性,但当铝胁迫时间延长至10 d后,IAA的加入降低了东方百合POD的活性,并在处理10 d 时,POD活性达到最低值,随着IAA浓度的提高,POD活性也呈现下降趋势。

2.4 IAA对铝胁迫超氧化物歧化酶(SOD)活性的影响
由图4可知,在铝胁迫下,SOD活性呈现先升后降的趋势。铝胁迫10 d后SOD活性比胁迫5 d的增高6.2%,胁迫15 d的比胁迫10 d的降低10.8%。但是,在铝胁迫5、10、15 d 下,SOD活性分别降低为无铝对照的86.8%、88.8%、68.2%。说明铝胁迫不同程度地降低了东方百合SOD活性,铝胁迫抑制了SOD的活性。
喷施IAA显著影响了东方百合SOD的活性。在喷施低浓度的IAA时,SOD活性基本呈下降趋势,但是随着IAA浓度的提高,SOD活性显著增高。在处理10、15 d后,6 mg/L IAA对SOD活性的影响最为显著。

3 结论与讨论
丙二醛(MDA)含量和电导率是反映细胞膜脂过氧化作用程度和质膜破坏程度的重要指标,可以用来衡量植物对逆境胁迫的抵御能力[19]。盐逆境往往会造成植物的生长受阻和组织伤害,常常出现生长缓慢,叶色变淡、脱落甚至死亡等可见表现和体内生理指标的改变,如脯氨酸含量增加、细胞膜透性增大以及光合能力下降等[20]。本研究结果表明,铝胁迫后5、10、15 d,东方百合的MDA含量始终高于无铝胁迫,说明铝胁迫对东方百合细胞膜产生了明显的破坏,同时东方百合MDA含量增长率逐渐降低,与对照之间的差距越来越小,可见在铝胁迫下,东方百合通过自身防御系统的增强和活性氧的消除,逐渐缓解了铝毒对其的伤害。此研究结果与前人的研究结果[21]一致。本研究结果显示,在铝胁迫下,东方百合的电导率也始终高于无铝胁迫,表明铝胁迫对东方百合质膜结构造成伤害,电解质外渗增加,细胞离子平衡受到影响,并直接影响到东方百合的生长。本研究结果也与刘鹏等对大豆铝胁迫处理下的研究结果[22]一致。当植物处于逆境时,POD和SOD等保护酶能有效地消除过氧化所产生的活性氧物质,防御植物细胞膜过氧化,降低植物细胞受伤害的程度[23]。本研究中铝胁迫不同程度地降低了东方百合SOD活性,表明铝胁迫抑制了细胞中SOD的合成和活性,这个结果与许多学者的研究结果[24]一致。本研究结果显示,铝胁迫下东方百合的POD活性随着铝胁迫时间的延长呈现持续增高的趋势,并且始终高于无铝胁迫,表明铝胁迫促进了东方百合POD酶的形成和活性。
生长调节剂可以通过促进植物生长来缓解重金属胁迫,国内外针对生长调节剂缓解重金属胁迫、减轻膜系统损伤的研究已有报道。IAA是植物体内重要的信号物质,不仅可以调控植物的生长发育,而且在植物抗逆胁迫调控抗氧化物酶体系中发挥着重要作用[25-27]。在本研究中添加IAA后,SOD活性呈现先下降后上升趋势,POD活性呈现先上升后下降趋势,结果表明,IAA促进铝胁迫东方百合根系生长和发育首先是通过提高铝胁迫东方百合POD活性来清除铝胁迫诱导和积累的根细胞氧自由基,减轻细胞受到活性氧离子的伤害,从而保护细胞膜质的稳定性。此试验证明,在铝胁迫处理下,植物抗氧化酶与植物生长调节剂之间存在密切的相关性,与王学等研究结果[28]一致。
[1]任晓燕,周 鹏,安 渊.喷施IAA对紫花苜蓿幼苗铝毒害的缓解作用[J].草业科学,2014,31(7):1323-1329.
[2]冯英明,喻 敏,王昌全,等.铝胁迫诱导植物细胞反应研究进展[J].华中农业大学学报,2005,12(6):320-324.
[3]Kochian L V.Cellular mechanisms of aluminum toxicity and resistance in plants[J].Annual Review of Plant Physiology & Plant Molecular Biology,1995,46(1):237-260.
[4]王 平,陈 奇,陈东杰,等.外源添加IAA对铝胁迫下黑大豆根系生长的影响[J].大豆科学,2013,32(5):650-654.
[5]Cui K R,Xing G K,Zhou G K.The induced and regulatory effects of hormones in somatic embryogesis[J].Hereditas,2000,22(5):349-354.
[6]Wang Z L,Gao W X.Regulation of plant gene expression by cytokinins[J].Plant Physiology Communications,2000,36(1):82-88.
[7]Ivanova A P,Stefanov K L,Yordanov I T.Effect of cytokinin 4PU-30 on the lipid composition of water stress been plants[J].Biologia Plantarum,1998,41(1):155-159.
[8]Liu X Z,Li J K,Wang Z X,et al.Effect of cytokinin on resistance of summer maize to waterlogging[J].Acta Agronomica Sinica,1996,22(4):403-408.
[9]陈志杰,张 锋,王 琦.常见植物激素的科学使用[J].西北园艺,2007(1):4-6.
[10]向言词,官春云,黄 璜,等.植物生长调节剂IAA、GA和 6-BA 对芥菜型油菜和甘蓝型油菜富集镉的强化[J].农业现代化研究,2010(4):4-5.
[11]Ouzounidou G,Ilias I.Hormone-induced protection of sunflower photosynthetic apparatus against copper toxicity[J].Biologia Plantarum,2005,49(2):223-228.
[12]杨 野,王巧兰,耿明建,等.生长素对铝胁迫下不同耐铝性小麦根苹果酸分泌的影响[J].中国农业科学,2010,43(10):2016-2022.
[13]闫 雯,张兴兴,安 渊.二种生长调节剂对紫花苜蓿铝胁迫和恢复生长的影响[J].上海交通大学学报,2011,29(2):75-82.
[14]赵祥云.百合[M].北京:中国农业出版社,2000.
[15]华智锐,马锋旺,李小玲,等.百合组培苗对盐胁迫的生理反应[J].西北农林科技大学学报(自然科学版),2007,35(4):179-184.
[16]王 忠.植物生理学[M].北京:中国农业出版社,2000:121-184.
[17]张志良.植物生理学实验指导[M].北京:高等教育出版社,2003:67-70.
[18]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[19]Dong B,Sang W L,Jiang X,et al.Effects of aluminum on physiological metabolism and antioxidant system of wheat (TriticumaestivumL.)[J].Chemosphere,2002,47(1):87-92.
[20]许祥明,叶和春,李国凤.植物抗盐机理的研究进展[J].应用与环境生物学报,2000,6(4):379-387.
[21]李朝苏,刘 鹏,徐根娣.铝对芥菜幼苗根系形态和叶内抗氧化系统的影响[J].园艺学报,2006,33(3):645-648.
[22]刘 鹏,徐根娣,姜雪梅.铝对大豆幼苗膜脂过氧化和体内保护系统的影响[J].农业环境科学学报,2004,23(1):51-54.
[23]李艳芳,包国章,刘晓婷,等.冻融及碱性盐胁迫下紫花苜蓿幼苗的生理响应[J].江苏农业科学,2016,44(7):278-281.
[24]周红卫,施国新,陈景耀.6-BA对水花生抗氧化酶系Hg2+毒害的缓解作用[J].生态学报,2003,2(3):12-14.
[25]李智洋,李亚男,陈大清.光与IAA和NAA对拟南芥下胚轴伸长的影响[J].长江大学学报,2006,3(3):169-171.
[26]郭 健,曹 珂,朱更瑞,等.蟠桃与圆桃果实4种内源激素含量差异分析[J].江苏农业科学,2016,44(3):196-199.
[27]李 畅,苏家乐,肖 政,等.旱涝交替胁迫下杜鹃花叶片内源激素含量的变化[J].江苏农业科学,2016,44(7):233-235.
[28]王 学,施国新,徐勤松.外源亚精胺缓解荇菜Cr6+毒害的生理研究[J].环境科学学报,2003,23(5):690-693.
