急性心肌梗死行血栓抽吸患者冠状动脉内微粒与外周血微粒中microRNA基因芯片的差异性表达分析
2018-03-05温宁馨祖凌云王贵松牛杰张永珍韩江莉崔鸣高炜
温宁馨 祖凌云 王贵松 牛杰 张永珍 韩江莉 崔鸣 高炜
急性ST段抬高型心肌梗死(ST-segment elevated myocardial infarction, STEMI)是心血管疾病中的一个严重临床类型。临床上对于STEMI患者行急诊经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)时,如血栓负荷较重,通常行血栓抽吸以减少梗死相关动脉(infarctrelated artery,IRA)的慢血流 /无复流的发生[1]。血栓抽吸所得的IRA局部血液为研究心肌梗死血管局部微环境及活性物质提供了 “犯罪现场”的真实资料。
微粒是从细胞表面以出芽的方式产生的具有双层膜结构的微小囊泡,直径范围0.4~1μm。微粒膜表面携带着大量受体/配体,囊泡内含有蛋白、mRNA、microRNA等。微粒可以与靶细胞通过受体/配体方式结合,激活靶细胞相关信号通路;或直接与靶细胞融合,将自身携带的生物活性物质转移到靶细胞内,影响靶细胞的生物行为[2]。因此,微粒是介导体内病理生理过程的重要信使。我们团队的前期研究发现急性心肌梗死患者行急诊PCI术后血浆中不同来源微粒随着心肌梗死时程的动态变化[3],因此推测微粒在急性心肌梗死的病理生理进展过程中发挥了重要作用。
microRNA是微粒的重要内容物,是一类内源性长度为 22 nt的非编码小分子RNA。microRNA可以通过作用于相应的靶mRNA调控基因表达,在许多疾病的发病机制中起着重要的调控作用[4]。microRNA是微粒内发挥病理生理作用的重要组成成分。为了进一步明确微粒在急性心肌梗死的病理生理进展过程中的作用,本研究提取了急性心肌梗死血栓抽吸所得的冠状动脉内局部血液及外周血样中的微粒,通过基因芯片测序筛选微粒的microRNA表达谱差异,并对其功能及可能作用的靶点进行分析和预测,以便为进一步深入研究微粒在急性心肌梗死局部微环境中的病理生理机制提供线索。
1 对象和方法
1.1 研究对象
连续入选2014年6月至2017年6月于发病12 h 内在北京大学第三医院行直接 PCI 的 STEMI患者,按标准Judkins法经股动脉或桡动脉入路行冠状动脉造影检查,确认IRA,根据造影判定血栓负荷较重(TIMI血栓分级≥Ⅱ级)[5],预计置入支架前行血栓抽吸的患者(STEMI患者于行急诊PCI前入选并填写知情同意书,如果病情不需要行血栓抽吸,则自动退出)。STEMI 的诊断符合中华医学会心血管病学分会2010年《急性ST段抬高型心肌梗死诊断和治疗指南》诊断标准[6]。排除标准:(1)患者合并急慢性感染、肝肾功能不全、血液系统疾病、严重出血、自身免疫性疾病、恶性肿瘤、严重创伤、非动脉粥样硬化导致的急性心肌梗死等情况;(2)发病前服用抗血小板药物1周以上的患者;(3)非ST段抬高型心肌梗死患者;(4)既往陈旧性心肌梗死者。患者通常进行血栓抽吸2~4次,留取血样10~15 ml,同时留取外周血样(桡动脉或股动脉穿刺部位)10~15 ml。其中5例的血样用于基因芯片检测,25例用于其他研究。本临床研究方案经北京大学第三医院临床试验伦理委员会批准[伦理档案编号:PUTH-REC-SOP-06-3.0-A27(2013)医伦申第(105-3)号]。患者均在签署知情同意书之后入组。
1.2 研究方法
1. 2. 1 样品处理 将血栓抽吸血样及外周血样予109 mmol/L枸橼酸钠1︰9全血抗凝,4℃暂存;后200 g,15 min离心去血细胞,并记录红细胞体积;13 800 g,4 min去除剩余血小板,取上清,–80℃分装冻存。以上操作除离心外,均在无菌操作台,且在抽吸后4 h内完成。
1. 2. 2 微粒的鉴定和提取 将分装血清样品于室温或37℃迅速溶解。根据微粒表面带有AnnexinV及不同母细胞来源的标记,将微粒标以不同荧光标记抗体(CD144,CD45,CD41b)以及 AnnexinV 染料双标,调整抗体比例。将500 μl标记好抗体及染料的微粒悬液与BD Trucount Tube中的粒子混匀(该粒子在任意荧光通道均可被检测到),限定收集粒子数为1000后,在Beckman Coulter Gallious进行微粒数量及种类绝对定量。10组样品分别取200 μl血清,以磷酸盐缓冲液(PBS)稀释,100 000 g,60 min 离心,弃上清,分离得到微粒。将微粒用少量PBS沉淀重悬,将样品吸附在碳包被的铜网上,使用JEM-1400 plus透射式电子显微镜确定分离所得微粒保持完整生理结构。按前述方法检测,分析回收率,记录数值,作为后续试验校正值。
1. 2. 3 样品总RNA抽提及质量检测 超速离心所得微粒加入适量Trizol,进行充分裂解,裂解后抽提RNA。使用Nanodrop测定RNA在分光光度计260 nm、280 nm和230 nm的吸收值,以计算浓度并评估纯度。甲醛电泳试剂(上海康成生物工程公司提供)进行变性琼脂糖凝胶电泳,检测RNA纯度及完整性。
1. 2. 4 microRNA标记及芯片杂交 使用miRCURYTM Array Power Labeling kit标记样品。混合试剂,与样品在16℃避光孵育1 h,标记酶将Hy3TM或Hy5TM荧光基团标记microRNA,可以得到与芯片杂交的荧光探针。将以标定之荧光小核酸样品与2×microRNA 杂交缓冲液(hybridization buffer)混合并加入适当体积纯水制备样品。样品进行PCR加热 95°C,2 min后,以微量吸量管加入一端样品注入口,注入后用注入口夹子将杂交袋两端封口。将以注入样品之芯片置于56°C杂交烘箱中,2 r/min垂直转速,过夜。充分杂交后,拆开杂交袋将芯片取出,并于预热56°C清洗溶液 (buffer A)清洗2 min,buffer B室温清洗2 min,再进行1次buffer B 2 min,25°C后,以buffer C进行室温清洗 2 min,最后用水进行短暂清洗再以离心将芯片甩干。
1. 2. 5 数据采集及标准化 芯片经洗涤后立即使用Axon GenePix 4000 B微阵列扫描仪扫描芯片的荧光强度,并使用GenePix Pro 6.0读取荧光强度,去除背景后通过对每个探针上的四个平行点的均值计算得出绿色荧光信号的强度,把实验结果转换成数字型数据保存。将血栓抽吸血样及外周血样共10例样品的microRNA 表达量采用中值归一化法获得归一化数据到同一数量级,获取标准表达量(standard expression)。相同的探针取中值合并。保留在所有样品中均≥30.0的探针,对全部芯片进行中值标准化,筛选差异表达探针,对差异表达microRNA进行聚类并绘制聚类图。
1. 2. 6 靶基因预测及功能分析 采用基因芯片分析所得到的具有差异的microRNA,通过miRanda,mirbase,Targetscan三大收集该物种的靶基因数据库,将三种数据库的结果交集作为获得这些差异microRNA的靶基因结果。对这些差异的microRNA的靶基因使用KOBAS3.0进行GO与Pathway,Reactom,Disease注释。从注释结果中挑选部分感兴趣的通路,反向寻找microRNA与靶基因的关系(microRNA-mRNA对应关系)最后将所得的基因运用cytoscape进行作图。
1.3 统计学分析
所有数据采用SPSS19.0统计软件处理分析。计量资料用均数±标准差(中位数)表示,计数资料用占病例的百分比表示。对于microRNA在血栓抽吸血样及外周血样的微粒表达水平的比较,采用归一化表达量=microRNA表达量/样品总表达量×106,若microRNA表达量为0,则把数值修正为 0.01;若两样品microRNA 表达量都<1,则此microRNA不能用于差异性表达分析。数据不符合参数检验条件,采用配对样本的非参数秩和检验。数据符合参数检验的条件,采用样本t检验。 对于microRNA表达水平的分层分析,采用独立样本的非参数秩和检验。倍比值=log2(抽吸组归一化表达量/外周组归一化表达量)。当倍比值≥1.5且P≤0.05时,认为 microRNA 具有统计学差异性表达。
2 结果
2.1 患者基线资料分析
本研究共入组2014年6月至2017年6月STEMI行血栓抽吸患者30例。患者平均年龄为56岁,男性患者26例(86.7%);合并高血压病14例(46.7%),高血脂13例(43.3%),糖尿病9例(30.0%);吸烟史19例(63.3%);左心室射血分数降低10例(33.3%);超敏肌钙蛋白(hs-TnT)增高28例(93.3%),平均值为(4.77±3.31)ng/ml,中位数为4.74 ng/ml;肌酸激酶(CK)增高26例(86.7%),平均值为(1889.64±1574.77)U/L,中位数为1600 U/L;肌酸激酶同工酶(CK-MB)增高25例(83.3%),平均值为(182.76±152.62)U/L,中位数为180 U/L。
2.2 提取微粒的鉴定
将分离得到的微粒沉淀以PBS轻洗重悬,于激光共聚焦显微镜下及冰冻显微镜下观察提纯微粒,可见双层膜结构。其直径约300 nm,符合文献报道范围(100~1000 nm)[7]。
2.3 RNA质量检测结果 (表1)
STEMI患者血栓抽吸血样及外周血样共10例样本提取的微粒RNA浓度、纯度及完整性均通过标准规范,可执行进一步芯片分析。
2.4 microRNA芯片筛选结果
STEMI患者血栓抽吸血样及外周血样中微粒的microRNA芯片表达谱对比发现差异表达的microRNA共有307个,其中有221个表达上调,86个表达下调。上调microRNA包括hsa-miR-1263,hsa-miR-625-5p,hsa-miR-648,hsa-miR-4309,hsamiR-4320等;下调microRNA包括hsa-miR-634,hsa-miR-103a-3p,hsa-miR-2110,hsa-miR-125b-1-3p,hsa-miR-5581-3p等。
2.5 microRNA芯片差异表达数据聚类分析(图1)
聚类分析结果显示血栓抽吸5例样本全部出现在同一个簇中,外周血样中仅有1例游离于簇之外。结果证明血栓抽吸血样及外周血样间有较大的基因差异表达,且可能分别具有类似的生物学功能。
2.6 差异microRNA下游靶基因及功能分析(图 2)
考虑上调或下调的倍数、差异有统计学意义以及目前相关数据库有相应靶标预测数据等多方面综合分析,本研究结果主要对49个与心血管疾病相关性高的microRNA进行了下游靶基因的预测和分析,发现他们的作用靶点广泛,与细胞周期调控、信号转导等都有密切关系,并且与转化生长因子β(TGF-β)等影响心脏纤维化的信号通路都有很强的关联性。这49个与心血管疾病相关性高的microRNA主要包括 hsa-miR-625-5p,hsa-miR-648,hsa-miR-3613-3p,hsa-miR-875-3p,hsa-miR-647,hsa-miR-155-5p,hsa-miR-137,hsa-miR-186-3p,hsa-miR-199b-5p 等。
3 讨论
STEMI患者PCI术血栓抽吸的应用旨在降低远端血栓的发生率,更有效地实现早期再灌注。有关血栓抽吸的早期临床研究共纳入1071例,以死亡率为次要终点的单中心试验,其结果提示在STEMI患者中行血栓抽吸术可以减小梗死面积以及提高生存率[8]。然而纳入7224例STEMI患者 TASTE 研究[9]和10732例TOTAL 研究[10]却进一步提示 PCI术前进行血栓抽吸并不能降低患者的近期死亡率,同时未降低因心肌梗死而再入院和支架内血栓形成的发生率。基于以上结果,2015年美国心脏病学会(ACC)/美国心脏协会(AHA)/心血管造影和介入学会(SCAI)对STEMI患者直接PCI指南进行了更新将常规血栓抽吸的推荐级别由Ⅱa 级降至Ⅲ级[11]。STEMI患者的IRA内是否存在某些有益的成分,作为人体的一种代偿机制促进心肌修复,而这些成分可能在血栓抽吸的同时被弃去,从而丧失心肌保护作用,进而导致了血栓抽吸的临床获益有限。本研究重点研究了血栓抽吸血样及外周血样提取微粒内的microRNA变化,进一步明确血栓抽吸血样内成分与外周血样成分的差异,试图为进一步解释血栓抽吸获益有限提供线索。
2013年,瑞典卡罗琳医学院授予James E.Rothman等三位科学家诺贝尔医学及生理学奖,以奖励他们“发现了细胞囊泡交通的运行与调节机制(for their discoveries of machinery regulating vesicle traffic, a major transport system in our cells)”。这些囊泡即为微粒。微粒广泛参与细胞的黏附、迁移、增殖、凋亡、免疫应答、血管新生、血栓形成及细胞间信息交流等过程中都发挥着重要作用。近年来,微粒病理生理作用逐渐被认识,炎症反应、心血管疾病、肿瘤、感染及正常或病理妊娠等多种状态均可刺激其过度产生[12]。微粒已被认为是一种生物标记或介质,在多种疾病中存在并发挥作用。本课题组的团队是国内较早开展介入治疗的心脏中心,从2010年就致力于冠状动脉抽吸血液相关微环境信息研究,成功建立了血浆微粒检测平台,并已经积累了相当数量的STEMI患者冠状动脉内抽吸血样本及数据研究。在我们的前期研究中发现,微粒与动脉粥样硬化具有一定的相关性,早期动脉粥样硬化患者经过降压、降脂治疗后,其血浆中内皮细胞来源的微粒具有一定的抗炎作用,可以抑制单核细胞在内皮细胞上的黏附[13]。同时,本课题组还检测了STEMI患者行急诊PCI术后血浆内微粒水平,发现其在PCI术后逐渐上升,48 h达顶峰[14]。由此可以明确STEMI患者体内确实存在微粒水平的动态变化,推测微粒参与了急性心肌梗死的病理生理发展变化。关于微粒影响靶细胞的具体机制研究一直是其热点方向,近年来随着microRNA逐渐进入公众视野,越来越多研究将其与微粒中所含的microRNA联系了起来,关于microRNA与心血管疾病的关系已经是当前的一个研究热点。microRNA是一类新颖的、高度保守的小分子非编码单链RNA,在转录后水平对基因表达进行负向调控,导致翻译抑制或mRNA降解[15]。现在已有证据表明microRNA所介导的基因调控在心脏自身稳态与病理性重构中起到了重要的作用[16]。例如TGFβ1和TGFβ2可以介导microRNA-21的表达,microRNA在心脏纤维化中起着重要的作用,同时还可以抑制microRNA-30家族的表达[17]。
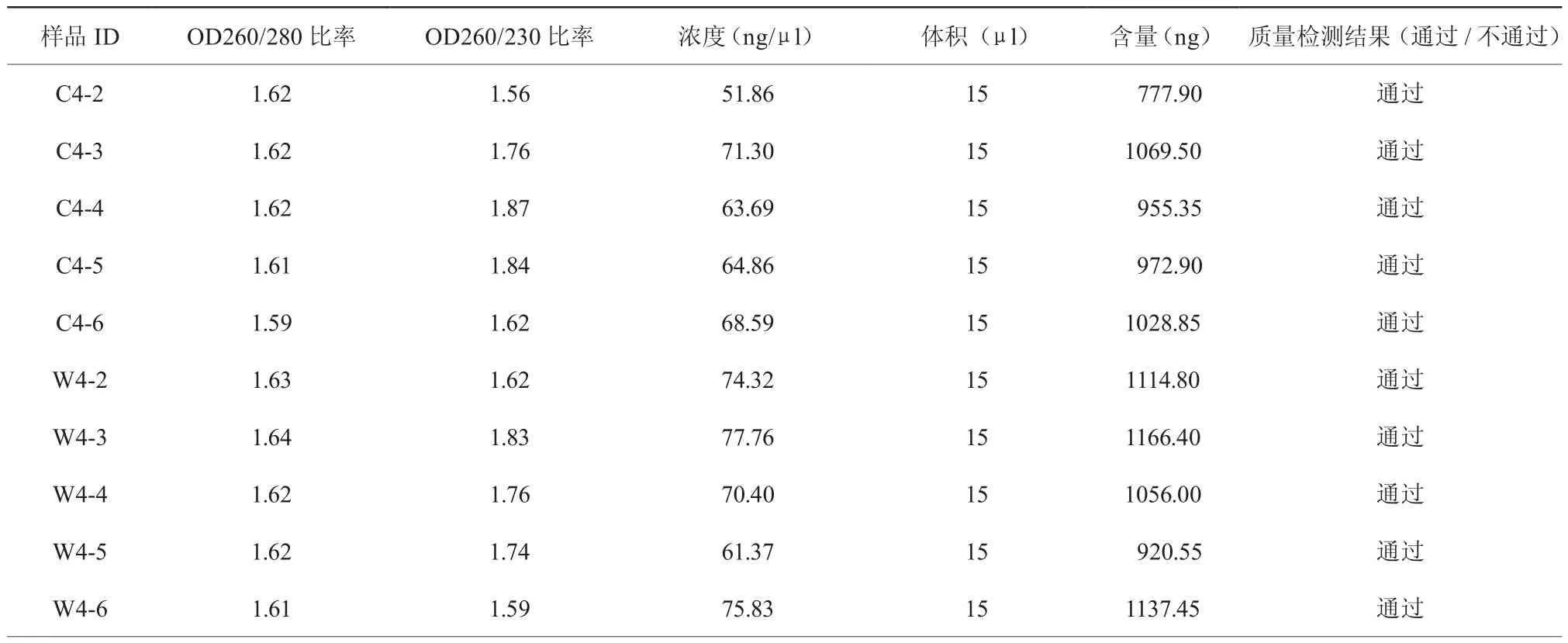
表1 样品RNA浓度、纯度及完整性
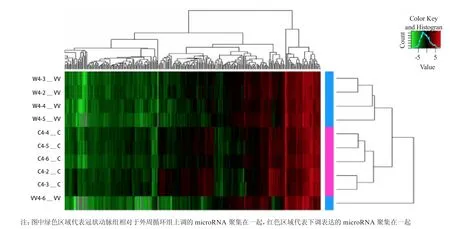
图1 microRNA聚类分析

图2 与心血管疾病相关的microRNA及其可能作用的靶基因
本研究中主要提取了STEMI患者冠状动脉血栓抽吸血样及外周血样中微粒,并进一步通过基因芯片筛查并分析了microRNA表达谱的差异和其可能的下游靶点和功能。本研究发现上述差异表达的microRNA中有很大一部分目前还没有关于心血管方面的研究。在所有的差异基因中,通过GO富集分析对差异基因按GO分类,并对分类结果进行基于正态分布的显著性分析、富集度分析,得到与心血管疾病有显著相关的hsa-miR-625-5p,hsamiR-648,hsa-miR-3613-3p等49个microRNA。通过靶基因预测软件miRanda,mirbase,Targetscan筛查上述microRNA的作用靶基因。为了降低假阳性率,我们采用三个软件同时预测到的基因作为主要靶基因。其中如hsa-miR-155已经被发现下调其水平可以减轻心脏的病理性肥大[18];hsa-miR-212可以同时调节心脏肥大以及心肌细胞的自噬[19]。但还有许多基因如hsa-miR-199b,hsa-miR-625等目前只在癌症领域有所涉及,对于心血管系统有何影响是一个很有意义的研究方向。
本研究通过收集冠状动脉血栓抽吸血样,进行心肌梗死相关病理生理研究分析,具有一定的创新性。以往对急性心肌梗死相关病理生理机制的研究多基于动物模型实验,但是动物模型本身的局限性以及人体实际病理生理过程的复杂性,动物模型与人体存在一定差异[20]。血栓抽吸为我们获得真实的急性心肌梗死患者微环境信息提供了珍贵的样本。血栓抽吸所得的梗死局部血液为我们研究心肌梗死血管局部微环境及活性物质提供了重要信息。
综上所述,急性心肌梗死患者冠状动脉血栓抽吸血样与外周血样的微粒所含有的microRNA表达具有显著性差异,其中有49个与心血管疾病密切相关,可以作为进一步研究的靶点。本研究结果提示了急性心肌梗死患者冠状动脉血栓抽吸血样与外周血样中微粒总含量及其组分的区别,揭示了微粒中microRNA的差异表达谱。冠状动脉血栓抽吸血样与外周血样中差异的microRNA可能是导致对于血栓负荷重的患者行血栓抽吸术后并未降低死亡率及再入院率的原因之一,其机制可能是血栓抽吸血中所含有的一些对心血管系统有保护作用的microRNA被抽走。目前对于微粒中microRNA对于心血管疾病的影响的研究绝大部分还处于实验室阶段,如何将基础实验的科研结果推向临床是将来研究中首先需要考虑的。因此对于本实验还需要进一步扩大样本量并对所筛查出的差异基因进一步细化分析及实验,以期从中找出真正影响心血管系统的新靶点。
[1] Fröbert O, Lagerqvist B, Olivecrona GK, et al. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med,2013,369(17):1587-1597.
[2] Burger D, Schock S, Thompson CS, et al. Microparticles:biomarkers and beyond. Clin Sci (Lond), 2013,124(7):423-441.
[3] Zhou B, Li J, Chen S, et al. Time course of various cell origin circulating microparticles in ST-segment elevation myocardial infarction patients undergoing percutaneous transluminal coronary intervention. Exp Ther Med, 2016 ,11(4):1481-1486.
[4] Porro C, Trotta T, Panaro MA. Microvesicles in the brain:Biomarker, messenger or mediator ? J Neuroimmunol,2015,288:70-78.
[5] Gibson CM, de Lemos JA, Murphy SA, et al. Combination therapy with abciximab reduces angiographically evident thrombus in acute myocardial infarction: a TIMI 14 substudy.Circulation, 2001,103(21):2550-2554.
[6] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 急性ST段抬高型心肌梗死诊断和治疗指南. 中华心血管病杂志,2010,38(8):675-688.
[7] Boulanger CM, Loyer X, Rautou PE, et al. Extracellular vesicles in coronary artery disease. Nat Rev Cardiol, 2017 ,14(5):259-272.
[8] Vlaar PJ, Svilaas T, van der Horst IC, et al. Cardiac death and reinfarction after 1 year in the Thrombus Aspiration during Percutaneous coronary intervention in Acute myocardial infarction Study (TAPAS): a 1-year follow-up study. Lancet,2008,371(9628):1915-1920.
[9] Lagerqvist B, Fröbert O, Olivecrona GK, et al. Outcomes 1 year after thrombus aspiration for myocardial infarction. N Engl J Med, 2014,371(12):1111-1120.
[10] Jolly SS, Cairns JA, Yusuf S, et al. Randomized trial of primary PCI with or without routine manual thrombectomy.N Engl J Med, 2015,372(15):1389-1398.
[11] Levine GN, Bates ER, Blankenship JC, et al. 2015 ACC/AHA/SCAI Focused Update on Primary Percutaneous Coronary Intervention for Patients With ST-Elevation Myocardial Infarction: An Update of the 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention and the 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction. J Am Coll Cardiol, 2016,67(10):1235-1250.
[12] 任川,祖凌云,郭丽君,等. 微粒在动脉粥样硬化发生发展中的作用.中国介入心脏病学杂志, 2014, 22(3): 188-190.
[13] Zu L, Ren C, Pan B, et al. Endothelial microparticles after antihypertensive and lipid-lowering therapy inhibit the adhesion of monocytes to endothelial cells. Int J Cardiol, 2016,202:756-759.
[14] Zhou B, Li J, Chen S, et al. Time course of various cell origin circulating microparticles in ST-segment elevation myocardial infarction patients undergoing percutaneous transluminal coronary intervention. Exp Ther Med, 2016 ,11(4):1481-1486.
[15] Lee D, Shin C. MicroRNA-target interactions: new insights from genome-wide approaches. Ann N Y Acad Sci,2012,1271:118-128.
[16] Thum T. Noncoding RNAs and myocardial fibrosis. Nat Rev Cardiol, 2014,11(11):655-663.
[17] Volkmann I, Kumarswamy R, Pfaff N, et al. MicroRNA-mediated epigenetic silencing of sirtuin1 contributes to impaired angiogenic responses. Circ Res, 2013,113(8):997-1003.
[18] Seok HY, Chen J, Kataoka M, et al. Loss of MicroRNA-155 protects the heart from pathological cardiac hypertrophy. Circ Res, 2014,114(10):1585-1595.
[19] Ucar A, Gupta SK, Fiedler J,et al. The miRNA-212/132 family regulates both cardiac hypertrophy and cardiomyocyte autophagy. Nat Commun, 2012,3:1078.
[20] Frangogiannis NG. The inflammatory response in myocardial injury, repair, and remodelling. Nat Rev Cardiol, 2014,11(5):255-265.
