心外膜左心室重建术对前间壁瘢痕形成的缺血性心力衰竭患者的短期安全性及疗效评价
2018-03-05王建肖国胜王斌林智尤颢胡珀元杨谦赖可可苏茂龙温红梅赵之伟王焱
王建 肖国胜 王斌 林智 尤颢 胡珀元 杨谦 赖可可 苏茂龙 温红梅赵之伟 王焱
我国目前急性心肌梗死的急诊救治网络尚不健全,胸痛中心正处于建设中[1-2]。有相当多的患者无法在时间窗内开通罪犯血管,导致大面积心肌坏死后形成瘢痕。坏死心肌处收缩力下降或丧失,左心室收缩顺序改变、瘢痕区域的矛盾运动,严重影响急性心肌梗死后重塑的左心室功能[3];在心腔内压力的作用下,坏死处的瘢痕组织向外膨出形成室壁瘤,是急性心肌梗死后的常见并发症之一[4]。室壁瘤内血栓栓塞的风险也是导致急性心肌梗死患者再次发生心脑血管事件的重要因素[5]。此外,急性心肌梗死后大面积瘢痕形成的缺血性心力衰竭患者伴有恶性心律失常、心功能不全或功能性的二尖瓣反流是埋藏式心律转复除颤器(ICD)、心脏再同步除颤器(CRT-D)植入或经皮二尖瓣修复术(MitraClip)指征。但是,国内左心室射血分数(LVEF)降低的缺血性心肌病患者ICD的植入率很低[6]。梗死瘢痕区域的存在导致患者对心脏再同步化治疗的低应答,冠状动脉旁路移植术时进行左心室重建也未能降低缺血性心力衰竭患者的总死亡率[7]。
目前,通过经导管途径的左心室重建术或左心室分区术,旨在减小左心室容积,改善或消除大面积左心室瘢痕患者的室壁活动异常,增加患者的心输出量并降低血栓栓塞和瘢痕相关的恶性心律失常的发生率。我们前期经导管途径使用Parachute装置进行左心室分区术的临床研究[8-11],结果表明行经皮左心室分区术的短期安全性和较高的手术成功率,术后患者的有创心排量、超声心动图以及包括美国纽约心脏病协会(NYHA)分级、6分钟步行试验在内的心功能指标均较术前有所改善。
2017年2月起,厦门大学附属心血管病医院心脏团队使用Revivent系统完成10例前间壁瘢痕形成的缺血性心力衰竭患者心外膜左心室重建术。这是缺血性心力衰竭器械治疗领域的又一次尝试,并取得了良好的手术效果。本文分析10例手术的临床效果并对初步的操作经验作一总结。
1 对象和方法
1.1 研究对象
患者的入选标准:(1)年龄≥18岁;(2)透壁性前间壁心肌梗死后90 d以上、接受最优化抗心力衰竭药物治疗后NYHA心功能Ⅱ~Ⅲ级的心力衰竭患者;(3)超声心动图及延迟镓增强心脏磁共振[方法学参照2010年美国心脏病学会基金会(ACCF)/美国放射学会(ACR)/美国心脏协会(AHA)/北美心血管成像协会(NASCI)/心血管磁共振学会(SCMR )心脏磁共振成像专家共识[12]]显示左心室前壁、室间隔和(或)心尖部存在透壁性心肌梗死瘢痕(图1),LVEF ≥ 15% 和LVEF≤40% ;(4)左心室前壁瘢痕区域存在结构异常或者运动异常。排除标准:冠状动脉仍需再血管化治疗,瘢痕区域存在存活心肌,左心房或左心室存在血栓及其他肿物,60 d内植入包括CRT在内的永久起搏装置,右心导管测定肺动脉收缩压>60 mmHg(1 mmHg=0.133 kPa),既往右颈手术、心包切开或影响左侧肋间切口的手术,血清肌酸酐>176.8 μmol/L,存在常规心导管手术或抗凝禁忌证、妨碍短暂单侧肺通气的肺部疾病。本项研究已通过厦门大学附属心血管病医院伦理委员会批准。所有患者术前均签署手术知情同意书。
1.2 手术过程及心功能评估
患者平卧于手术台,喉罩通气全麻后常规消毒铺巾,常规经食管超声心动图术中监测,通过穿刺右侧颈内静脉置入14 F鞘管和左胸侧切口建立手术入路。将Jag钢丝通过6 F Swan-Ganz导管至肺动脉,撤出漂浮导管,以8 F多功能导管预置抓捕器后沿钢丝推送至主肺动脉并释放(图2);通过左胸侧切口于瘢痕与正常心肌交界处,以“Y”型穿刺针穿刺左心室游离壁及室间隔至右心室,放置6 F动脉鞘管至右心室,置入Amplatz R1 导管并使其开口朝向右心室流出道,推送0.018 in(1 in=2.54 cm)钢丝至肺动脉,以抓捕器抓捕该钢丝建立轨道(图3)。将Amplatz R1导管通过14 F鞘管推送至体外并交换3 m×0.014 in钢丝,沿钢丝将内锚定送至室间隔右心室面,通过轨道将外锚定置于左心室游离壁面并挤压瘢痕组织使之折叠封闭(图4)。此期间反复行经食管超声心动图观察三尖瓣活动。根据患者左心室瘢痕范围大小重复以上操作逐一夹闭(图5),心尖部的瘢痕区域可通过两个外锚定装置直接夹闭。复查超声心动图及左心室造影评估减容效果及各瓣膜功能。术毕拔除颈静脉鞘管并逐层关闭左胸侧切口,放置引流。患者术后1个月内行心脏磁共振评估左心室容积及射血分数。
1.3 统计学分析
所有数据采用SPSS13.0软件进行处理。符合正态分布的计量资料以均数±标准差表示,采用配对t检验 ;非正态分布的计量资料用中位数(四分位间距)表示;计数资料以例数(率)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 患者临床基本情况
10例前间壁瘢痕形成的缺血性心力衰竭患者,9例男性,1例女性,平均年龄(55.2±13.9)岁。NYHA分级为(2.9±0.6),平均体重指数(25.7±2.9)kg/m2。10例患者经过心脏影像学评估,显示左心室前壁及室间隔在急性心肌梗死后出现大面积的心肌梗死瘢痕,瘢痕区域心肌出现节段性活动异常(无活动或矛盾运动),左心室容积明显增大。所有患者均成功地接受了该手术,未发生严重并发症。

图1 心脏磁共振延迟镓增强显像提示心肌梗死瘢痕

图2 经右颈内静脉放置14 F鞘管并将抓捕器放置于肺动脉

图3 穿刺左心室游离壁至右心室将导丝送入抓捕器,建立轨道

图4 将右心室内锚定装置与左心室外锚定对接

图5 逐一夹闭相对应的内、外锚定装置,游离前间壁瘢痕组织
2.2 患者心功能指标的改善
术后1个月患者的NYHA分级由(2.9±0.6)改善至(1.5±0.5)(P<0.01),LVEF由(27.8±8.4)%提 升 至(37.5±11.4)%( 增 加 35.0%,P<0.01),左心室收缩末期容积由(149.9±61.6)ml降至(109.9±58.0)ml( 降 低 26.7%,P<0.01),左 心室收缩末期容积指数由(84.8±36.7)ml/m2降至(63.0±34.2)ml/m2( 降 低 25.7%,P<0.01);左心室舒张末期容积由(203.0±64.0)ml降至(167.9±58.2)ml(降 低 17.3%,P<0.01),左 心室舒张末期容积指数由(114.5±37.8)ml/m2降至(96.2±35.2)ml/m2(降低 16.0%,P<0.01)。心输出量由(4.0±1.5)L/min增加至(4.8±1.2)L/min(增加20.0%,P=0.034),心脏指数由(2.2±0.7)L/(min . m2)增加至(2.7±0.7)L/(min . m2) (增加22.4%,P=0.023)(图6)。10例患者术后左心室收缩末期容积指数(图7)分别较术前减少26.7%和25.7%,其中6例患者的左心室收缩末期容积下降至70 ml/m2,5例患者的左心室收缩末容积指数下降 >30%。
3 讨论
急性心肌梗死后由于大面积心肌组织坏死,收缩力减弱或丧失,梗死区域扩张使心腔扩大,根据Laplace定律,心室壁张力进一步增高并增加心脏收缩做功,最终导致整个左心室功能衰竭;此外,左心室扩大后继发性二尖瓣关闭不全、肺动脉高压和右心功能衰竭,终致全心心力衰竭,表现为胸闷、呼吸困难、不能平卧、肢体水肿、胸水和腹水,危及生命;有的还会在心腔内形成血栓,并发脑部等重要脏器栓塞而致残甚至致命[13]。冠状动脉旁路移植术同时进行外科左心室成形术,只能改善部分心肌梗死后缺血性心力衰竭患者的心功能和预后,但外科手术风险仍较高[14]。STICH研究的第一阶段结果发现,对于缺血性心肌病患者行单纯外科冠状动脉血运重建与血运重建加左心室成形术的远期结果,差异无统计学意义。由于患者不能从左心室成形术中获益,因此不建议在血运重建基础上常规加行左心室成形术[6]。STICH的后续研究分析发现,与冠状动脉旁路移植术相比,在冠状动脉旁路移植术同时进行左心室成形术,能够为术后左心室收缩末期容积指数减少至70 ml/m2以下或较术前减小>30%的患者带来生存获益和临床症状改善[15]。
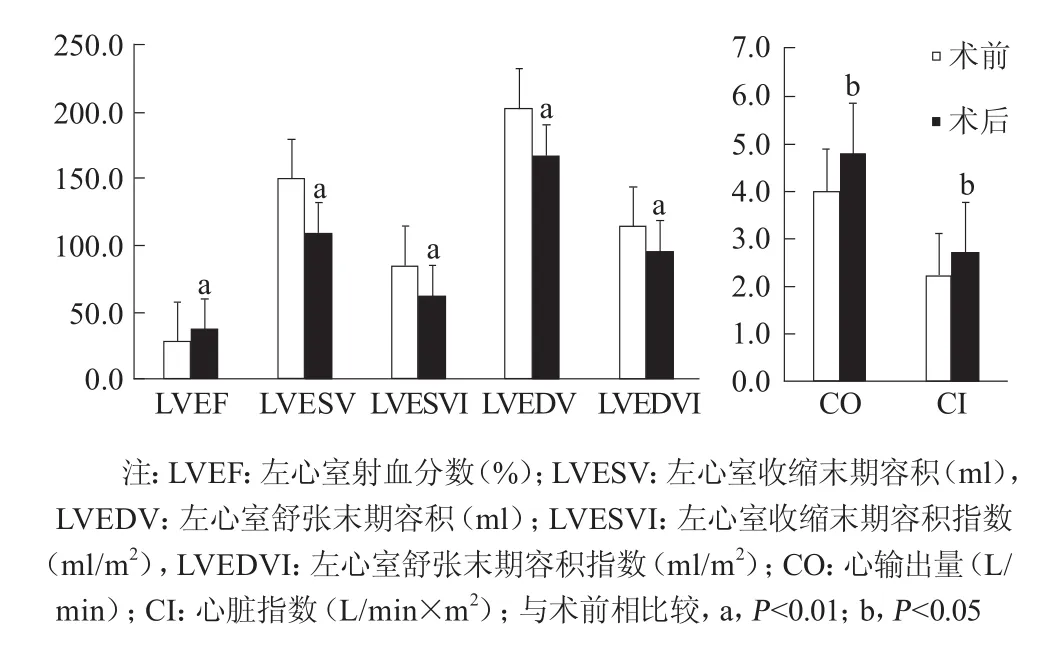
图6 10例患者心脏磁共振评估心功能指标

图7 10例患者心脏磁共振测定左心室收缩末容积指数(mL/m2)
侵入性更小、保留左心室原始形态的左心室重建术是近年来缺血性心力衰竭介入治疗领域的热点。目前在国内外已开展的Parachute进行经皮左心室分区术,根据现有的数据,其安全性似乎优于外科手术,既往临床研究[8-9,11]也初步证实其有效性。但是,该手术局限于室壁瘤的部位及大小形态,仅部分患者可以接受这一治疗。本研究中10例患者采用了Revivent系统,不停跳下进行心外膜左心室重建术,治疗的病变针对心肌梗死后前壁和室间隔大面积瘢痕形成(图1)的缺血性心力衰竭患者,旨在将坏死并扩大的心肌瘢痕隔绝出左心室,缩小左心室收缩末期和舒张末期容积,降低心脏做功并改善心力衰竭症状,最终改善患者的生活质量及临床预后。Wechsler等[16]最早报道了31例接受该手术的缺血性心肌病患者,并对前11例患者进行了超声心动图的评估,与基线相比,6个月和12个月的左心室收缩末期容积指数分别降低(36.2±18.3)%(P<0.001)和(39.6±14.8)% (P<0.001),6个月和12个月的左心室收缩末期容积指数分别降低(28.6±18.8)%(P<0.001)和(32.2±14.9)%(P<0.05)。在改进器械后,目前已可以在胸腔镜协助下行经导管心外膜左心室重建术。在心肌梗死动物模型研究[17]中,经导管心外膜左心室重建术能够使左心室收缩末期容积由(58.8±16.6)ml减少至(25.1±7.6)ml(P<0.01),LVEF由(32.0±7.3)% 增加至(52.0±7.5)%,左心室收缩扭转由术前的(–0.41±0.94)增加至(3.83±2.21)(P=0.01),左心室整体收缩期纵向应变由–5.64%增加至–10.77%(P<0.05)。本研究10例患者,术后1个月复查心脏磁共振提示LVEF较术前提升35.0%,心输出量和心脏指数分别提升20.0%和22.4%。这提示使用Revivent系统行心肌梗死后心外膜左心室重建术短期内可明显改善大面积前间壁心肌梗死患者的左心室收缩功能,提高心输出量。10例患者术后左心室收缩末期容积及指数(图7)分别较术前减少26.7%和25.7%,其中6例患者的左心室收缩末期容积下降至70 ml/m2,5例患者的左心室收缩末期容积指数下降>30%(参考STICH研究中的左心室收缩末期容积指数减少至70 ml/m2以下或较术前减小>30%提示患者预后改善)。但值得注意的是,本研究中采用心脏磁共振测定的左心室容积,与STICH研究中心脏超声测定的左心室容积存在方法学上的差异可能导致预后判断的指数有所差异[18]。
在心力衰竭药物治疗和再血管化难以进一步改善大面积心肌梗死的缺血性心力衰竭患者临床症状和预后的情况下,寻求创伤更小的途径进行左心室重建术,减小左心室容积,降低心脏做功,降低瘢痕或心室异常运动相关的并发症发生率,是缺血性心力衰竭领域值得深入研究的治疗手段。本研究使用Revivent系统行心肌梗死后心外膜左心室重建术短期即可明显增加LVEF、心输出量及心脏指数,明显减少左心室舒张末期和收缩末期容积及其容积指数,但局限于样本量较小,其安全性和有效性还有待大样本、长期的观察。
[1] 王焱,王斌,常贺,等.厦门市心血管病医院构建区域协同胸痛急救网络探索.中华医院管理杂志,2016,32(6):453-455.
[2] 中国胸痛中心认证工作委员会.中国胸痛中心认证标准(2015年11 月修订). 中国介入心脏病学杂志,2016 , 24(3) :121-130.
[3] Høst NB, Hansen PR. Infarction expansion and ventricular remodelling after acute myocardial infarction. U geskr Laeger,1993,155(43):3463-3467.
[4] Mills NL, Everson CT, Hockmuth DR. Technical advances in the treatment of left ventricular aneurysm. Ann Thorac Surg,1993,55(3):792-800.
[5] Asinger RW, Herzog CA, Dick CD. Echocardiography in the evaluation of cardiac sources of emboli: the role of transthoracic echocardiography. Echocardiography,1993,10(4):373-396.
[6] Dai SM, Zhang S, Chen KP, et al. Prognostic factors affecting the all-cause death and sudden cardiac death rates of post myocardial infarction patients with low left ventricular ejection fraction. Chin Med J (Engl),2009,122(7):802-806.
[7] Jones RH, Velazquez EJ, Michler RE,et al. Coronary bypass surgery with or without surgical ventricular reconstruction. N Engl J Med,2009,360(17):1705-1717.
[8] 王建, 王斌, 肖国胜, 等. 经皮左心室分隔术对心尖部室壁瘤形成的缺血性心力衰竭患者的安全性及疗效评估. 中国循环杂志,2016,31(8):775-779.
[9] 李桂阳,王建,苏茂龙, 等.左室室壁瘤分区术治疗缺血性心力衰竭并室壁瘤.中国分子心脏病学杂志,2016,16 (3):1718-1720.
[10] 王建,张艳平,叶榕婷,等. 伴左室心尖部室壁瘤的缺血性心力衰竭患者的治疗进展. 慢性病学杂志, 2016, 12(11) : 1214-1217.
[11] 王建,赖可可,张哲义,等.经皮左心室重建术对心尖部室壁瘤形成的缺血性心肌病患者术后即刻心输出量的影响.中国介入心脏病学杂志,2017,25 (3):133-137.
[12] Hundley WG, Bluemke DA, Finn JP, et al. ACCF/ACR/AHA/NASCI/SCMR 2010 expert consensus document on cardiovascular magnetic resonance: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. Circulation, 2010,121(22):2462-2508.
[13] Baxley WA, Jones WB, Dodge HT. Left ventricular anatomical and functional abnormalities in chronic postinfarction heart failure.Ann Intern Med,1971,74(4):499-508.
[14] Shen LL, Wang C, Wang R, et al. Surgical ventricular restoration versus isolated coronary artery bypass grafting for left ventricular aneurysm: comparison of mid- to longterm outcomes.Nan Fang Yi Ke Da Xue Xue Bao, 2016 ,36(5):681-687.
[15] Michler RE, Rouleau JL, Al-Khalidi HR, et al. Insights from the STICH trial: change in left ventricular size after coronary artery bypass grafting with and without surgical ventricular reconstruction. J Thorac Cardiovasc Surg,2013,146(5):1139-1145.
[16] Wechsler AS, Sadowski J, Kapelak B,et al. Durability of epicardial ventricular restoration without ventriculotomy. Eur J Cardiothorac Surg,2013,44(3):e189-192; discussion e192.
[17] Cheng Y, Yi GH, Annest LS, et al. Early feasibility evaluation of thoracoscopically assisted transcatheter ventricular reconstruction in an experimental model of ischaemic heart failure with left anteroapical aneurysm.EuroIntervention, 2015,10(12):1480-1487.
[18] Malik SB, Chen N, Parker RA 3rd, et al. Transthoracic Echocardiography: Pitfalls and Limitations as Delineated at Cardiac CT and MR Imaging. Radiographics,2017,37(2):383-406.
