饲粮中添加燕麦干草对绵羊体外发酵的影响
2018-03-04张毕阳赵桂琴焦婷柴继宽苟智强许兴泽闫车太甘肃农业大学草业学院甘肃兰州730070草业生态系统教育部重点实验室甘肃兰州730070甘肃省草业工程实验室甘肃兰州730070美草地畜牧业可持续研究中心甘肃兰州730070
张毕阳,赵桂琴,2,3,4*,焦婷,2,3,柴继宽,2,苟智强,许兴泽,闫车太(.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室,甘肃 兰州 730070;3.甘肃省草业工程实验室,甘肃 兰州 730070;4.中-美草地畜牧业可持续研究中心,甘肃 兰州 730070)
燕麦(Avenasativa)干草作为一种优质的粗饲料,在奶牛的饲养中一直被广泛利用[1]。燕麦是我国北方高海拔冷凉地区重要的饲草料来源。燕麦干草具有产量高、品质优和适口性好等特点[2],是奶牛养殖的主要粗饲料[3]。近年来随着我国畜牧业和养殖业的快速发展,燕麦干草逐渐成为反刍动物饲粮中粗饲料的主要来源之一。因此,研究燕麦干草作为粗饲料对反刍动物瘤胃发酵的影响有一定的学术价值和经济意义。但目前有关燕麦干草作为粗饲料对绵羊瘤胃发酵影响方面的研究鲜见报道。桑丹等[4]通过奶牛体外发酵试验比较了燕麦干草、青贮玉米及谷草对瘤胃发酵调控的影响,通过对3种饲草消化率的测定、营养成分分析和产气量的测定,表明燕麦干草的发酵参数、体外消化率及产气量均高于青贮玉米(Zeamays)和谷草,在奶牛瘤胃中被利用比例大,对瘤胃发酵的调控更加有利。潘美娟[5]通过对燕麦草、羊草(Leymuschinensis)及其组合日粮人工瘤胃发酵规律的研究结果表明,燕麦草在产气量、产气速率及降解速率上都显著高于羊草,干物质和蛋白质的降解率也高于羊草。崔占鸿等[6]的牦牛体外发酵研究表明,在精料水平相同的条件下,当燕麦青干草与藏嵩草(Kobresiatibetica)1∶1组合时,产气量和产气速率最大且组合效应值最大。瘤胃是绵羊最重要的消化器官之一,燕麦干草与不同饲料的合理组合可通过对动物进行饲喂来讨论研究。而对动物的饲喂需要大量的试验动物,成本较大,且耗时耗力[7]。因此,燕麦干草的合理添加量可通过瘤胃体外发酵进行较为准确的预测。德国霍恩海姆大学动物营养研究所Menke等[8]建立的活体外人工瘤胃产气量法操作简便、重复性好,可较为真实地模拟饲粮在瘤胃中的发酵过程。Blummel等[9]运用活体外人工瘤胃产气量法进行实验发现体外产气量与有机物的表观降解率及真降解率高度相关,而且发现用此方法进行试验易于标准化和批量化。Koratikere等[10]用Menke法成功的评估了经过尿素处理的子和秸秆之间的组合效应,发现两种饲草之间存在正组合效应。Liu等[11]采用Menke法将稻草与经过化学处理的稻草、桑叶及禾本科干草两两组合进行试验研究,通过对产气量、降解率等的测定表明稻草与禾本科干草及桑叶之间存在正组合效应。
本研究拟选用3种不同燕麦干草添加量的饲粮,采用体外产气法模拟瘤胃运动,研究其对绵羊瘤胃产气量、甲烷产量及营养物质降解率等指标的影响,筛选适宜的燕麦干草添加量以达到饲粮的最大组合效应,为燕麦干草在绵羊养殖中的合理使用提供参考。
1 材料与方法
1.1 试验动物及饲养管理
选用6头体况相似、体重 (70.24±2.03) kg且装有永久性瘤胃瘘管的杂种(美利奴♂×蒙古羊♀)公羊作为试验动物,提供瘤胃液。绵羊饲粮的精粗比为35∶65(精饲料+燕麦干草+全株玉米青贮,1.71 kg·头-1·d-1)。每天分别在8:30和18:30分两次进行饲喂,试验羊自由采食,自由饮水。
1.2 试验设计
2015年11-12月在甘肃省定西市临洮县华加牧业牧场进行绵羊饲喂试验并采集瘤胃液,采样后于2015年12月在甘肃农业大学草业生态系统教育部重点实验室进行体外发酵试验。饲喂试验预试期15 d,正试期7 d,正试期最后一天采集瘤胃液。提前配置3种饲粮作为体外发酵的底物,C1组:精料+100%玉米青贮;C2组:精料+50%玉米青贮+50%燕麦干草;C3组:精料+100%燕麦干草。各处理组每个培养时间点设3个重复,培养时间分别为3、6、9、12和24 h。
1.3 日粮设计
参照我国肉羊饲养行业标准,按70 kg育成公羊日增重50 g的营养需求量配制3组燕麦干草饲粮,其营养成分及水平见表1。
1.4 瘤胃体外发酵设计及样品采集
1.4.1体外发酵装置 采用振荡频率可调的恒温振荡水浴作为实验主体,精度<±0.5 ℃。用德国进口的100 mL玻璃注射器作为培养装置,注射头安装橡皮软管,用带针头的医用塑料注射器插入橡皮管收集气体。使用前需将玻璃注射器洗净烘干,在活塞四周涂抹少量凡士林保证密封效果及减少气体推动活塞的阻力。
1.4.2缓冲液配制 培养液的制备:蒸馏水400 mL+常量元素溶液200 mL+缓冲液200 mL+微量元素溶液0.1 mL+还原剂溶液40 mL+刃天青溶液1 mL(表2)。按顺序将蒸馏水、微量元素溶液、缓冲液、常量元素溶液及刃天青溶液按上述比例依次加入玻璃瓶中。与刃天青溶液混合后液体呈红色,然后持续通入30 min CO2并将混合液加热到39 ℃,溶液颜色变淡。最后加入还原剂溶液,持续通入CO2气体使混合溶液褪至无色。
试验开始前1 d,分别向玻璃注射器中加入1 g发酵底物和40 mL培养液,持续通入10 min CO2气体后迅速将强密封性的橡皮管装至注射头,将玻璃注射器置于39 ℃恒温水域中以备用。
1.4.3瘤胃液的采集及培养流程 晨饲(08:30)前从试验羊瘤胃中采集瘤胃液,经5层纱布过滤迅速装入保温桶中带回实验室,保温桶需提前预热至39 ℃并通满CO2以保证厌氧环境。 瘤胃液持续通入10 min CO2气体后分别在上述玻璃注射器中加入20 mL。置于恒温振荡水浴开始培养, 同时设定3个空白对照。各个培养时间点瘤胃液发酵完成后将产生的气体立即用注射器吸取并注入气体采样袋中保存。

表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the experiment diets (dry matter basis)
注:1)预混料为每kg饲粮提供:VA 220000 IU,VD372000 IU,VE 2000 IU,D-生物素40 mg,烟酰胺2000 mg,Mn 710 mg,Zn 2005 mg,Fe 830 mg,Cu 680 mg,Co 12 mg。2) 实测值。
Note: 1) The premix provided the following per kg of diets: VA 220000 IU, VD372000 IU, VE 2000 IU, D-biotin 40 mg, nicotinic acid amide 2000 mg, Mn 710 mg, Zn 2005 mg, Fe 830 mg, Cu 680 mg, Co 12 mg. 2) Measured values.
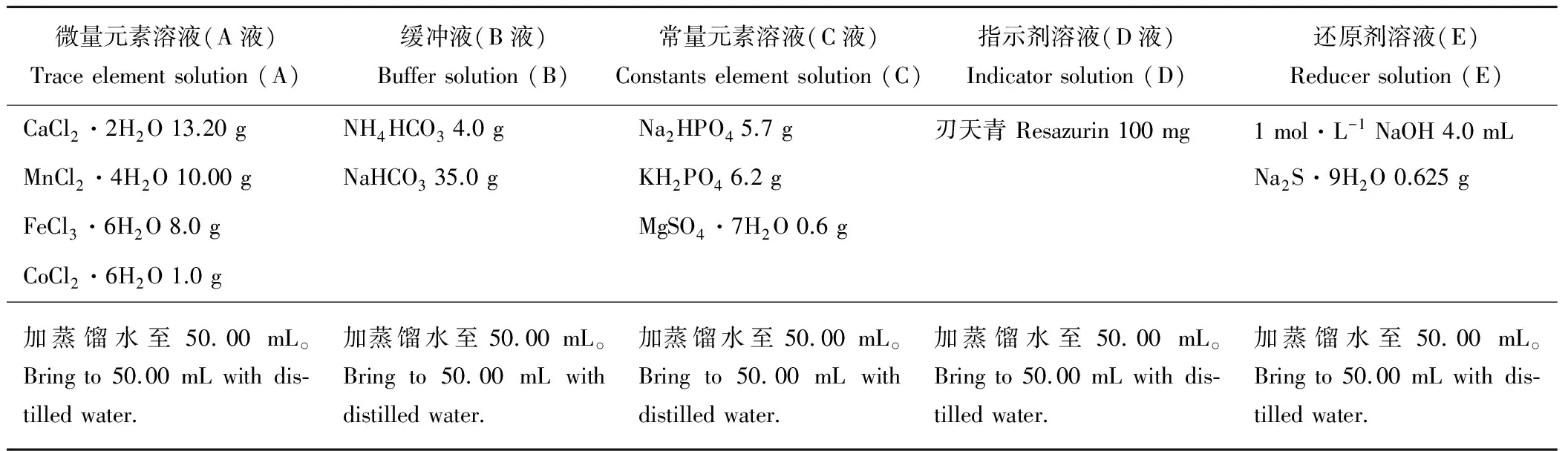
表2 人工瘤胃液各溶液配方Table 2 Formula of different solutions
1.5 指标的测定
1.5.1产气量及CH4含量的测定 培养开始后,分别在3、6、9、12和24 h记录各组产气量。记录完成后用医用塑料注射器抽取玻璃注射器中的气体迅速注入气体样品采样袋中,并立即测定CH4含量。CH4含量的测定使用安捷伦(Aglient)6890N型气相色谱仪,色谱柱为AT·SE-30毛细管柱(甘肃农业大学动物科学技术学院)。色谱条件:进样口温度为100 ℃,分流比为15∶1,N2流量为1.7 mL·min-1,FID 250 ℃,恒温模式(100 ℃ 3 min),FID空气、N2和H2流量分别为450 mL·min-1、45 mL·min-1和40 mL·min-1。
1.5.2培养液NH3-N浓度的测定 采用冯宗慈改进的比色法[12]测定培养液NH3-N浓度。
测得的标准曲线Y=0.586X(R2=0.998)。
式中:X为氨氮质量(mg);Y为吸光值。
瘤胃液取样量为0.4 mL。
1.5.3培养液pH值的测定 采用HI98103型高精度笔式酸度计测定(北京泰亚赛福公司)培养液pH值。
1.5.4培养液中VFA浓度的测定 采用安捷伦1260高效液相色谱测定总挥发性脂肪酸(TVFA)、乙酸(acetic,AA)、丙酸(propionic,PA)及丁酸(butyric,BA)。色谱条件为:SB-AQ C18色谱柱(4.6 mm×250.0 mm);流动相A(甲醇)∶流动相B[0.01 mol·L-1(NH4)2HPO4,pH=2.70]=3∶97,流速1 mL·min-1,进样量20 μL,检测波长210 nm,柱温25 ℃[13]。
1.5.5体外干物质降解率(IVDMD)和体外蛋白质降解率(IVCPD)的测定 测完pH值,将培养液和发酵底物无损失转至50 mL离心管中离心10 min(4000 r·min-1),离心管提前称重。取10 mL上清液装入离心管-20 ℃保存,用于VFA和NH3-N浓度的测定。之后将离心管放入110 ℃烘箱烘至恒重,计算IVDMD。将同时间点相同处理的剩余发酵底物进行混合用于测定CP含量,并计算IVCPD。
养分降解率=(饲粮中该养分含量-食糜中该养分含量)×100%/饲粮中该养分含量
1.5.6体外发酵多项指标综合指数(MFAEI)的评价 按照卢德勋提出的方法计算体外发酵单项指标效应指数(SFAEI)和多项指标综合指数(MFAEI)[14]。
SFAEI=(组合后实测值-加权估算值)/加权估算值
加权估算值=(一种饲料的实际测定值×所占比例)+(另一种饲料的实际测定值×所占比例)
单项指标效应指数(SFAEI)的加权值即为MFAEI。
1.6 数据统计分析
用Excel 2013进行所有数据预处理后,用SPSS 21.0软件进行单因子方差分析,用Turkey法进行多重比较,差异显著性判断标准为P<0.05,有无变化趋势判断标准为P≤0.20。
2 结果与分析
2.1 添加燕麦干草对绵羊瘤胃体外发酵产气量的影响
由表3可知,饲粮中添加燕麦干草对各发酵时间点的产气量及24 h总产气量均有明显影响(P<0.05)。随着体外发酵时间的延长,各组产气量逐渐上升。同时随着燕麦干草的加入,产气量也呈上升趋势;添加组的产气量显著高于未添加组(P<0.05)。3个处理组在各发酵时间点的产气量及24 h总产气量均为C2组>C3组>C1组,其中总产气量C2组高出C1组36.23%,C3组较C1组高12.54%。
2.2 添加燕麦干草对绵羊瘤胃体外发酵甲烷产量的影响
燕麦干草的添加对甲烷产量影响显著(表4)。随着发酵时间的延长,甲烷产量不断增加。C1组甲烷产量在3~6 h间显著高于C2和C3组(P<0.05),但此后C3组甲烷产量迅速升高,到9 h时,已增加至8.88 mL·g-1, 较6 h 时上升了1.64倍;尽管C1和C2组的产量也明显增加,但C3组增幅最大。12 h的甲烷产量仍以C3组为最高,但从9 h到12 h这一阶段C2组增幅最大(57.98%)。C1组的甲烷产量从发酵初期的最高值逐渐成为发酵后期的最低值。24 h的甲烷总产量以添加燕麦干草的C3组和C2组最高,分别高出C1组13.37%和12.90%(P<0.05)。
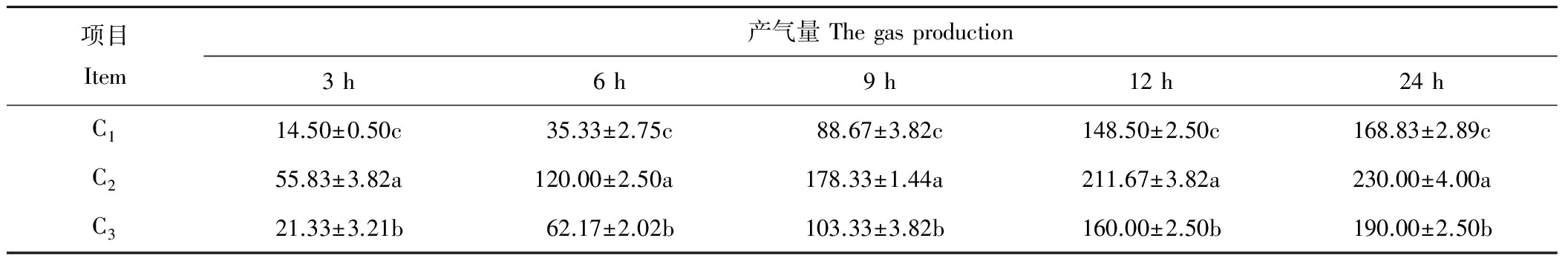
表3 饲粮中添加燕麦干草对绵羊瘤胃体外发酵产气量的影响Table 3 Effects of adding oat hay in diets on gas production of in vitro ruminal fermentation (mL·g-1)
注:数据无字母或标相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下同。
Note: Values with no letter or the same letter mean no significant difference (P>0.05), while with different small letter mean significant difference (P<0.05). The same below.

表4 饲粮中添加燕麦干草对绵羊瘤胃体外发酵甲烷产量的影响Table 4 Effects of adding oat hay in diets on methane production of in vitro ruminal fermentation (mL·g-1)
2.3 添加燕麦干草对绵羊瘤胃体外发酵NH3-N浓度的影响
绵羊饲粮中添加燕麦干草显著影响了NH3-N浓度(表5)。添加燕麦干草组的NH3-N浓度明显高于未添加组(P<0.05)。与甲烷产量的变化不同,NH3-N浓度在发酵初期(3~6 h)并无明显变化,发酵9 h时,C1组的NH3-N浓度较6 h增加了14.58%,C2和C3组稍有上升但并不明显。到12 h时,C1组较前一时间点基本无变化,C2组增加了4.38%,C3组则升高了14.77%。发酵24 h时,NH3-N浓度较12 h 进一步增加,但3个组的增幅并不显著,变幅在3.83%~8.19%之间,仍以C3组增幅最大。纵观整个发酵过程可以看出,NH3-N浓度在发酵6 h时降至最低点,之后逐渐上升,在24 h升至最高;而且3个处理组中C2组的NH3-N浓度在各个时间点均为最高值。

表5 饲粮中添加燕麦干草对绵羊瘤胃体外发酵NH3-N浓度的影响Table 5 Effects of adding oat hay in diets on NH3-N concentration of in vitro ruminal fermentation (mg·100 mL-1)
2.4 添加燕麦干草对绵羊瘤胃体外发酵pH的影响
由表6可知,饲粮中添加燕麦干草对培养液pH未产生显著影响,3个处理组在各时间点的pH差异均不显著(P>0.05)。总体而言,随着发酵时间的延长,pH逐渐下降并在24 h降至最低点。
2.5 添加燕麦干草对绵羊瘤胃体外发酵VFA的影响
饲粮中添加燕麦干草会显著影响绵羊瘤胃体外发酵的VFA产量(P<0.05)。由表7可知,添加燕麦干草后总挥发性脂肪酸明显上升,C2、C3组较不添加的C1组分别高22.57%和16.89%。乙酸摩尔比也随燕麦干草的添加而有所增加(C2、C3分别较C1增加了4.44% 和7.69%),但丙酸摩尔比则稍有下降,最终导致乙丙比(乙酸/丙酸)出现了显著变化。C3组的乙丙比最高,较C2和C1分别高出20.00%和12.26%。丁酸摩尔比也以C3为最高,C1和C2间无明显差异。

表6 饲粮中添加燕麦干草对绵羊瘤胃体外发酵pH的影响Table 6 Effects of adding oat hay in diets on pH of in vitro ruminal fermentation
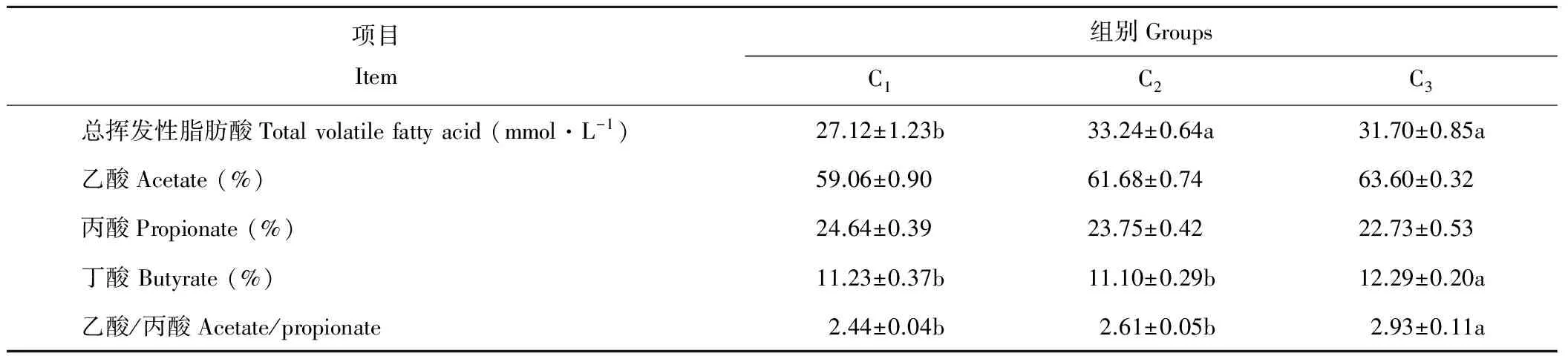
表7 饲粮中添加燕麦干草对绵羊瘤胃体外发酵VFA的影响Table 7 Effects of adding oat hay in diets on VFA of in vitro ruminal fermentation
2.6 添加燕麦干草对绵羊瘤胃体外干物质降解率的影响
由表8可知,饲粮中添加燕麦干草对干物质降解率有明显影响(P<0.05)。随着发酵时间的延长,各处理组的干物质降解率逐渐上升。但是3个处理组在3~12 h内的干物质降解率之间差异并不显著(P>0.05),到24 h才产生了显著差异。C3组的干物质降解率最高,达53.03%,显著高于未添加燕麦干草的C1组。另外,从整个发酵过程看,C2和C3组的干物质降解率也高于C1组,体现了燕麦干草在提高绵羊瘤胃体外干物质降解率的作用。

表8 饲粮中添加燕麦干草对绵羊瘤胃体外干物质降解率的影响Table 8 Effects of adding oat hay in diets on IVDMD of in vitro ruminal fermentation (%)
2.7 添加燕麦干草对绵羊瘤胃体外蛋白质降解率的影响
绵羊瘤胃体外蛋白质的降解率也受到了添加燕麦干草的影响(表9)。发酵初期(3 h)C1组的蛋白质降解率较高;随后C2和C3组上升幅度加大,在9 h时超过C1组并产生了显著差异(P<0.05)。发酵12 h时,处理间的差异缩小,但到了24 h,3个组间的差异又进一步加大,添加燕麦干草的C2和C3组蛋白质降解率显著高于未添加的C1组(C2和C3较C1分别高出16.10%和18.57%)。
2.8 添加燕麦干草对绵羊瘤胃体外发酵效果影响的综合评价
针对混合日粮体外发酵多时间点和多指标组合效应的计算,卢德勋提出了组合效应指数(MFAEI),对日粮组合效应进行整体量化和直观比较。C1组为对照组。由表10可知,C2和C3组各项指标的SFAEI除pH为负值外,产气量、甲烷产量、NH3-N、TVFA、IVDMD、IVCPD和MFAEI均为正值,且C2组的MFAEI高于C3组。说明C2组综合指数最高,即燕麦干草和青贮玉米1∶1配制粗饲料时,饲粮的组合效应最大。

表9 饲粮中添加燕麦干草对绵羊瘤胃体外蛋白质降解率的影响Table 9 Effects of adding oat hay in diets on IVCPD of in vitro ruminal fermentation (%)

表10 体外发酵组合效应指数Table 10 The multiple-factors associative effects index (MFAEI) in vitro ruminal fermentation
3 讨论
3.1 饲粮中添加燕麦干草对绵羊瘤胃体外发酵产气量及甲烷产量的影响
研究表明,产气量和甲烷产量与体内营养物质的消化率之间存在正相关,改变饲粮类型会影响动物瘤胃的产气量、甲烷产量及瘤胃发酵模式[15]。体外产气量可在一定程度上反映动物体内某种饲料的降解规律,但体外产气法仅仅是一种模拟技术,模拟的环境与动物瘤胃的真实状况有一定的区别,而且不同饲料其产气量也各不相同,产气量的多少并不能直接反映饲料的降解程度,所以饲料的营养价值需要通过多种营养成分的降解率来综合评定[16]。本研究中,添加燕麦干草后产气量显著上升,当燕麦干草与青贮玉米1∶1混合时产气量达到最大值230.00 mL·g-1,但同时甲烷产量也随之上升。可能是因为在饲粮精料相同的条件下,燕麦干草所含易发酵的碳水化合物等较多,发酵速度快,在瘤胃中的降解率高于青贮玉米,随之产生的发酵气体也较高;但由于瘤胃发酵产生的乙酸摩尔比和丁酸摩尔比较高,故增加了乙酸和丁酸发酵过程中所伴随的甲烷生成。此次研究中添加燕麦干草的C3组饲粮TVFA浓度、乙酸摩尔比和丁酸摩尔比均高于未添加燕麦干草的C1组,3组间丙酸摩尔比差异不显著,此结果与上述理论一致。甲烷产量过高会对周围环境造成不同程度的污染,且会增大饲粮的能量损失[17],因此需要调整燕麦干草比例将甲烷产量控制在合理的范围内。崔占鸿等[18]研究表明,燕麦青干草以50%比例与藏嵩草组合时,饲粮的组合效应最佳,表明不同种粗饲料组合的产气量较单一饲草有所增加,本研究结果与此相似。何玉鹏等[19]在饲粮精料相同的条件下进行体外发酵试验,发现含添加剂组的饲粮产气量显著高于对照组,而甲烷产量则较低。这可能与试验方法、饲粮组成和类型等存在差异有关。
3.2 饲粮中添加燕麦干草对绵羊瘤胃体外发酵液NH-N3浓度、pH和VFA的影响
瘤胃液pH是饲粮类型、瘤胃缓冲液、唾液、瘤胃内酸碱物质的消化和排出以及水等因素之间相互作用的结果[20]。本研究中,各处理组培养液pH在6.59~6.96范围内浮动,处于正常状态,可能是因为进行体外发酵试验时,培养液中缓冲液所占比例较高而发酵底物所占比例小。评定瘤胃液pH是否正常,通常考虑其是否有利于瘤胃内纤维素分解菌的活动[21]。Mound等[22]报道,当瘤胃液pH在6.30以上时瘤胃内的纤维分解菌才会有活力。Φrskov等[23]的研究结果也表明,较高的pH值适合纤维分解菌的繁殖及瘤胃微生物合成蛋白质。本研究中,各组pH变动范围在瘤胃发酵的正常范围内,各处理组间的pH在各时间点均没有显著差异,表明在30%~50%精料水平条件下改变粗饲料的类型不会对瘤胃液pH造成较大影[24-25]。但C3和C2组又略低于C1组,这可能是由于燕麦干草与青贮玉米相比含有较多的水溶性碳水化合物,易于发酵,在人工瘤胃内产生的TVFA的量较多,故pH较低。
瘤胃液NH3-N是合成微生物蛋白的主要原料之一,影响NH3-N浓度的主要因素是饲粮蛋白降解特性和微生物蛋白合成速率[26]。瘤胃微生物的生长以及微生物蛋白的合成需要一个适宜的NH3-N浓度,一般认为最佳浓度为6.30~27.50 mg·100 mL-1[27]。很多研究表明,培养液NH3-N浓度在发酵开始后先升高,然后随时间的推移而降低[28],本研究结果基本符合微生物生长的最佳浓度范围和动态变化趋势。发酵前期,饲粮中的蛋白质在瘤胃内降解后被瘤胃微生物充分利用合成蛋白质,NH3-N浓度逐渐降低;而随着微生物合成蛋白质速率放慢,NH3在瘤胃中不断地积累导致NH3-N浓度又逐渐回升。Ariza等[29]研究发现,饲粮中加入部分富含水溶性碳水化合物(WSC)的粗饲料可提高瘤胃微生物分解蛋白质的效率,增加瘤胃液NH3-N浓度。本研究也得到类似的结果,饲粮中添加燕麦干草,培养液NH3-N浓度显著提高,原因可能是含有燕麦干草的饲粮作为底物进行体外发酵,培养液中微生物的可利用能源增加,进而微生物降解蛋白质的能力以及活性均得到增强,NH3的释放量增大。
在反刍动物的瘤胃中,碳水化合物发酵后的产物主要是乙酸、丙酸、丁酸等,是反刍动物主要的能量来源,同时这些酸可作为原料在动物体内合成体脂肪和乳脂肪[30]。本研究发现,饲粮中加入燕麦干草,对培养液的丙酸摩尔比未产生显著影响,但升高了TVFA浓度、乙酸、丁酸摩尔比及乙酸/丙酸,而且可以看出添加燕麦干草有降低丙酸摩尔比的趋势。反刍动物的瘤胃VFA主要由乙酸、丙酸和丁酸组成且占TVFA的95%左右[31],乙酸的增加有利于提高动物的体脂率和乳脂率,丙酸的增加有利于葡萄糖的转化和储存,丁酸则用来为机体各组织供能[5]。C3组乙酸和丁酸摩尔比高于C1组,丙酸摩尔比低于C1组,这可能是由于纤维素和半纤维素发酵产生的乙酸比例高,糖和淀粉发酵产生的丙酸比例较高[32]。粗饲料的类型不同,瘤胃微生物中纤维降解菌的数量和纤维降解酶活性都会有一定的差别,所产生的乙酸和丙酸比例也不同[33]。由于燕麦干草富含粗纤维和WSC,而青贮玉米的淀粉含量较高。所以在精料水平相同的条件下,C3组的瘤胃乙酸摩尔比和乙酸/丙酸显著高于C1组,丙酸摩尔比则较低。乙酸摩尔比升高的同时会伴随着甲烷产量的上升,而甲烷产量的过度增加会造成环境的污染以及能量的损失,故饲粮中燕麦干草的添加量不宜过高。饲粮的配制应该在提高VFA浓度并有效控制甲烷产量的条件下筛选出最适宜的燕麦干草添加量。
3.3 饲粮中添加燕麦干草对绵羊瘤胃IVDMD和IVCPD的影响
作为体外发酵的重要参数,体外干物质消失率(IVDMD)和体外蛋白质消失率(IVCPD)通常能较为准确的反映反刍动物瘤胃中饲粮的降解特性。本研究中,添加燕麦干草组饲粮在培养液中发酵24 h后的IVCPD显著高于未添加组,IVDMD也高于未添加组,这是因为饲粮营养水平相近的条件下,改变粗饲料的类型会影响营养物质的降解率。3组饲粮的粗蛋白含量基本相同,但自然干燥的燕麦草通常具有较高的粗蛋白瘤胃降解率[34]。由培养液NH3-N浓度的结果可知,含燕麦干草的饲粮发酵环境更有利于瘤胃微生物的生长及蛋白质的合成,说明其可消化养分含量高于未添加组,因此随着燕麦干草比例的增加,可消化养分含量也随之增加。此外,由于燕麦干草富含可溶性碳水化合物,发酵过程中能释放充足的能量供瘤胃微生物利用去分解饲粮中的营养物质,从而导致含有燕麦干草的C2和C3组24 h的IVDMD及IVCPD高于C1组。对于反刍动物,燕麦干草可能是通过调节瘤胃微生物的发酵和生化过程来影响养分消化,具体原因有待于进一步研究。
3.4 添加燕麦干草对绵羊瘤胃体外发酵效果影响的综合评价
单凭个别指标很难得出准确的实验结果,所以有必要将多个指标进行综合分析和评价。对各单一指标进行有效加权,称之为MFAEI,其可靠程度较高,能较为准确地评价各项指标的组合效应,从而得出科学合理的结论[35]。本研究中,C2组的综合指数最高,说明在精料水平相同的条件下,燕麦干草与青贮玉米1∶1混合作为粗饲料可得到最大组合效应。
4 结论
1)精料相同,精粗比35∶65条件下,绵羊饲粮组合中加入燕麦干草提高了瘤胃液NH3-N浓度和瘤胃发酵产气量,同时也升高了甲烷产量。
2)饲粮中添加燕麦干草提高了绵羊瘤胃液TVFA浓度,乙酸和丁酸的比例,同时也升高了乙丙比。瘤胃液pH略有降低。
3)添加燕麦干草提高了绵羊瘤胃体外发酵的IVDMD和IVCPD。
4)3种饲粮组合,以燕麦干草与青贮玉米1∶1混合可得到最大组合效应。
References:
[1] Cui H, Wang J Q, Bu D P,etal. Application of oat (AvenaL.) in animal production. China Animal Husbandry and Veterinary Medicine, 2010, 37(6): 214-217.
崔海, 王加启, 卜登攀, 等. 燕麦饲料在动物生产中的应用. 中国畜牧兽医, 2010, 37(6): 214-217.
[2] Li Z Q. Quality evaluation of oat hay. China Dairy Cattle, 2013, (19): 1-3.
李志强. 燕麦干草质量评价. 中国奶牛, 2013, (19): 1-3.
[3] Zhao G Q, Mu P, Wei L M. Research progress inAvenasativa. Acta Prataculturae Sinica, 2007, 16(4): 116-125.
赵桂琴, 慕平, 魏黎明. 饲用燕麦研究进展. 草业学报, 2007, 16(4): 116-125.
[4] Sang D, Sun H Z, Fu X F,etal. Analysis of nutrition components of green and dried grass from oat and parameter determination of ruminal fermentinvitro. Animal Husbandry and Feed Science, 2010, 5: 45-46.
桑丹, 孙海洲, 付晓峰, 等. 燕麦草干草营养成分分析及活体外瘤胃发酵参数测定. 畜牧与饲料科学, 2010, 5: 45-46.
[5] Pan M J. The Impact of TMR Composed with Oat Hay orLeymuschinensison Rumen Digestion and Metabolism. Nanjing: Nanjing Agricultural University, 2007.
潘美娟. 燕麦草、羊草及其组合TMR日粮对奶牛瘤胃消化代谢的影响. 南京: 南京农业大学, 2007.
[6] Cui Z H, Hao L Z, Liu S J,etal. Evaluation of the fermentation characteristics of mixed oat green hay and native pastures in the Qinghai plateau using aninvitrogas production technique. Acta Prataculturae Sinica, 2012, 21(3): 250-257.
崔占鸿, 郝力壮, 刘书杰, 等. 体外产气法评价青海高原燕麦青干草与天然牧草组合效应. 草业学报, 2012, 21(3): 250-257.
[7] Mu P, Zhang E H, Fang Y F,etal. Primary study on different maize stalk feeding values byinvitrogas production method. Acta Agrestia Sinica, 2011, 19(6): 983-987.
慕平, 张恩和, 方永丰, 等. 体外产气法对3种玉米秸秆饲用价值评价研究初探. 草地学报, 2011, 19(6): 983-987.
[8] Menke K H, Raab L, Salews K I,etal. The gas production method. Agricultural Science, 1979, 93: 217-222. `
[9] Blummel M, Sxhroder A, Sudekum K H,etal. Estimating ruminal microbial effciencies in silage-fed cattle: comparison of aninvitromethod with a combination of in situ andinvivomeasurements. Animal Physiology, 1999, 81: 57-65.
[10] Koratikere T, Christopher S, Wood D,etal. Effect of urea and by-products on theinvitrofermentation of untreated and urea treated finger millet (Eleusinrcoracana) straw. Journal of Animal Science, 1995, 67: 323-328.
[11] Liu J X, Susenbeth A, Sudekum K H.Invitrogas production measurements to evaluste interactions between untreated and chemically treated rice straws, grass hay, and mulberry leaves. Journal of Animal Science, 2002, 80: 517-524.
[12] Feng Z C. Improvement of ammonia nitrogen content in rumen by colorimetric method. Inner Mongolian Journal of Animal Sciences and Production, 1993, 4: 40-41.
冯宗慈. 通过比色法测定瘤胃液氨氮含量方法的改进. 内蒙古畜牧科学, 1993, 4: 40-41.
[13] Ju Z L, Zhao G Q, Qin F C,etal. Effects of fermentation interval and additives on the quality of baled oat and common vetch mixture silage in an alpine area. Acta Prataculturae Sinica, 2016, 25(6): 148-157.
琚泽亮, 赵桂琴, 覃方锉, 等. 青贮时间及添加剂对高寒牧区燕麦—箭筈豌豆混播捆裹青贮发酵品质的影响. 草业学报, 2016, 25(6): 148-157.
[14] Jin H, Liu G R, Xue S Y,etal. The formula of dairy cattle ration was optimized by the comprehensive evaluation method. Animal Husbandry and Feed Science, 2010, 31(6/7): 438-440.
金海, 刘桂瑞, 薛树媛, 等. 利用体外发酵多项指标综合评定法优选泌乳牛日粮配方. 畜牧鱼饲料科学, 2010, 31(6/7): 438-440.
[15] Zheng C. Effects of Adding Mannanoligosaccharides on Digestibility and Metabolism of Nutrients, Ruminal Parameters, Digesta Passage and Immune of Sheep. Lanzhou: Gansu Agricultural University, 2012.
郑琛. 外源添加甘露寡糖对绵羊养分消化代谢、瘤胃发酵、消化道食糜流通量及免疫的影响. 兰州: 甘肃农业大学, 2012.
[16] Menke K, Steingawss H. Estimation of the energetic feed value obtained from chemical analysis andinvitrogas prodution using rumen fluid. Animal Search and Development, 1988, 28(7): 55.
[17] Goiri I, Oregui L M, Garcia-Rodriguez A. Dose-response effects of chitosans oninvitrorumen digestion and fermentation of mixtures differing in forage to concentrate ratios. Animal Feed Science and Technology, 2009, 151: 215-227.
[18] Cui Z H, Liu S J, Chai S T,etal. Evalution of associate effects of supplementary herbage, concentrate feed and native pastures of Qinghai plateau usinginvitrogas production technique. Acta Agrestia Sinica, 2011, 19(6): 988-994.
崔占鸿, 刘书杰, 柴沙驼, 等. 体外产气法评价青海高原补饲草料与天然草地牧草组合效应. 草地学报, 2011, 19(6): 988-994.
[19] He Y P, Guo Y L, Ju J Z,etal. Effects of chitosan supplementation in diets with different concentrate to forage ratios on methane production, and fermentation characteristics ofinvitroruminal fermentation. Chinese Journal of Animal Nutrition, 2014, 26(11): 3433-3442.
何玉鹏, 郭艳丽, 鞠九洲, 等. 不同精粗比饲粮中添加壳聚糖对体外瘤胃发酵甲烷产量和发酵特性的影响. 动物营养学报, 2014, 26(11): 3433-3442.
[20] Han Z K, Chen J. The Rumen of Ruminants. Beijing: Science Press, 1988.
韩正康, 陈杰. 反刍动物瘤胃的消化和代谢. 北京: 科学出版社, 1988.
[21] Kumar S, Dagar S S, Sirohi S K,etal. Microbial profiles,invitrogas production and dry matter digestibility based on various ratios of roughage to concentrate. Annals of Microbiology, 2013, 63(2): 541-545.
[22] Mound F L, Orskov E R. Manipulation of rumen fluid pH and its influence on celluloysis in sacco, dry matter degradation and the rumen microflora in sheep offered either hay or concentrate. Journal of Animal Science, 1983, (10): 1-14.
[23] Φrskov E R, Ryle M. Ruminant Nutrition. Zhou J M. Beijing: China Agriculure Press, 1992.
Φrskov E R, Ryle M. 反刍动物营养学. 周建民. 北京: 中国农业科技出版社, 1992.
[24] Michel W. Nutrition and Feeding. Shi Y, Shi F S. Beijing: China Agricultural University Press, 2004.
[25] Bargo F, Muller L D, Delahoy J E,etal. Milk response to concentrate supplementation of high producing dairy cows grazing at two pasture allowances. Journal of Dairy Science, 2001, 85(7): 1777-1792.
[26] Cheng S L. Effects of Pellet Diets with Different Nutritional Levels on Performance and Rumen Metabolism of Fattening Lambs. Lanzhou: Gansu Agricultural University, 2002.
程胜利. 不同营养水平颗粒料对育肥羔羊生产性能和瘤胃代谢的影响. 兰州: 甘肃农业大学, 2002.
[27] Ortega M E, Stern M D, Satter L D. The effect of rumen ammonia concentrate on dry matter disappearance in situ. Journal of Dairy Science, 1979, 62(1): 145-158.
[28] Zhang Q, Xia J M, Li S L,etal. Effects of different dietary proportion of compacted corn straw and Chinese wildrye on rumen fermentation and performance in dairy cows. Chinese Journal of Animal Nutrition, 2010, 22(2): 474-480.
张倩, 夏建民, 李胜利, 等. 不同比例压块秸秆与羊草组成粗饲料对奶牛瘤胃发酵和生产性能的影响. 动物营养学报, 2010, 22(2): 474-480.
[29] Ariza P, Bach A, Stern M D,etal. Effects of carbohydrates from citrus pulp and hominy feed on microbial fermentation in continuous culture. Journal of Animal Science, 2001, 79(10): 2713-2718.
[30] Hao Z L, Liu S M, Meng X Z. Nutrition of Ruminant Animals. Lanzhou: Gansu National Publishing House, 2000.
郝正里, 刘世民, 孟宪政. 反刍动物营养学. 兰州: 甘肃民族出版社, 2000.
[31] Liu J, Diao Q Y, Zhao Y G,etal. Effects of dietary NFC/NDF ratios on rumen pH, NH3-N and VFA of meat sheep. Chinese Journal of Animal Nutrition, 2012, 24(6): 1069-1077.
刘洁, 刁其玉, 赵一广, 等. 饲粮不同NFC/NDF对肉用绵羊瘤胃pH、氨态氮和挥发性脂肪酸的影响. 动物营养学报, 2012, 24(6): 1069-1077.
[32] Yang W Z, Beauchemin K A, Rode L M. Barley processing, forage: concentrate, and forage length effects on chewing and digest a passage in lactating cows. Journal of Dairy Science, 2001, 84: 2709-2720.
[33] Luo J J, Zhang B, Lan X Y,etal. Review of volatile fatty acid in animal production. Feed Review, 2012, (3): 10-12.
罗佳捷, 张彬, 兰欣怡, 等. 动物生产中挥发性脂肪酸的研究进展. 饲料博览, 2012, (3): 10-12.
[34] Broderick G A, Yang J H, Koegel R G,etal. Effect of heat-treating alfalfa hay on its utilization by lactating dairy cows. Journal of Dairy Science, 1991, 74(1): 210-217.
[35] Duan Z Y. Study of Associative Effects Between Starch and Neutral Detergent Fiber in Ruminants. Hangzhou: Zhejiang University, 2006.
段志勇. 反刍动物日粮中淀粉与纤维的组合效应及其机理的研究. 杭州: 浙江大学, 2006.
