曝气量对颗粒污泥制备生物柴油的影响
2018-03-02李安婕李美茜北京师范大学环境学院水沙科学教育部重点实验室水环境模拟国家重点实验室北京100875
迟 夏,李安婕,李美茜 (北京师范大学环境学院,水沙科学教育部重点实验室,水环境模拟国家重点实验室 北京 100875)
生物柴油是一种可再生,环境友好型能源,与动植物油脂相比,微生物油脂生产周期短,占用土地量小,可利用大量有机废弃物,是降低生物柴油生产成本,避免“与人争粮,与粮争地”的重要途径之一.利用废水作为碳源生产微生物油脂不仅可以降低生产成本,还可以减少因废水排放造成的环境污染.此外,把剩余污泥作为可再生资源实现能源回收,不仅能满足严格的环境质量标准,还能持续提供可靠能源.近几年已有研究者开展了市政废水处理厂初沉池,二沉池活性污泥生产生物柴油的方法,含量以及组分的研究[1-3],但目前活性污泥中提取出的脂质相对纯菌培养较低,为了提高活性污泥提取油脂制备生物柴油的可行性,需要从提高活性污泥微生物产油能力入手.
好氧颗粒污泥是多种微生物在生存竞争过程中自发形成的一种代谢互补紧密的营养关系,具有相当丰富的微生物相,通过调整好氧颗粒污泥培养条件很可能可以提高颗粒污泥混合菌群中产油微生物的比重以及油脂产量.颗粒污泥结构致密且生物量大,有利于简化后续微生物油脂提取脱水步骤以及提高油脂产量,从而降低生物柴油生产成本.
曝气量是污水好氧生化处理系统的重要工艺参数之一,影响着活性污泥中微生物的菌群结构以及降解污染物效果[4].此外,曝气系统也是污水处理厂运行的主要能耗单元之一.已有研究表明曝气量及溶解氧对微生物脂肪酸的组成会产生影响[5],因此,从节能降耗的角度出发,研究曝气量对颗粒污泥菌群结构、油脂积累以及后续制备生物柴油产量及组分的影响,对于颗粒污泥制备生物柴油的工业化生产具有理论价值和实践意义.
1 材料与方法
1.1 实验装置和SBR运行
以3个工作体积为1.2L的有机玻璃柱(直径5cm,高60cm)作为SBR反应器,分别设置不同的曝气量(R1,42L/(min·m³);R2,167L/(min·m³);R3,667L/(min·m³)).在反应器底部和中部分别设进水口和排水口.进水COD浓度为2000mg/L, COD:N:P=100:2:1,分别以葡萄糖和氯化铵作为碳源和氮源.反应器每6h为一个周期,其中进水5min,曝气344min,沉淀 3min,出水8min.在运行期间,通过投加NaHCO3,控制反应器的pH值处于7.5~8之间.接种颗粒污泥浓度约为6.4g/L左右.运行期间,测试的指标包括葡萄糖和氨氮浓度,污泥生物量,污泥粒径,污泥容积指数,以反映污泥的变化.
1.2 颗粒污泥分析检测方法
出水葡萄糖浓度采用苯酚-硫酸法测定[6],氨氮浓度采用国标《水质氨氮的测定纳氏试剂分光光度法》[7]测定.污泥平均粒径由激光粒度分析仪(Microtrac S3500,U.S.)测试.污泥特性监测指标包括总悬浮固体浓度 MLSS和污泥溶剂指数SVI[8].污泥中微生物菌群分布采用高通量测序获得,细菌与真菌的分布比例采用荧光定量PCR分析.选用E.Z.N.A.® Bacteria DNA试剂盒(Omega Bio-Tek, Norcross, GA, U.S.),根据试剂盒说明提取微生物DNA,并分别对细菌16s的V3V4区,真菌18s rRNA 进行PCR扩增,引物为16S Eub338 (ACTCCTACGGGAGGCAGCAG)/Eub518 (ATTACCGCGGCTGCTGG)和18S-F(CGGCTACCACATCCAAGGAA)/18S-R(GCTGGAATTACCGCGGCT).扩增程序如下:95℃变性2min,然后在95℃变性30s,55℃复性30s,72℃延伸30s,循环25次,72℃终延伸5min.20µL 标准PCR反应体系:5×Fastpfu Buffer 4µL,2.5mM dNTPs 2µL,上下游引物(5mM)各0.8µL,Fastpfu聚合酶0.4µL,DNA模板10ng.每个样本3次重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(Axygen Biosciences, Union City, CA, U.S.),将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega, U.S.)进行检测定量.纯化后的扩增产物由上海美吉生物医药科技有限公司在Illumina MiSeq PE300 平台上进行测序[9].
1.3 生物柴油制备和分析方法
生物柴油的制备方法:将1g 脱水污泥,7.5mL 5%硫酸甲醇及10mL正己烷在75℃条件下甲酯化反应7h,使用5mL饱和氯化钠溶液将锥形瓶中的混合物转移至离心管,并用正己烷重复萃取3次,离心后提取上层正己烷层,在80℃条件下蒸干,获得生物柴油.生物柴油在进行气相色谱检测前,存于-20℃冰箱.加入适量正己烷充分溶解样品,并以1,3-二甲苯作为内标,采用0.45μm的聚四氟乙烯(PTFE)滤膜过滤,利用安捷伦7890A气相色谱仪进行分析.色谱柱为30m×0.320mm×0.25μm HP-5毛细管柱(19091J-413,Agilent),其固定相为5%苯基甲基聚硅氧烷.柱箱温度从50℃开始,保持2min,以10℃/min的速率提高到130℃,以4℃/min提高到200℃,以3℃/min升至220℃,最后以5℃/min升至270℃.氢气,空气和氮气的流量分别是30,300和25mL/min.进样量为1μL,不分流模式.进样口和FID检测器温度分别设为200℃和270℃.用于脂肪酸甲酯定性定量分析的标准物包括含14种C8~C24的FAME混标(18918-1AMP,Sigma-Aldrich,美国),两种支链脂肪酸甲酯(12-甲基十四烷酸甲酯,14-甲基十五烷酸甲酯,Larodan Fine Chemicals AB,瑞典)和两种奇数碳脂肪酸甲酯(十五烷酸甲酯,十七烷酸甲酯,AccuStandard, Inc.,纽黑文,美国).
2 结果与讨论
2.1 曝气量对SBR运行情况的影响
曝气量分别为42,167和667L/(min·m3)的条件下,SBR反应器中的溶解氧浓度在一个运行周期内虽然会发生变化,但基本保持在3个不同水平,曝气量较高的反应器内能长时间保持较高的溶解氧浓度(图1).进水完成后,R1反应器中的溶解氧略低,为4mg/L,R2和R3的溶解氧浓度为4.4mg/L.曝气量为42L/(min·m3)时,反应器中的溶解氧在1h内下降到2mg/L左右,之后有轻微下降趋势,并在第4h降为1.6mg/L,紧接着开始略有上升.R2中的溶解氧在进水1h后,下降到3.7mg/L,之后呈逐渐上升的趋势,在曝气结束时达到6.4mg/L.曝气量为667L/(min·m3)时,R3的溶解氧浓度在前2h迅速上升到8.7mg/L;后4h,R3的溶解氧虽然略有波动,但几乎都在8mg/L以上.反应器中溶解氧的回升表明颗粒污泥对葡萄糖和氨氮的降解接近完成,减少耗氧量,使得反应器中的溶氧浓度增加.
曝气量不同,不仅反应器中的溶解氧浓度不同,颗粒污泥受到的剪切力也不同,因此颗粒污泥的生物量,沉降性能,平均粒径均呈现出明显差异(图2).曝气量为42L/(min·m3)时,颗粒污泥的生物量在第一周内几乎不变,微生物生长和衰亡的速率相当;曝气量为167 和667L/(min·m3)时,生物量有明显上升,说明提高曝气量有助于微生物的生长.但在后两周.
反应器R1和R2出现了生物量流失,MLSS逐渐下降.这是由于颗粒污泥粒径较大,曝气量低时,所提供的剪切力不利于颗粒污泥结构稳定;并且曝气量较低时,反应器中的溶解氧浓度也较低,在高有机负荷条件下,容易出现污泥膨胀.污泥发生膨胀后,有许多来不及沉降的污泥随出水流出,使得反应器中的MLSS下降.
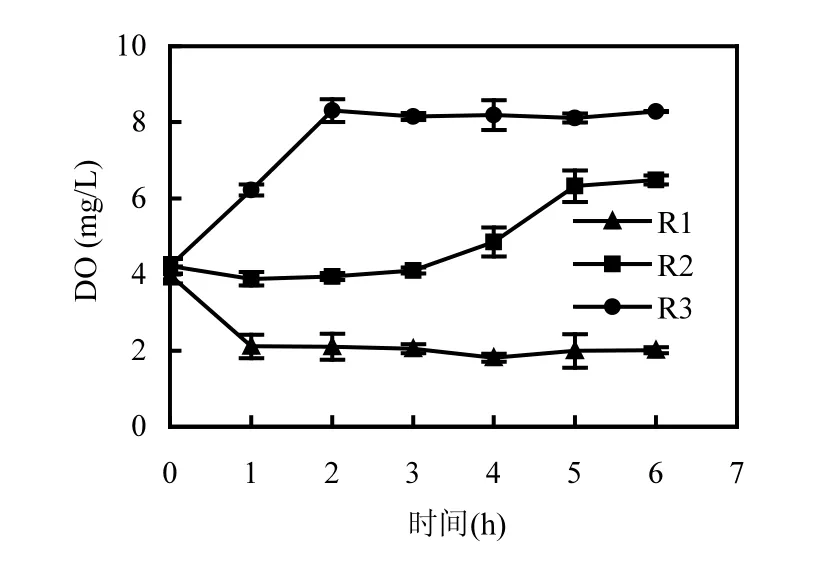
图1 不同曝气量下的SBR反应器溶解氧浓度Fig.1 The DO concentration in the three SBRs with different aeration rates
图2b的结果也表明,曝气量为42和167L/(min·m3)时,颗粒污泥的SVI值明显升高(大于150mL/g),污泥沉降性能恶化.污泥发生膨胀时,颗粒污泥不再保持紧密结实的结构,反而变得蓬松,如图2c所示,曝气量为42和167L/(min·m3)的污泥粒径明显增加,而曝气量为667L/(min·m3)下的污泥粒径维持在570~730um范围内,变化不大.当曝气量为667L/(min·m3)时,反应器中的溶解氧充足,并且微生物和底物的接触更为均匀,颗粒污泥处于较稳定的状态.在第14d时,R3反应器中的MLSS达到(17.74 ± 0.16)g/L.并保持很好的沉降性能,其SVI在35mL/g以下.颗粒污泥的粒径在前两周逐步上升,第三周有所下降,这可能是由于生物量太高时,污泥负荷降低,引起颗粒污泥轻微解体.虽然曝气量对颗粒污泥的生长和性状有很大影响,但它们对葡萄糖均有很好的降解效果.曝气量为42L/(min·m3)时,颗粒污泥对氨氮的降解效果不如曝气量较高时的情况,剩余氨氮约为5mg/L.当曝气量较高时,剩余氨氮低于1mg/L.
观察污泥的形态特征,发现颗粒污泥在较低曝气量下运行时,形态发生了显著的改变(图3).当曝气量为42和167L/(min·m³)时,污泥的颜色从初始的黄色变成灰白色,在边界上出现绒毛状微生物.第14d时,由于较小的絮状物更容易被排出,反应器中留下的多是连接成片状的污泥或是被灰白色微生物包裹的颗粒污泥.虽然有许多丝状菌附在颗粒污泥的表面,但膨胀后颗粒污泥内部黄色的区域仍然易于辨认.当曝气量为667L/ (min·m3)时,颗粒污泥除了在数量上明显增多外,在外观上与接种颗粒污泥无明显差别,均保持密实的结构,而且颗粒污泥呈黄色,并无明显膨胀的现象.

图2 曝气量对SBR反应器中颗粒污泥生物量、沉降性能和平均粒径的影响Fig.2 The performance parameters of the three SBRs:MLSS of the granular sludge, SVI of the granular sludge, sedimentation and particle size of sludge
2.2 曝气量对颗粒污泥制备生物柴油产量及组分的影响
在曝气量分别为42,167和667L/(min·m3)的条件下运行20d后,颗粒污泥制备生物柴油的产量有了不同程度的提高,分别为(38.39±1.26),(48.62±1.36)和(27.28±2.94)mg/g SS,初始接种污泥的生物柴油产量为(22.71±2.24)mg/g SS,其中曝气量为167L/(min·m3)条件下单位生物量的油脂含量最高.在667L/(min·m3)条件下,颗粒污泥的生长量最高,降低了污泥负荷,使得相应的生物柴油产量的增幅较低.
另一方面,不同曝气量对颗粒污泥制备生物柴油各组分的影响极为明显(图3).如图a所示,曝气量为42,167和667L/(min·m3)时,棕榈油酸甲酯(C16:1)的产量随曝气量的降低而升高,分别为(10.98 ± 0.22),(4.13 ± 0.46)和(1.70 ± 0.17) mg/g SS.曝气量为667L/(min·m3)时,棕榈酸甲脂(C16:0)的产量也明显低于曝气量为42和167L/(min·m3)的情况.但油酸甲酯(C18:1)的产量随曝气量的变化表现出相反的趋势,随着曝气量的提高,其产量分别为(9.72±0.34),(12.16±0.36)和(14.79±1.35)mg/g SS.此外,亚油酸甲酯(C18:2)也受曝气量影响很大,在曝气量为167L/(min·m3)时,产量高达(20.85±0.09) mg/g SS.但曝气量在42和667L/(min·m3)时,其产量明显偏低,分别为(4.05±0.38)和(0.82±0.04)mg/g SS.上述结果表明适当的曝气有利于某些特定脂肪酸的累积.比较生物柴油的组分分布发现,在曝气量为667L/(min·m3)的条件下,颗粒污泥制备生物柴油的组分分布与接种污泥极其相近.这是由于接种污泥是在曝气量为833L/(min·m3)的条件下培养而得的,本次实验所设的667L/(min·m3)与之非常接近.而曝气量为42和167L/(min·m3)时,生物柴油的组分分布却差异很大.王怡等[10]采用某污水处理厂的二沉池污泥制备生物柴油,产量为19.3mg/g SS,主要包括棕榈油酸甲酯,棕榈酸甲酯,油酸甲酯,硬脂酸甲酯和亚油酸甲酯.其生物柴油产量与本实验初始接种污泥的产量相近,远低于在曝气量167L/ (min·m3)下培养的颗粒污泥,说明适当的曝气条件确实能够提高生物柴油产量且影响生物柴油组分.
2.3 曝气量对颗粒污泥菌群结构的影响
在不同曝气量条件下运行一段时间后,颗粒污泥的菌群结构变化明显.通过荧光定量PCR确定了颗粒污泥中细菌和真菌的比例(表1).3个反应器中细菌均占据着绝对优势,比例在91%以上.曝气量为42和667L/(min·m3)时,真菌的比例分别是0.01% 和0.18%;曝气量为167L/(min·m3)时,真菌比例最高(8.57%).曝气量为167L/(min·m3)时,颗粒污泥发生膨胀,部分生物量流失,使得污泥负荷增加(约1kg COD/kg MLSS⋅d).本实验室之前的研究表明,初始污泥负荷较高时,真菌更容易成为颗粒污泥中的优势菌群.类似地,本研究后期污泥负荷的提高,也可能促进真菌的繁殖.颗粒污泥在曝气量为42L/(min·m3)条件下运行时,虽然污泥负荷有所提高,但过低的曝气量可能影响微生物的活性,进而抑制了真菌的生长.真菌的产油能力一般高于细菌[11],因此曝气量为167L/(min·m3)时,单位污泥的生物柴油产量最高(图4).

图3 不同曝气量下SBR反应器中的颗粒污泥形态Fig.3 The morphology of the granular sludge in the three SBRs with different aeration rates

表1 颗粒污泥中细菌和真菌的比例Table 1 The distribution of bacteria and fungi in the three types of granular sludge
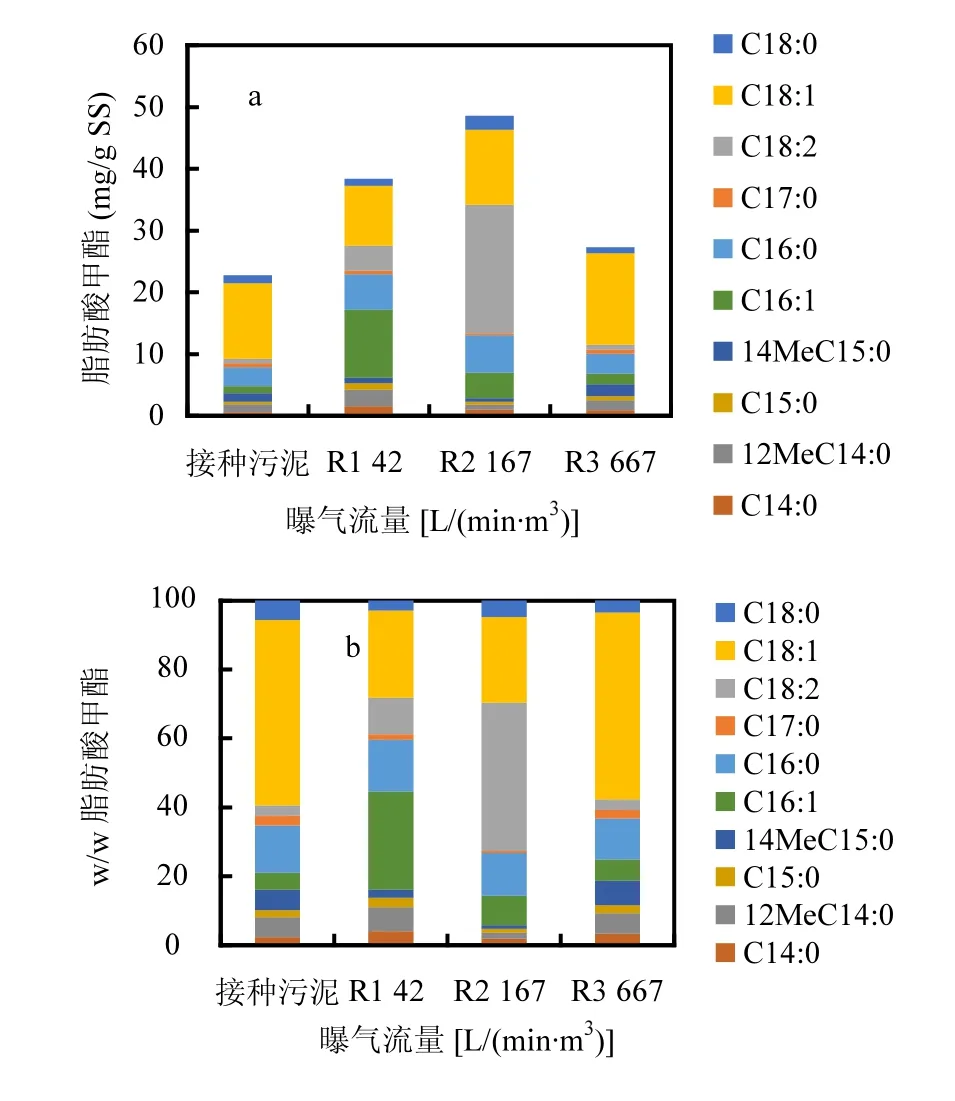
图4 SBR反应器颗粒污泥制备生物柴油的产量和组分分布Fig.4 The yield of each FAME from the granular sludge based on the weight of dry sludge and the percentage of each FAME
对颗粒污泥中的细菌进行门水平上的分析(图5a),发现变形菌门Proteobacteria和拟杆菌门Bacteroidetes占优势,其中Proteobacteria的比例大于70%.随着曝气量的增加,Proteobacteria的比例略有下降,但Bacteroidetes的比例却明显提高.曝气量为42L/(min·m3)时,厚壁菌门Firmicutes比其余情况更高,约占9%.此外,Gracilibacteria的比例在曝气量为167L/(min·m3)时明显增高.如图5b所示,曝气量过低时,丛毛单胞菌Comamonadaceaeunclassified在细菌中占绝对优势(占46%).此外,Tolumonas,Photobacterium和Lactococcus也是含量较高的菌种,各占7~9%.许多研究表明Comamonadaceae含有C16:0,C16:1和C18:1等脂肪酸[12-14].十六烷酸(C16:0)是Tolumonas osonensis sp.最主要的脂肪酸[15],碳数为16的饱和脂肪酸和单不饱和脂肪酸则是Photobacterium中最主要的脂肪酸[16]. Lactococcus lactis细胞膜上主要的脂肪酸为十六烷酸(C16:0)和十八烯酸(C18:1)[17].这些细菌均含有碳数为16的脂肪酸,因此曝气量为42L/(min·m3)时,生物柴油中碳数为16的脂肪酸酸甲酯(C16:0,C16:1)的产量最高.曝气量为167L/(min·m³)时,Comamonadaceae的比例下降到9%,但Tolumonas和Photobacterium的含量大幅上升,分别占31%和21%.因此,曝气量为167L/(min·m3)时,生物柴油中仍有较高的棕榈酸甲酯(C16:0)和棕榈油酸甲酯(C16:1).曝气量为667L/(min·m3)时,最主要的四类细菌分别是Comamonadaceae(12%),Photobacterium(18%),Flavobacterium(9%)和Hydrogenophaga(10%),而Tolumonas的比例有明显的下降,仅为1%.Hydrogenophaga含有较多的十八烯酸[18],有助于提高生物柴油中油酸甲酯(C18:1)的含量.
对颗粒污泥中的真菌进一步鉴定(图6a),结果表明曝气量为42和167L/(min·m³)时,颗粒污泥的真菌部分几乎完全由子囊菌门Ascomycota构成,其比例大于99%.当曝气量为667L/(min·m³)时,颗粒污泥的真菌多样性更为丰富,Ascomycota的比例下降到82%,另外还有褐藻门Ochrophyta(12%),Ciliophora(3%)等.图6b给出了真菌在属水平上的分析结果,Dipodascus和Hypocreales都属于子囊菌门Ascomycota,但Hypocreales只出现在曝气量为667L/(min·m3)的情况下.褐藻门Ochrophyta被进一步鉴定为Spumella. Dipodascus是一种酵母菌,属于Dipodascaceae科,Botha和Kock1[19]在Dipodascaceae中提取出亚油酸(C18:2).Dipodascu在颗粒污泥中的出现,大大提高了生物柴油中亚油酸甲酯(C18:2)的含量(图6).
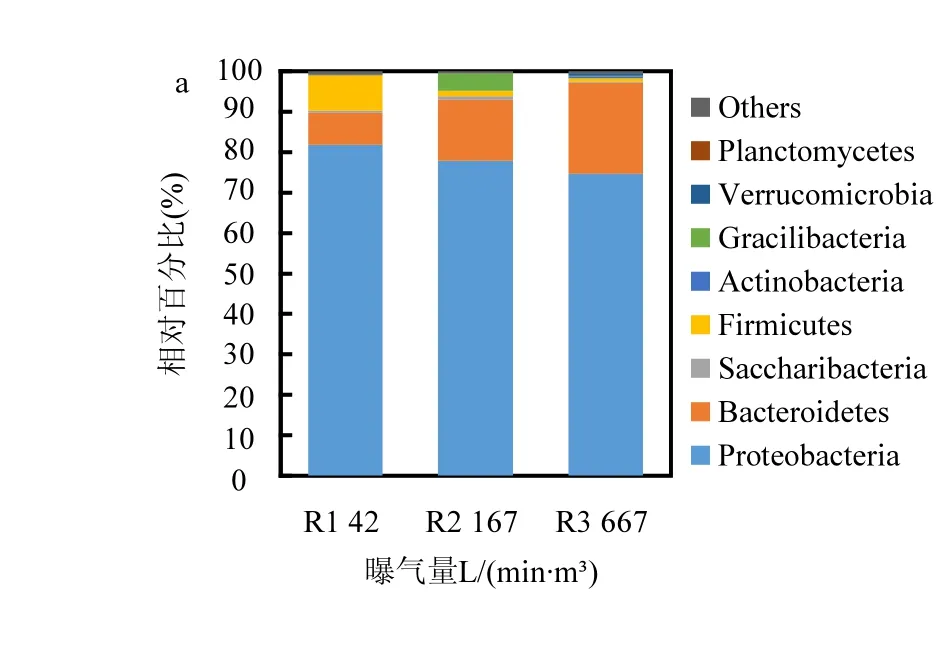
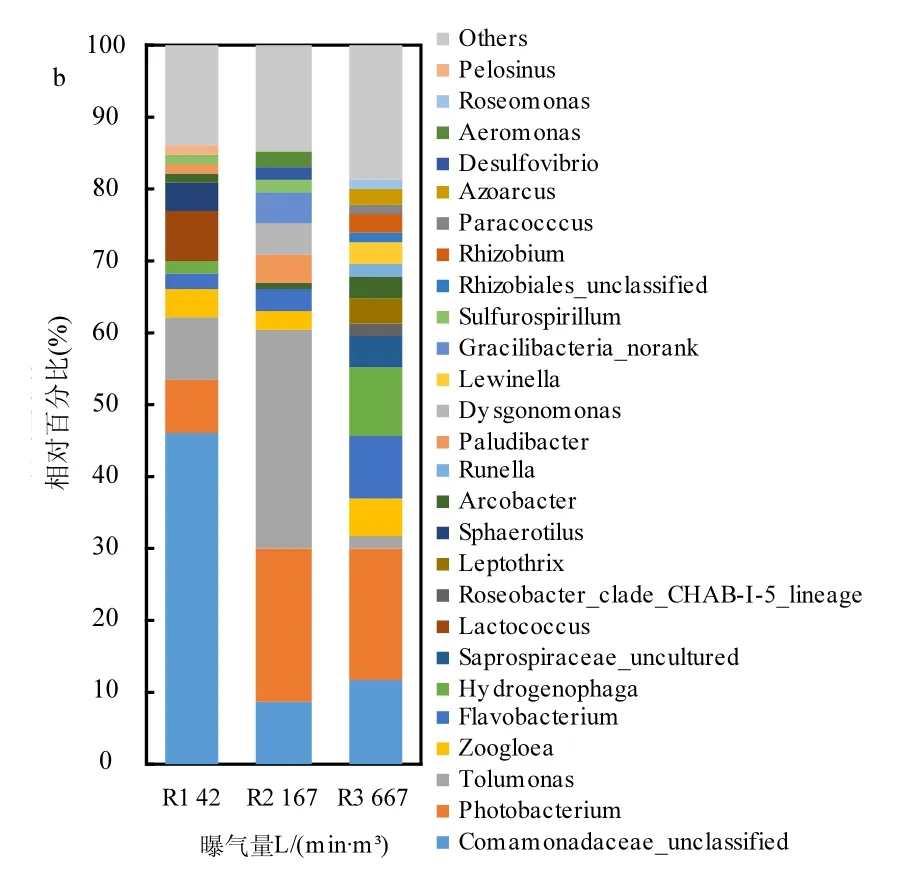
图5 颗粒污泥细菌菌群结构Fig.5 The bacterial population structure of granular sludge in the three SBRs
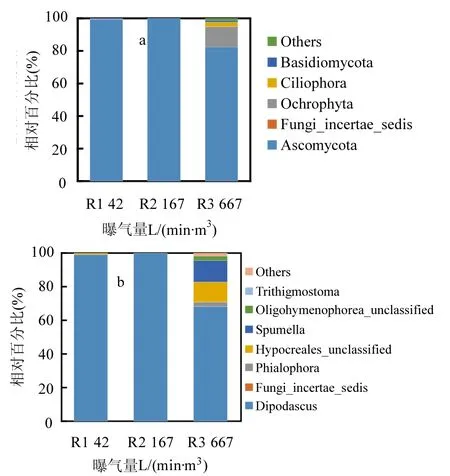
图6 颗粒污泥真菌菌群结构Fig.6 The fungal population structure of granular sludge in the three SBRs
3 结论
3.1 曝气量需控制在一个适中的水平才有利于微生物累积油脂.当曝气量太高时,微生物生长速率太快,降低了微生物的油脂量.曝气量太低时,微生物油脂产量也会减少.当曝气量为167L/(min·m³)时,单位污泥的生物柴油产量较高,为(48.62 ± 1.36) mg/g SS.
3.2 不同曝气条件下的菌群结构有显著差别,曝气量为167L/(min·m³)时,真菌比例最高,达到8.57%,而细菌中的Tolumonas和Photobacterium含量也大幅上升,分别占31%和21%,菌群结构的差异可能是导致油脂产量不同的主要原因.
3.3 曝气量较低时,颗粒污泥倾向于累积更多棕榈酸 (C16:0)和棕榈油酸(C16:1);曝气量为167L/(min·m³)时,油酸甲酯(C18:2)大幅增加,该油脂组分的变化可能与颗粒污泥中出现的酵母Dipodascus有很大的关系.
[1] Mondala A, Liang K, Toghiani H, et al. Biodiesel production by in situ transesterification of municipal primary and secondary sludges [J]. Bioresource Technology, 2009,100(3):1203-1210.
[2] 刘 琳,叶嘉琦,刘玉洪,等.好氧污泥-微藻耦合颗粒的培养及特性研究 [J]. 2017,37(7):2536-2541.
[3] Pastore C, Lopez A, Lotito V, et al. Biodiesel from dewatered wastewater sludge: a two-step process for a more advantageous production [J]. Chemosphere, 2013,92(6):667-673.
[4] 杨岸明.城市污水处理厂曝气节能方法与技术 [D]. 北京工业大学, 2012.
[5] Ahmed S U, Singh S K, Pandey A, et al. Fatty acid profiling during microbial lipid production under varying pO2and impeller tip speeds [J]. Applied Biochemistry and Biotechnology, 2008,151(2):599-609.
[6] Philipp Gerhardt, Murray R G E, et al. Methods for general and molecular bacteriology [M]. American Society for Microbiology, 1994.
[7] HJ535-2009 《水质 氨氮的测定-纳氏试剂分光光度法》[S].
[8] APHA, 2005. Standard methods for the examination of water and wastewater, twenty first ed [J]. American Public Health Administration, Washington, 2005.
[9] Sun Q, Li A J, Li M X, et al. Effect of pH on biodiesel production and the microbial structure of glucose-fed activated sludge [J]. Int Biodeter Biodegr, 2015,104:224-230.
[10] 王 怡,白小娟,艾怡霏,等.城市污水处理厂污泥制取生物柴油的试验研究 [J]. 中国给水排水, 2014,(1):14-17.
[11] 李元森.产油脂丝状真菌的筛选及其产油脂条件的优化 [D].济南:山东轻工业学院, 2009.
[12] Bruland N, Bathe S, Willems A, et al. Pseudorhodoferax soli gen.nov., sp. nov. and Pseudorhodoferax caeni sp. nov., two members of the class Betaproteobacteria belonging to the family Comamonadaceae [J]. International Journal of Systematic &Evolutionary Microbiology, 2009,59(11):2702-2709.
[13] Dong L, Ming H, Liu L, et al. Zhizhongheella caldifontis gen.nov., sp. nov., a novel member of the family Comamonadaceae [J].Antonie van Leeuwenhoek, 2014,105(4):755-761.
[14] Fang W, Li Y, Xue H, et al. Corticibacter populi gen. nov., sp.nov., a new member of the Comamonadaceae, from the bark of Populus euramericana [J]. International Journal of Systematic &Evolutionary Microbiology, 2015,65(10):3333-3338.
[15] Caldwell M E, Allen T D, Lawson P A, et al. Tolumonas osonensis sp. nov., isolated from anoxic freshwater sediment, and emended description of the genus Tolumonas [J]. International Journal of Systematic & Evolutionary Microbiology, 2011,61(11):2659-2663.
[16] Kuang G, Xiao A, Chen Q, et al. Characterization of PB-CS01, A novel photobacterium strain isolated from commercial pork [J].Journal of Animal & Veterinary Advances, 2012,11(23):4292-4296.
[17] Veld G I T, Driessen A J M, Kamp J A F O D, et al. Hydrophobic membrane thickness and lipid-protein interactions of the leucine transport system of Lactococcus lactis [J]. Biochimica Et Biophysica Acta, 1991,1065(2):203-212.
[18] Contzen M, Moore E R, Blümel S, et al. Hydrogenophaga intermedia sp. nov., a 4-aminobenzenesulfonate degrading organism [J]. Systematic & Applied Microbiology, 2000,23(4):487-493.
[19] Botha A, Kock J L. The distribution and taxonomic value of fatty acids and eicosanoids in the Lipomycetaceae and Dipodascaceae[J]. Antonie van Leeuwenhoek, 1993,63(2):111-123.
