麦田O3干沉降过程及不同沉降通道分配的模拟
2018-03-02徐静馨郑有飞麦博儒储仲芳黄积庆中国气象局气溶胶与云降水重点开放实验室江苏南京0044南京信息工程大学江苏省大气环境与装备技术协同创新中心江苏南京0044中国气象局广州热带海洋气象研究所广东省区域数值天气预报重点实验室广东广州50080
徐静馨,郑有飞,*,麦博儒,赵 辉,储仲芳,黄积庆,袁 月 (.中国气象局气溶胶与云降水重点开放实验室,江苏 南京 0044;.南京信息工程大学,江苏省大气环境与装备技术协同创新中心,江苏 南京 0044;.中国气象局广州热带海洋气象研究所/广东省区域数值天气预报重点实验室,广东 广州 50080)
平流层臭氧(O3)可以保护地球上的生命免受过量紫外线的强烈辐射,而近地层O3不仅是一种常见的温室气体和重要空气污染物,而且还是主要由NOx和VOC通过光化学反应产生的强氧化剂.由于人类活动的影响目前全球一些地区的平均年O3浓度从工业革命前的10nL/L增长到20~45nL/L[1],Meehl等[2]预计到2015~2050年全球平均O3浓度会增加20%~25%,到2100会增加40%~60%.
O3能减少大气中的红外辐射释放到太空从而使全球气温变暖,其正辐射强迫占全球净辐射强迫的25%[3].其次,O3对建筑材料、人类健康和植物均带来毒害效应[4-9].对于植物来说,O3损害其光合作用和干物质累积[10-19].对于农田生态系统来说,目前高浓度的O3浓度已导致作物大幅度减产,使每年的经济损失高达11~18亿美元,直接威胁了粮食安全[20-22].此外最近的模型研究指出O3会使陆地生态系统中的CO2吸收减少,从而影响大气温室气体的收支平衡和全球温室效应[23-24].因此提供准确的表面O3交换模型对改善全球近地层O3收支的估算有着重要的意义.
陆地生态系统是O3重要的汇.O3难溶于水,主要采用干沉降方式进行沉降[25].为了了解陆地生态系统O3的干沉降过程和预测O3对植物的潜在危害,需要预测总O3通量并区分其不同沉降通道的分配.不少国外学者在森林、草地和农田等陆地生态系统已经展开了模型研究[26-30].目前主要假设将O3干沉降过程分为气孔沉降与非气孔沉降两个通道,其中非气孔沉降主要包含土壤沉降和表面沉降.对于O3干沉降的模拟主要采用一层或两次植被层及一层土壤层的阻力模型[31-32],然而这些模型的阻力参数并不相同,尤其是非气孔沉降阻力参数的使用并不一致[28,33-34],其中土壤和表面沉降过程可能存在相互补偿的作用且它们各自在非气孔通道的分配比并不明确.此外近几年研究指出由于植物排放的BVOC和土壤排放的NO等气体与O3产生的化学反应,也是O3干沉降的另一条沉降通道[35].我国对于O3干沉降的研究还仅限于观测试验和分析[36-39],还并未开展O3干沉降模型的相关研究.本文将在涡度相关系统对南京地区冬小麦田和裸土期O3干沉降过程观测的基础上,引入Surfatm-O3干沉降模型,首次用该方法对其叶片气孔阻力(Rsleaf)、土壤阻力(Rsoil)和表面阻力(Rcut)进行参数化修订和验证,开展了冬小麦主要生育期的总O3通量(FO3)、干沉降速率(Vd)及其不同沉降通道分配的模拟,并间接分析了NO与O3的化学反应对O3干沉降的影响,为农田生态系统O3干沉降模型的研究和定量评估O3胁迫对作物的影响提供理论依据和方法.
1 材料和方法
1.1 试验地介绍
试验位于南京信息工程大学浦口区盘城镇永丰观测场(118°42’25’E,32°11’6’N,海拔22m)的稻麦轮作区,周围地势平坦开阔,无高大建筑物遮蔽,耕作土壤类型为黄棕壤,土质细腻均匀,肥力中等,黏粒含量为26.1%.试验地处北亚热带季风湿润气候区,具有气候温和、四季分明、冬冷夏热、雨量充沛、光照充足的特点.年均降雨量和气温分别为1100mm和15.4℃,年均日照时数2264h,适宜作物生长的无霜期约为225d.供试作物为当地主载品种‘扬麦13号’(Triticum aestivum L. cv. Yangmai 13),于2015年11月上旬撒播,至2016年6月6日成熟收割.
1.2 仪器和观测
试验主要分为两个时段:冬小麦覆盖期(2016年3月16日(冬小麦拔节初期)开始,于2016年5月30日(冬小麦蜡熟期)结束)和裸土期(2016年6月6日~2016年6月18日).O3通量的观测是主要基于涡度相关系统.该系统主要由一台CR3000数据采集器、一个三维超声风速仪(CSAT3, Campbell Scientific, USA)、一套 H2O/CO2浓度红外分析仪(LI-7500, LI-COR, USA)、一台慢速紫外O3分析仪(EC9810-O3, Casella Measurement, England)和一台快速化学发光O3分析仪(FOSV12, Sextant, New Zealand)组成.CR3000数据采集器用于数据存储,并可在线对原始数据进行了延时纠正和时间平均等前处理,得到30min的平均数据;三维超声风速仪用于测量三维风速和超声虚温;H2O/CO2浓度红外分析仪用于测量生态系统的感热通量、潜热通量、CO2通量和H2O通量;慢速紫外O3分析仪分辨率为0.001ppm,响应时间为1s,原理是交替切换一个有选择性的O3涤去器进出于测量气路,并算出透射光的比值,从而得出通常空气混合物中的O3浓度的测量值.快速化学发光O3分析仪工作原理是香豆素被O3氧化并发出荧光,被光电倍增管探测后转化成为电压输出,频率为10Hz,获得的数据需要利用慢速紫外O3分析仪获得的30min平均O3浓度进行时时校准.其他气象要素也同时进行了观测,包含太阳辐射(TBQ-5A,JWF,中国上海),四分量净辐射(CNR4, Kipp &Zonen, the Netherlands)、空气温湿度(HOBO U23-001data-logger, Onset Computer, USA),风速、风向和降雨量(Watchdog, 2900ET, Spectrum Technologies, USA)等.涡度相关系统的采样频率为10Hz,系统每30min输出一组上述观测项目的平均结果(包括气象要素、通量和O3浓度等),观测数据和平均结果均由CR3000数据采集器进行存储.涡度相关系统的观测高度约为7m,两个O3分析仪进气口高度与其一致,气路是由惰性材料组成的密闭通道.观测期间每天定时查看数据和定期维护,由于香豆素会不断的被消耗,每5d左右更换一次香豆素涂层片.并从3月16日起每隔7d对冬小麦的叶面积(分绿叶和黄叶)、株高和气孔导度进行测量;叶面积和株高的测量方法参照《农业气象观测规范 上卷》[40],气孔导度的测量主要利用SC-1稳态气孔导度仪随机选择5~8株冬小麦旗叶,每次测量时间为08:00~17:00,每个小时进行1次气孔导度测量,其间每株冬小麦测量1个数据点.
裸土期土壤排放的NO通量主要采用静态箱进行测量,主要原理是用静态箱覆盖一定面积的土壤,限制箱内外气体交换并测定箱内空气中浓度的变化,由此计算界面交换的通量.静态箱体为不锈钢结构(长100cm×宽50cm×高50cm)外覆绝热材料,气温变化幅度小于2℃.底部为不锈钢底座,座壁深入土壤20cm,距离地表10cm以下的侧壁上开有9个直径2cm的圆孔,底座顶端有深、宽均为3cm的水槽,注水后可保证底座与箱体密封,箱内有两个风扇加速箱体内空气对流,同时利用温湿度气压仪对箱内的温湿度、气压进行连续观测.于裸土期间每天07:00至~17:00每小时对大气中的NO浓度进行测量;于每天相同时段同时对土壤排放NO浓度也进行测量:测量时静态箱开闭之间有20min的间隔,每隔10min抽取箱内气体进行测量,每次观测持续40min.大气中的NO浓度和土壤排放的NO浓度均采用NO- NO2-NOx化学发光式分析仪(Trace Level 42C, Thermo Environmental Instrument, USA)测定.观测之前已对仪器进行标定,该仪器响应时间为1s,量程为0~50.0mg/L,精度为±5%.
1.3 Surfatm-O3模型介绍
Surfatm-O3模型[41]是一维的双向土壤-植被-大气传输模型,是以阻力模型为基础的双层模型,由两个模型耦合组成,即能量平衡模型和污染气体交换模型,可模拟地表和大气间O3通量的污染物交换.该模型主要包括气孔、表面和土壤沉降3个通道,影响O3干沉降速率(Vd)的阻力包括空气动力学阻力Ra、冠层内空气动力学阻力Rac、叶片准层状边界层阻力Rbl、土壤准层状边界层阻力Rbs、土壤阻力Rsoil、表面阻力Rcut和叶片气孔阻力Rsleaf.其中Rbl、Rcut和Rs属于植被层阻力(Rplant),Rbs,Rac和Rsoil属于土壤层阻力(Rground),将植被层阻力和土壤层阻力之和表示为Rc.Vd主要公式为(1)~(4):
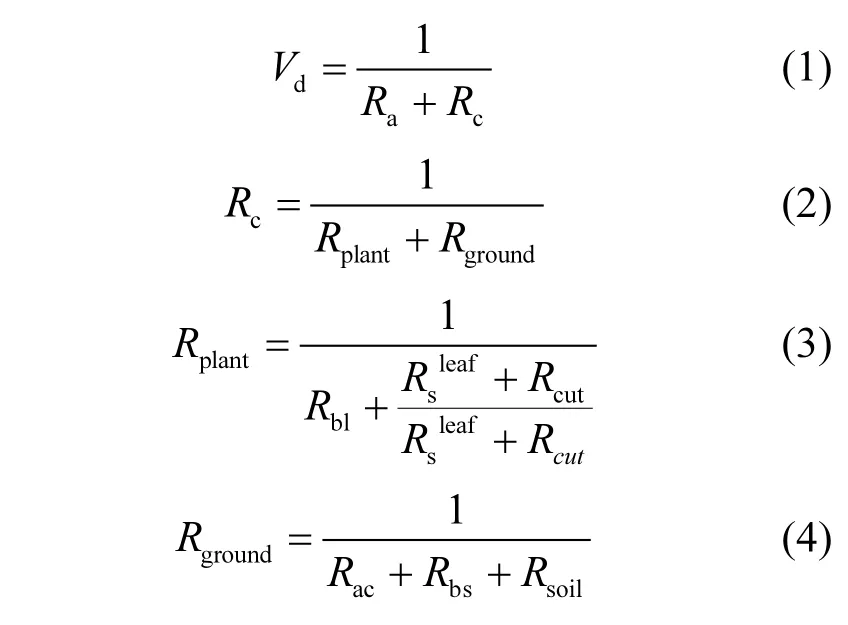
式中:Ra、Rac、Rbl、Rbs的计算方法主要参照Personne等[41]的方法.、Rcut、Rsoil的计算公式详见1.3.1-1.3.3节.
1.3.1 叶片气孔阻力Rsleaf叶片气孔阻力模型主要基于Jarvis非线性阶乘式算法模型.该模型考虑了太阳辐射(PAR)、温度(T)、水汽压差(VPD)、土壤水分(SWC)等多个环境因子综合作用对叶片气孔导度的综合影响.叶片气孔阻力()是气孔导度(Gs)的倒数,计算公式按照Emberson等[42]和Tuovinen等[43]的方法:
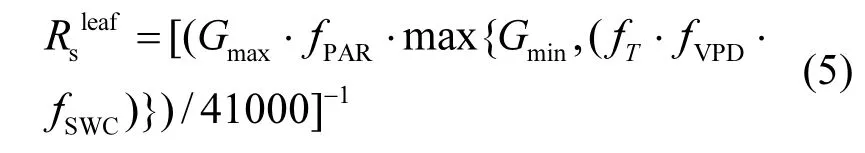
式中:Gmax是冬小麦的最大气孔导度,mmolO3/(m2·s);Gmin是在白天的最小气孔导度;函数fPAR、fT、fVPD和fSWC分别表示瞬时光合有效辐射(PAR)、温度(T)、叶片与空气间的水汽压差(VPD)和土壤水分(SWC)对气孔导度的影响函数;41000是单位mmol/(m2·s)与m/s之间的转换因子[44].其中函数fPAR、fT、fVPD和fSWC的值均在0~1之间变化.GS从H2O转化为O3的计算主要根据Graham定律,分子扩散转化因子为0.66.
将气孔导度从叶片尺度升级到冠层尺度,主要是将叶片气孔阻力除以叶面积指数(LAI)[42-43].此外,根据Stella等[29]的方法,本研究也将叶面积指数分为了绿叶(可进行光合作用)和黄叶(无法进行光合作用)叶面积指数,则冠层绿叶和黄叶气孔阻力公式分别为:

1.3.2 土壤阻力Rsoil土壤阻力(Rsoil)模型的算法主要基于Stella等[29]的如下公式:
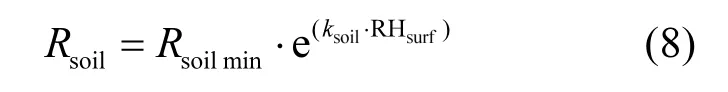
式中:Rsoilmin是当RHsurf=0时土壤阻力,m/s; ksoil为经验参数; RHsurf是土壤表面湿度,%. RHsurf的计算具体公式如下:

式中:Psurf是在参考高度的水汽压,Pa; P(Tsurf) 是在Tsurf时的饱和蒸气压,Pa; H是感热通量, W/m2;ρ是空气密度,kg/m2;Cp是空气比热容,J/(kg·K);XH2Osurf是表面水汽浓度,kg/m3;Ta是空气温度,℃;E是水汽通量,kg/(m2·s); XH2Oa是利用相对湿度计算的水汽密度,g/m3; R是普适气体常数,J/(mol·K);MH2O是水分子摩尔质量,g/mol; P是大气压强,Pa;L是水的汽化潜热,J/kg; To是水沸腾时的温度,℃.
Rsoilmin与ksoil的取值主要依据裸土期土壤阻力Rsoil_bare的参数化方案.这主要是因为裸土期无冠层植被覆盖,气孔阻力与表面阻力均为0,因此基于大叶O3干沉降模型理论[32],裸土期土壤阻力(Rsoil_bare)公式为:

式中:Rb为边界层阻力,m/s,计算方法参照Baldocchi等[45]的方法.则将公式(8)修改为:

1.3.3 表面阻力Rcut表面阻力(Rcut)的计算参照van Pul等[46]及Zhang等[33]的方法,具体公式如下:
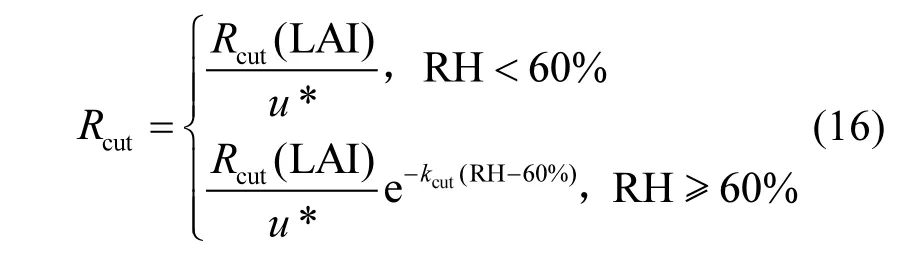
基于大叶O3干沉降模型理论,非气孔导度(Gns)是冠层导度(Gc)与气孔导度(Gs)的差值,也即土壤导度(Gsoil)与表面导度(Gcut)(其中导度为对应阻力的倒数)之和,其中植被覆盖期的Gsoil是Rac和Rsoil之和的倒数.具体公式如下:
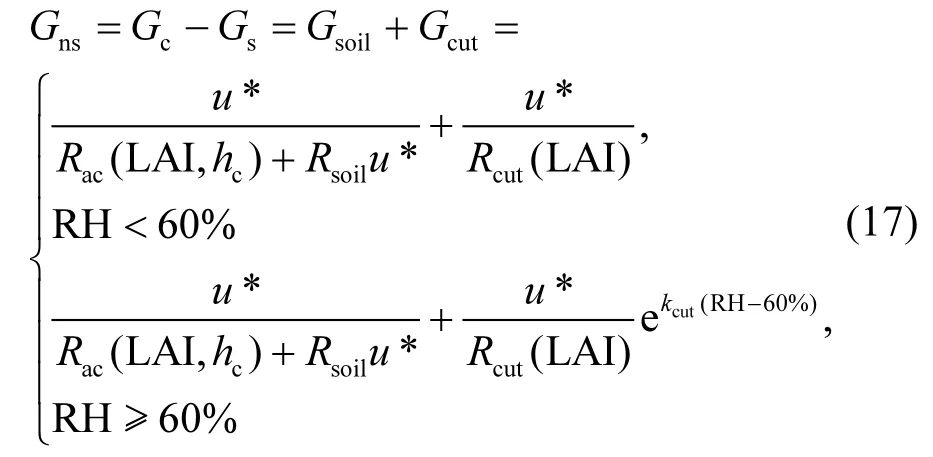
式中:Rac(LAI,hc)是冠层内动力学阻力经验系数;Rcut(LAI)是表面阻力系数;kcut是经验参数.
Rac(LAI,hc)和Rcut(LAI)会随冬小麦的叶面积指数(LAI)和株高(hc)而改变,其中Rac(LAI,hc)可以简化为b⋅LAI⋅hc,且当Rac(LAI,hc)达到最大值时(Racmax),则Rcut(LAI)则为最小值(Rcutmin).由于本研究观测期间冬小麦叶面积指数变化范围为1.5m2/m2~3.5m2/m2,株高变化范围为0.38m~0.73m,可见LAI和hc变化范围较小,因此在这里近似认为Rac(LAI,hc)和Rcut(LAI)是常数,且等同于Racmax和Rcutmin.则公式(17)改为:

综上公式(16)修改为:
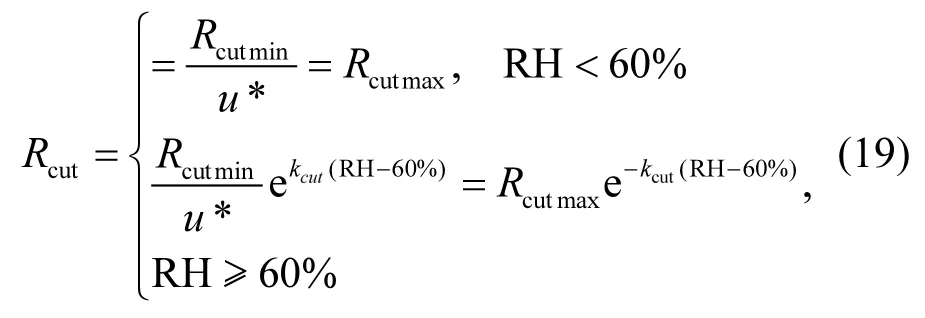
1.4 实测值的计算
1.4.1 实测冠层导度(Gcm)的计算 实测冠层导度(Gcm)的计算主要基于大叶O3干沉降理论,具体公式如下:
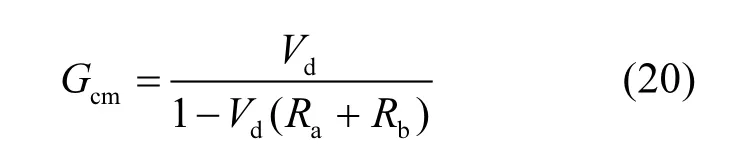
1.4.2 实测气孔导度Gsm和非气孔导度Gnsm的计算 实测气孔导度Gsm的计算基于不同干湿条件下,利用彭曼公式并结合CO2同化量(GPP)共同获得,主要计算过程详见Lamaud[34]等的方法.Gsm的计算公式为:
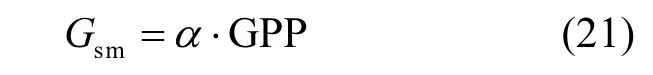
式中:α为在干燥条件下(即相对湿度<60%)时的Gs1与GPP的斜率,其中Gs1为干燥条件下利用彭曼公式计算的O3气孔导度,具体公式如下:
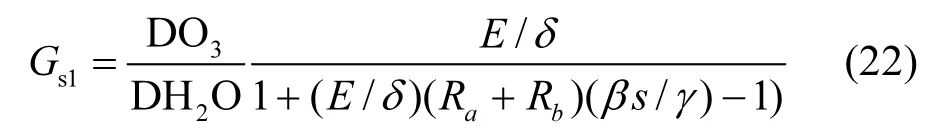
式中:DO3和DH2O是O3和H2O的分子扩散率,m2/s,其中DO3/DH2O≈0.66;E是水汽通量,kg/(m2·s);δ是水蒸气饱和密度差,kg/m3;β是波文比;s是饱和曲线斜率,Pa/K; γ是湿度常数,Pa/K.
实测非气孔导度(Gnsm)即为Gcm与Gsm的差值.
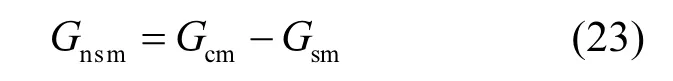
1.4.3 实测土壤排放的NO通量的计算 实测土壤排放的NO通量(FNO)的公式如下:
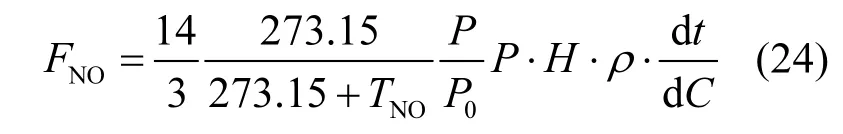
式中:FNO为土壤排放的NO通量,nmol/(m2·s);T为采样时的箱内平均气温,℃;P为采样时的气压,Pa;P0为标准大气压,Pa; ρ为标准状态下的NO密度,g/L;C为NO的体积浓度,×10-6;t为关箱时间,min.
2 结果与分析
2.1 气象条件、O3浓度和冬小麦生物要素因子的变化
图1是观测期间的气象条件、O3浓度和冬小麦生物要素因子的变化图.图1a~图1f是气象条件和O3浓度的日变化过程图.图1a中,冬小麦覆盖期太阳辐射(SR)呈“单峰”变化趋势,从清晨07:00开始快速上升,到正午12:00左右达到峰值(600W/m2)后迅速下降.图1b中,冬小麦覆盖期土壤水分(SWC)的日变化幅度较小,仅在午后14:00左右有微弱增大(32.2%).图1c中,各温度均呈现 “单峰”变化,冬小麦覆盖期温度(Ta-w)和裸土期温度(Ta-bare)均在午后14:00左右达到最大值(分别为22℃和27℃),变化范围分别为15℃~22℃和24℃~27℃;裸土期表面温度(Tsurf)在正午达到最大值(31℃),变化范围为23℃~31℃.图1d中,冬小麦覆盖期O3浓度(CO-w)和裸土期O3浓度(CO-bare)变化趋势相同,均在从07:00左右开始快速上升,在16:00左右达到一天的峰值(分别为60nL/L和70nL/L)后快速下降,20:00后保持缓慢下降的趋势,CO-bare的值略高于CO-w.图1e中,冬小麦覆盖期水汽压差(VPD)在清晨达到最小值后上升,在午后15:00左右达到最大值(1.8kPa)后迅速下降;裸土期空气相对湿度(RHbare)和表面相对湿度(RHsurf)的日变化趋势均与VPD相反,均在15:00左右达到最小值(分别为72%和52%),变化范围分别为72%~95%和53%~90%.图1f中,冬小麦覆盖期摩擦速度(u*)在午后15:00达到最大值(0.4m/s)后下降,20:00后又缓慢上升.
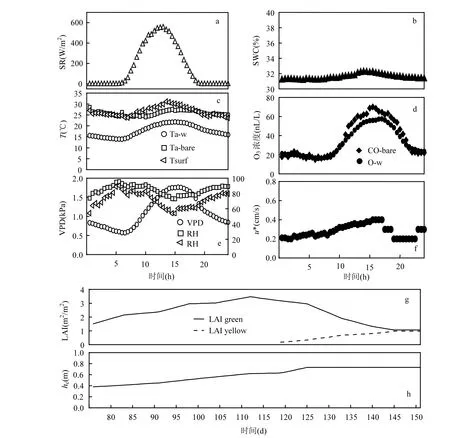
图1 观测期间气象条件、O3浓度的小时变化及生物要素的逐日变化Fig.1 Diurnal and time series variations of meteorological conditions, ozone concentration and crop phenology
图1g,1h是冬小麦叶面积指数(LAI)和株高(hc)的时间序列变化图.图1g中,冬小麦绿叶叶面积指数(LAIgreen)迅速增长,在110d左右达到最大值3.5m2/m2后逐渐减小至1.1m2/m-2;冬小麦黄叶叶面积指数(LAIyellow)从120d左右逐渐增大至0.97m2/m-2.图1h中,冬小麦hc逐渐增大,在12 5d左右达到最大值(0.73m)后并维持在该高度.
2.2 Surfatm-O3模型不同阻力的参数化修订
2.2.1 气孔阻力Rsleaf—Javis气孔导度模型 根据SC-1稳态气孔导度仪观测的冬小麦拔节期-蜡熟期旗叶气孔导度数据对Javis气孔导度模型进行参数化拟合(图2和表1).观测期间最大气孔导度Gmax为280mmolO3/(m2·s),最小气孔导度是最大气孔导度的10%,因此Gmin= 0.1.图2是环境因子(PAR、Ta-w、VPD和SWC)对气孔导度限制作用的边界线分析.从图2a可以看出,冬小麦气孔导度随着光照强度的增加迅速上升,具有较为典型的光饱和响应变化趋势,在PAR = 600mol/(m2·s)左右时气孔导度到达最大.图2b中冬小麦气孔导度与Ta-w的响应曲线为“钟形”趋势,在Ta-w= 25℃时气孔导度达到最大,其中冬小麦气孔运动的生理最低和最高温度分别为18℃和33℃.图2c中冬小麦气孔导度在VPD低值时完全开放,当VPD = 2.2kPa时,气孔导度线性下降,当VPD > 3.2kPa时,气孔基本关闭.图2d中,冬小麦气孔导度随SWC的增大而迅速线性上升,当SWC > 35%,气孔持续维持最大开度.Javis气孔导度限制因子的公式和参数取值详见表1.

图2 环境因子对气孔导度限制作用的边界线分析Fig.2 Boundary-line analysis of the relationship between relative stomatal conductance and variables
2.2.2 裸土期Rsoil早期的O3干沉降模型一般将引入的土壤阻力设置为常数,仅有较少的研究对土壤阻力建立参数化方案,且这些研究主要集中认为SWC是影响土壤阻力的驱动因子[47],而Stella等[48]在裸土期O3干沉降过程的研究结果提出相比于SWC,空气相对湿度(RH)才是影响Rsoil最为重要的因子,其中表面相对湿度(RHsurf)比空气相对湿度对Rsoil的影响更大.本文利用该研究结果,分别对裸土期Rsoil-bare与RHbare、RHsurf做相关性进行分析(图3).由图3可见,Rsoil-bare随RHbare和RHsurf均呈指数上升趋势,且Rsoil-bare与RHsurf的相关性更为显著(R2= 0.65),这与Stella[48]等的研究结果一致.综上,选择了RHsurf作为Rsoil-bare的主要影响因子进行参数化修订,则拟合结果为:Rsoilmin= 78.48,ksoil= 0.023,并将该拟合结果应用到冬小麦覆盖期Rsoil的计算.
2.2.3 表面阻力Rcut为了确定公式(17)中参数Racmax和Rcutmin的取值,分析了冬小麦覆盖期RH< 60%的条件下非气孔阻力实测值(Gnsm)与u*的关系(图4a),并基于该公式对其进行了拟合.这里的Rsoil是根据公式(17)拟合得到的平均Rsoil值(240s/m),Racmax和Rcutmin的最终的拟合结果分别为25和280s/m. Racmax是参数b和LAI与hc的乘积,由于冬小麦覆盖期平均LAI和hc分别为2.65m2/m2和0.6m,因此计算得到b的取值为15.7m-1,这个结果与Lamaud等[34]研究玉米田O3干沉降过程(b =12.3m-1)和van Pul等[46]的结果(b=14m-1)相似,但Racmax的值比Laumand等[34]的结果小约7倍,这主要是冬小麦的LAI和hc与玉米之间存在很大差距,这表明Rac与植物的结构密切相关;通过对比玉米田研究获得的Racmax/(Rsoil⋅u*)比值结果(2.5),比本文冬小麦田(0.4)大很多,可见在RH<60%的情况下冬小麦田的土壤沉降量要比玉米田的小很多.Massman[49]对公式(19)中Rcutmax参数修订中提出Rcutmax= A/LAI的公式(其中A取值为5000),认为Rcutmax仅与植物的LAI相关,并没有考虑u*的影响.在这里对两个公式计算的值进行一个对比,本文中平均u*为0.28m/s,通过公式(19)得到平均Rcutmax为1000s/m;利用Massman[49]的公式得到的Rcutmax为1886s/m(5000/2.65),可看出两者的结果还是比较接近的,但前者的Rcutmax不仅考虑了植物的LAI,还同时考虑了u*的影响.

表1 Javis气孔导度模型限制函数和其参数取值Table 1 Parameterisations used in the Javis-tpye stomatal conductance model
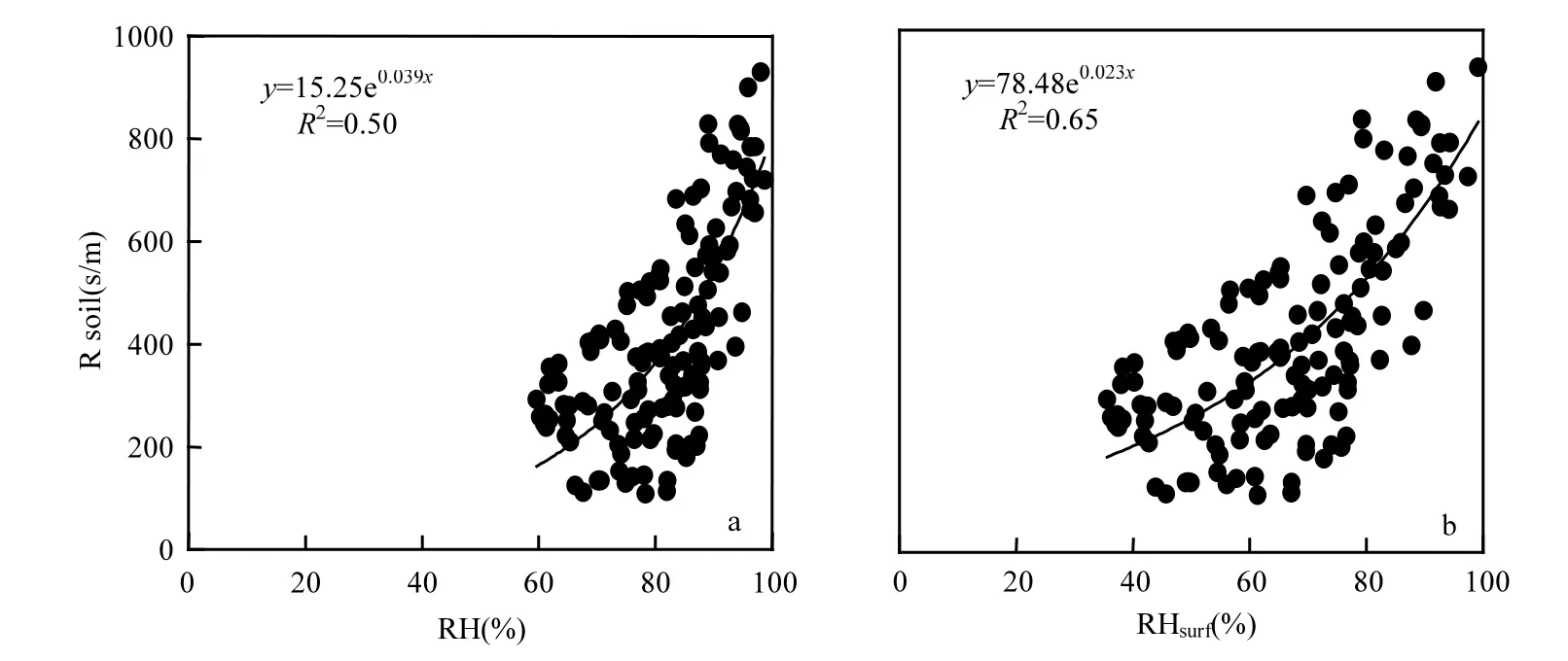
图3 裸土期Rsoil-bare/RHbare和RHsurf的相关关系Fig.3 The relationship between Rsoil-bare/RHbare and RHsurf during the bare-soil periods
为了确定公式中kcut的取值,分析了公式(18)中Rcutmin⋅Gcut/u*与RH的关系(图4b),从图4b可以看出,它们之间呈指数增长趋势,通过拟合得到kcut= 0.047.该拟合值与Laumand等[34]和Stellar等[29]的结果相似.
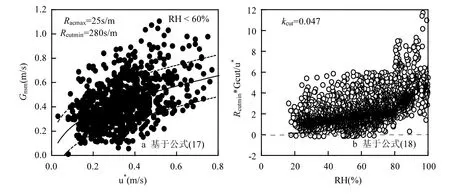
图4 基于公式(17)~(18)对表面阻力参数的拟合Fig.4 The fitting parameters of culticular resistance based on formula (17)~(18)
2.3 Surfatm-O3模型的验证
图5是冬小麦覆盖期实测Vd和模拟Vd的逐日变化对比.从图5可以看出,模拟Vd与实测Vd之间有较好的一致性,平均实测和模拟Vd值分别为0.39和0.37cm/s,模拟值比实测值低估5.3%.图6a是冬小麦覆盖期总O3通量实测值(FO-w,即实测Vd⋅CO-w)和模拟FO-w的1:1散点图,通过双样本t检验分析,实测和模拟FO-w之间不存在显著差异(P < 0.01),决定系数R2为0.65,斜率为0.837.尽管Vd和FO-w的模拟结果较好,但是针对不同通道的O3干沉降彼此之间会存在一定的相互补偿和抵消,所以有必要对每一个阻力参数进行逐一的验证.
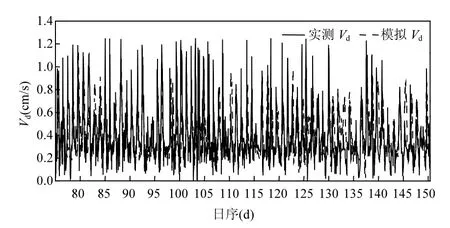
图5 冬小麦覆盖期实测Vd和模拟Vd的逐日变化对比Fig.5 Time series variations of measured Vd and modelled Vd in winter wheat field
为了验证Rsoil的模拟效果,对裸土期的总O3通量实测值(FO-bare,即土壤O3沉降通量 =Rsoil-bare⋅CO-bare)和模拟FO-bare进行了比较(图6b).从图6b中发现裸土期的实测FO-b和模拟FO-bare模拟结果较好(R2= 0.77),斜率为0.827.由此间接可以证明利用裸土期的土壤阻力参数的修订应用于冬小麦覆盖期Rsoil的运用是有效可靠的.
为了验证Rsleaf的模拟结果,对Javis气孔导度模型模拟的绿叶气孔导度()和彭曼公式结合GPP计算的实测Gsm的逐日变化进行了比较(图7).从图7可以看出,与实测Gsm相比,在75~95d和135~150d模拟值略有低估,而95~135d模拟值略有高估.模拟值低估的原因可能是因为Gst1的推演估算中由于土壤蒸腾作用就存在一些误差,而模拟值高估的原因可能是由于95~135d处于冬小麦生理活跃期(抽穗-扬花期),较大的LAIgreen导致较小的Rsgreen,从而使Gsgreen较大.
目前Rcut值的获取仍没有直接的观测手段,所以本研究无法给出Rcut的模拟验证结果.但是通过对Rsoil和Rsleaf的较好验证,并结合模拟模拟的结果与实测模拟的良好一致性,从而推断出Rcut的模拟结果也同样在可以接受的范围之内.
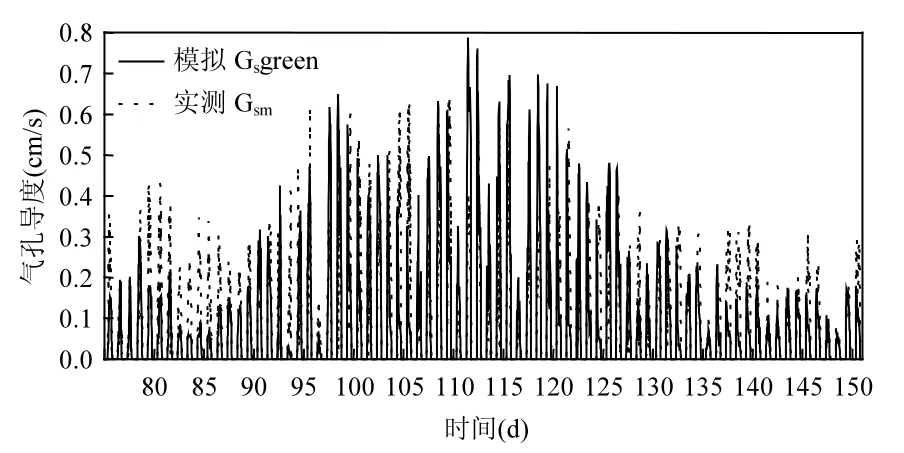
图7 绿叶气孔导度()模拟值和实测Gsm的逐日变化Fig.7 Time series variations of measured (Gsm) and modelled stomatal conductance () for green leaf
2.4 不同沉降通道的分配比例
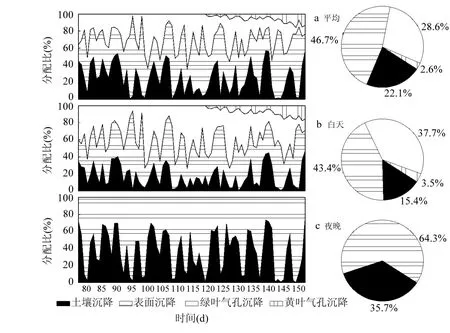
图8 平均(a)、白天(b)和夜晚(c)的表面、土壤、绿叶气孔、黄叶气孔沉降通道分配比的变化Fig.8 Mean (a), daily (b), and nocturnal (c) relative contributions of cuticular, soil, stomatal for green leaves, and stomatal for yellow leaves
图8分别是平均、白天和夜晚表面、土壤、绿叶气孔、黄叶气孔沉降通量所占总O3通量分配比例的变化图.从图8a可以看出,非气孔沉降(表面沉降和土壤沉降)是O3干沉降主要的沉降通道,占总O3通量的68.8%.在非气孔沉降中,平均表面沉降所占比例较高,占平均非气孔沉降量的46.7%,这可能是因为观测期间正处于冬小麦主要生长期(拔节-扬花期),LAI不断增长,一方面会使Rac增加,导致土壤沉降减少;另一方面会使Rcut减小,从而增大表面沉降.平均绿叶气孔沉降量占总O3通量的28.6%.在100~130d天绿叶气孔沉降较大,说明绿叶气孔沉降与冬小麦的生长旺盛期密切相关.平均黄叶气孔沉降量随着冬小麦绿叶的衰老而逐渐增大,占总O3通量的2.6%.
从图8b可以看出,白天绿叶和黄叶的气孔沉降比例较图8a相比比值增大,相反非气孔沉降比例减小至58.8%,其中白天绿叶和黄叶气孔沉降分别占总O3通量的37.7%和3.5%.这主要是因为白天植物的气孔沉降与其气孔开度密切相关,植物的光合作用使得气孔张开,同时也使O3进入到气孔,增加了气孔沉降.从夜间图可以看出,夜间由于植物气孔的关闭,非气孔沉降成唯一的沉降通道,其中表面沉降是主要的非气孔沉降通道,占64.3%.这可能是因为夜间的相对湿度较高,一方面增加了表面沉降,另一方面使土壤沉降减小[33-34].对比其他陆地生态系统的研究结果,Stella等[29]在玉米田研究中发现在玉米成熟期平均非气孔沉降可占总O3沉降的70%~80%; Fares等[50]在森林研究中得到非气孔沉降随季节变化所占比例可由33%~50%增加到65%; Gerosa等[51-52]在森林研究中也指出非气孔沉降可占O3干沉降的70%;大量研究指出在干植物冠层白天非气孔O3沉降量占总O3通量的30%~70%[53-54],气孔沉降通道占30%左右[55-57].
2.5 NO与O3的化学反应
冬小麦覆盖期和裸土期Vd实测值和模拟值之间虽然趋势相同, 模拟效果较好,但是两者相比均存在模拟值低估的现象.有研究指出土壤中排放的NO会增加O3干沉降速率[48,58],也有研究指出植物自身释放的BVOC也会与O3发生化学反应,从而影响O3的干沉降过程[54,59-60];这些化学反应也是O3干沉降的另一条沉降通道.为了解NO与O3的化学反应对O3干沉降过程的影响,利用裸土期监测的大气中的NO浓度和土壤排放的NO通量(FNO)的数据(数据未发表)与裸土期实测和模拟Vd之间的差值进行对比分析(图9).如图9所示实测和模拟Vd之间的差值与大气中的NO浓度并没有什么相关性(R2=0.004),而随FNO的增加而增加(R2=0.48),且当FNO>0.18nmol/(m2·s)时,模拟Vd明显小于实测Vd.由此可见大气中的NO并未对O3干沉降过程产生影响,而土壤排放的NO确实会影响O3干沉降过程.
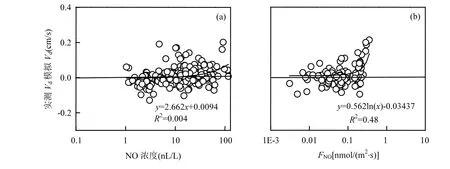
图9 裸土期实测与模拟Vd的差值与大气中的NO浓度(a)和土壤排放的FNO(b)的关系Fig.9 Difference between measured and modelled Vd as a function of air NO concentration (a) and soil NO flux FNO (b)
3 讨论
3.1 Surfatm-O3干沉降模型的敏感性分析
本研究选择了Surfatm-O3干沉降模型中各阻力参数中的Gmax、ksoil、Rsoilmin、kcut和Rcut对该模型进行敏感性分析.由于夜间的u*数据较小,因此这里主要对白天的情况进行分析,为了区分不同气象条件下各阻力参数对O3干沉降过程的影响,这里考虑了晴朗白天和阴天白天两种情况,主要通过SR、T和RH的变化进行区分,这里将晴朗白天定义为SR > 400W/m2,T > 20℃且60%< RH < 70%,将阴天白天定义为0 < SR <400W/m2,T < 15℃且RH > 80%.此外,为了进一步了解冬小麦处于不同生育期对O3干沉降过程的影响,这里还选择了其3个生育期,主要通过不同株高(hc)和叶面积指数(LAI)来区分,分别对应裸土期(hc=0& LAI=0)、生长旺盛期(hc=0.5m&LAI=2m2/m2)和成熟期(hc=1m & LAI=4m2/m2).具体分类见表2,其中参考值是指以本研究冬小麦的hc和LAI的平均值计算得到的总O3通量.
土壤阻力参数的敏感性与植物冠层结构密切相关,土壤阻力会随植物冠层的发展而减小,而气孔和表面阻力则随之增加.主要是因为气孔和表面O3沉降通道对总O3通量的贡献随作物的LAI增加而增加,而表面沉降通道贡献率的增加会使冠层内空气动力学阻力(Rac)增加,从而导致土壤沉降通道贡献率的降低.
目前气象条件对该模型阻力参数的影响并不是非常明确.因此选择了两种不同气象条件对模型阻力参数进行敏感性分析:晴朗白天和阴天白天.气象条件的变化不仅仅会带来气孔、土壤和表面阻力参数的改变,同时也会造成其他阻力参数(例如空气动力学阻力、边界层阻力和冠层内空气学阻力)的变化,但这里主要考虑了气孔、土壤和表面阻力参数所带来的影响.从表2可以看出,相比晴朗白天,总体而言,气孔、表面和土壤阻力参数均在阴天白天表现的敏感性更高.
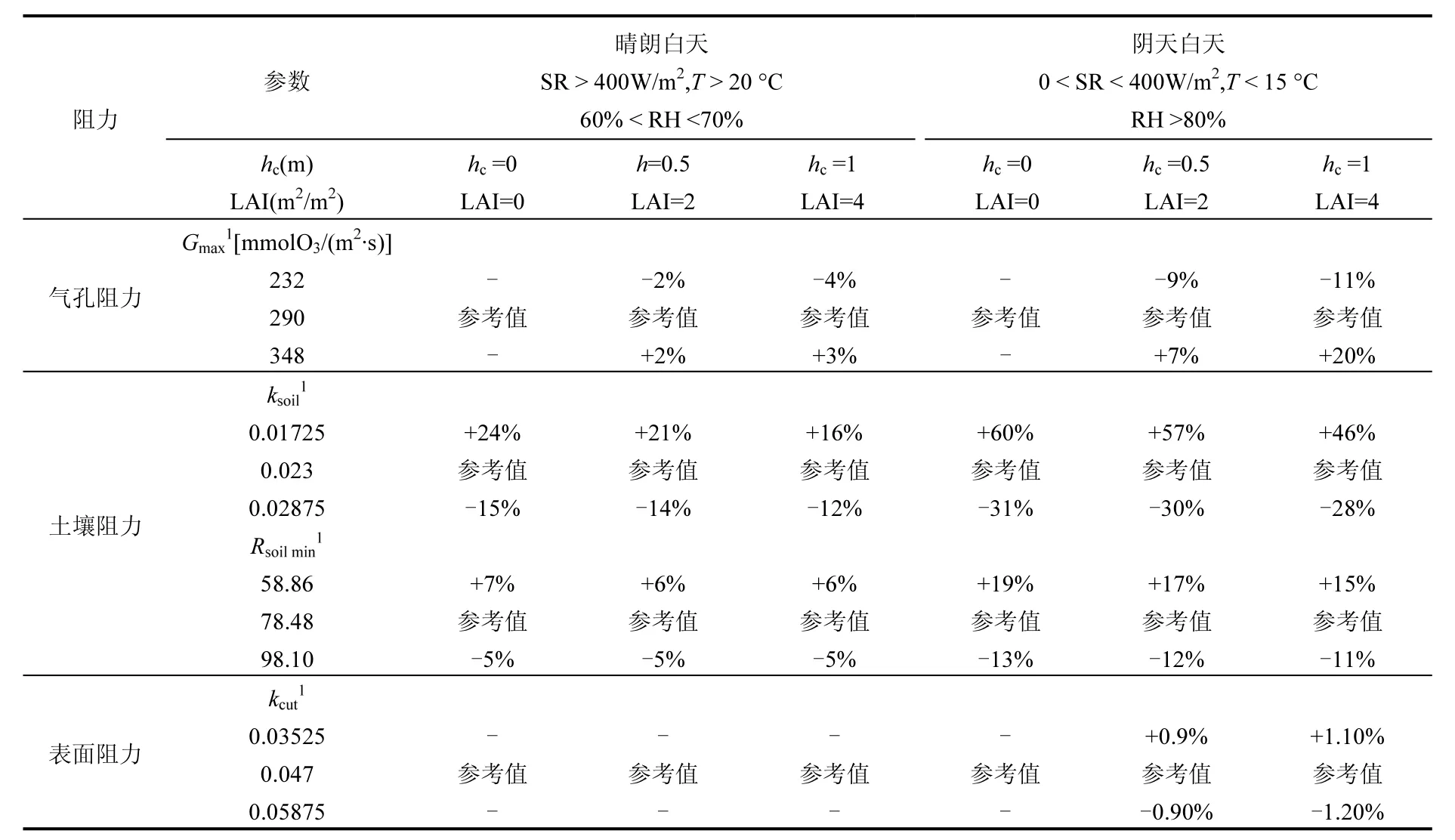
表2 Surfatm-O3干沉降模型各阻力参数对总O3通量模拟值的敏感性分析Table 2 Response of modelled total ozone flux to parameters of ozone deposition resistances
对于气孔阻力来说,在不同生育期,与参考值相比,±25%的Gmax变化最大导致了模拟总O3通量+20%的变化;Gmax在阴天白天的影响比晴天白天大很多.Gmax随hc和LAI的增大,与参考值相差越大,在成熟期的影响最大.然而,这里仅考虑了Gmax这一个参数的变化对该模型造成的影响,而Javis气孔导度模型中的其他参数变化也会导致模拟总O3通量不同程度的变化.对土壤阻力来说,裸土期时期(hc=0,LAI=0),ksoil非常敏感,与参考值相比,±25%的ksoil变化导致了模拟总O3通量晴天白天最大+24%的变化,而导致阴天白天总O3通量最大高达+60%的变化.ksoil随hc和LAI的增大,与参考值相差越小,在成熟期影响最小.Rsoilmin的敏感程度相比ksoil则小的多,±25%的Rsoilmin的变化导致晴天白天总O3通量最大+7%的变化,导致阴天白天最大+19%的变化.与ksoil一致,Rsoilmin也随hc和LAI的增大,与参考值相差越小,在成熟期影响最小.当ksoil和Rsoilmin减小时,模拟的总O3通量增加.对于表面阻力来说,在不同生育期,kcut白天的敏感性均较低,与参考值相比,无论晴天还是阴天±25%的kcut变化对模拟的总O3通量几乎没有影响,且hc与LAI的变化对其影响也较小.
对于以上敏感性分析结果发现白天每个参数的变化均会对该模型模拟的总O3通量带来较大的偏差,不仅依赖于气象因子的变化,而且也随作物不同生育期冠层结构变化而变化;其中在白天气象因子对模拟总O3通量的影响要大于作物生育期的改变.因此无论是气象条件的变化或者是作物冠层结构的变化,该O3干沉降模型对于O3干沉降量的模拟均有很强的适应性.对比其他研究结果,Stella等[29]利用Surfatm-O3模型研究玉米田时发现土壤阻力在裸土期和作物生长早期的敏感性较高;当作物冠层完全发展后表面和气孔阻力会对O3干沉降过程带来很大的影响;Massman[49]指出在晴朗的夜晚Rcutmax的改变会导致总O3通量+65%的变化;Lamaud等[34]指出kcut的敏感性较低,会引起模拟总O3通量小于1%~34%的改变.
3.2 NO与O3的化学反应
为了进一步分析NO对裸土期Vd的影响,分别计算了从观测高度到地面之间的大气中NO与O3的化学反应时间(tchem)和气体分子传输时间(ttrans),并对其进行了分析,其中tchem和ttrans的公式如下:
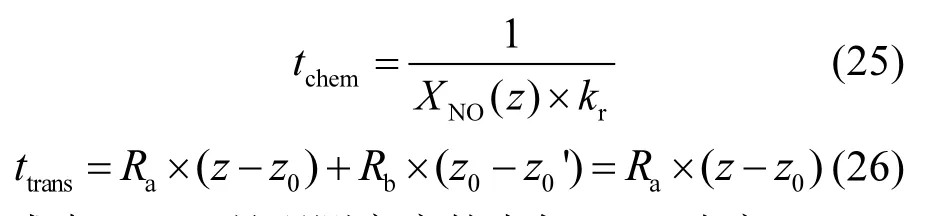
式中:XNO(z)是观测高度的大气NO浓度,nL/L;kr是反应速率,由裸土期空气温度决定,kr=0.0444exp(-1370/Ta-bare+273.15)[61-62];z是观测高度,m;z0是地面高度,m.
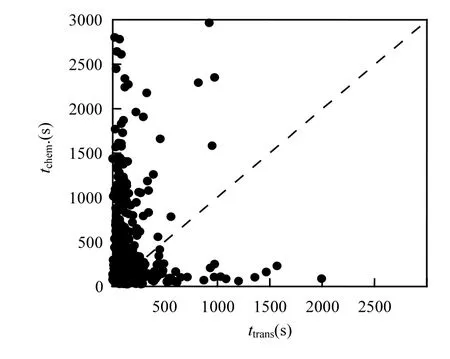
图10 裸土期大气中NO与O3的化学反应时间(tchem)与气体分子传输时间(ttrans)的相关关系Fig.10 Time of chemical depletion of O3 by NO (tchem)versus time of diffusive transport (ttrans) in bare-soil field
图10为裸土期tchem与ttrans的相关关系.从图10可以看出,大多数ttrans的值较小,比tchem小近10倍,这说明大气中NO在传输过程中来不及与O3进行化学反应,从而间接表明与O3发生化学反应的是来自于土壤排放的NO.但从图10也发现,少数ttrans的值较大,而tchem的值较小,可能是因为此时大气中的NO浓度很高,而此时u*较小,造成ttrans较大,从而使得大气中的NO在传输过程中可能存在少量的NO与O3进行化学反应的过程,但大多数化学反应是与土壤排放的NO.结合图9可表明大气中NO对裸土期的Vd变化的影响甚微,推断其对O3干沉降过程几乎没有影响;而土壤排放的NO与O3的化学反应会影响O3干沉降过程,成为O3干沉降的另一条通道.因此在O3干沉降模型研究中需要考虑土壤排放的NO与O3的化学反应对其产生的影响和该过程所占O3干沉降的分配比例,这些也将是我们下一步亟待开展的工作.
4 结论
4.1 冬小麦田总O3通量和沉降速率的模拟值和实测值趋势相似,平均模拟和实测Vd值分别为0.37和0.39cm/s,模拟值比实测值低估5.3%;模型中每一个独立阻力公式的模拟效果均较好.
4.2 平均非气孔沉降(表面沉降和土壤沉降)是O3干沉降的主要沉降通道,占总O3沉降量的68.8%.在非气孔沉降中,表面沉降占非气孔沉降量的46.7%;平均绿叶和黄叶气孔沉降量分别占总O3通量的28.6%和2.6%.白天非气孔沉降比例减小,气孔沉降比例增大.夜晚表面沉降和土壤沉降分别占总O3通量的64.3%和35.7%.
4.3 大气中NO对O3干沉降过程影响甚微,而土壤排放的NO会影响该过程,表明土壤排放的NO和O3的化学反应是O3干沉降的另一条通道.因此O3干沉降模型中需要考虑土壤排放的NO与O3进行的化学反应对其产生的影响.
[1] Vingarzan R. A review of surface ozone background levels and trends [J]. Atmospheric Environment, 2004,38:3431-3442.
[2] Meehl G A, Stocker T F, Collins W D, et al. Global climate projections, in: Climate Change 2007: The Physical Basis, edited by: Solomon S, Qin D, Manning M, Chen Z, et al. Contribution of Working Group I to Fourth Assessment Report of IPCC on Climate Change [R]. Cambridge University Press, Cambridge,UK/NY, USA.2007.
[3] Forster P, Ramaswamy V, Artaxo, P, B et al. Changes in Atmospheric Constituents and in Radiative Forcing, in: Climate Change 2007: The Physical Basis, edited by: Solomon S, Qin D,Manning M, Chen Z, et al. Contribution of Working Group I to Fourth Assessment Report of IPCC on Climate Change [R]Cambridge University Press, Cambridge, UK/NY, USA. 2007.
[4] Almeida E, Marracos M, Morcillo M, et al. Atmospheric corrosion of mild steel, Part I — Rural and urban atmosphere [J].Materials & Corrosion, 2000,51:859-864.
[5] Boyce A, Nord A G, Tronner K. Atmospheric bronze and copper corrosion as an environmental indicator [J]. Water, Air & Soil Pollution, 2001,127:193-205.
[6] Targer I B, Balmes J, Lurmann F, et al. Chronic exposure to ambient ozone and lung function in young adults [J].Epidemiology, 2005,16:751-759.
[7] 廖志恒,范绍佳.2006~2012年珠江三角洲地区O3污染对人群健康的影响 [J]. 中国环境科学, 2015,35(3):897-905.
[8] Ainsworth E A. Rice production in a changing climate: a met analysis of responses to elevated carbon dioxide an elevated ozone concentration [J]. Global Change Biology, 2008,14:1642-1650.
[9] Wittig V E, Ainsworth E A, Naidu S L, et al. Quantifying the impact of current and future tropospheric ozone on tree biomass,growth, physiology and biochemistry: a quantitative metaanalysis. Global Change Biology, 2009,15:396-424.
[10] 金明红,冯宗炜.臭氧对冬小麦叶片膜保护系统的影响 [J]. 生态学报, 2000,20:444-447.
[11] 郑启伟,王效科,冯兆忠,等.用旋转布气法开顶式气室研究臭氧对水稻生物量和产量的影响 [J]. 环境科学, 2007,28:170-175.[12] 白月明,王春乙,郭建平,等.大气臭氧变化对油菜影响的模拟试验 [J]. 中国环境科学, 2007,23(4):407-411.
[13] 王兰兰,何兴元,陈 玮,等.大气中O3、CO2浓度升高对蒙古栎叶片生长的影响 [J]. 中国环境科学, 2011,31(2):340-345.
[14] 郑有飞,赵 泽,吴荣军,等.臭氧胁迫对冬小麦叶绿素荧光及气体交换的影响 [J]. 环境科学, 2010,31:472-479.
[15] 姚芳芳,王效科,陈 展,等.农田冬小麦生长和产量对臭氧动态暴露的响应 [J]. 植物生态学报, 2008,32:212-219.
[16] Mills G, Hayes F, Simpson D, et al. Evidence of widespread effects of ozone on crops and (semi-)natural vegetation in Europe(1990-2006) in relation to AOT40- and flux-based risk maps [J].Global Change Biology, 2011,17:592-613.
[17] Payne R J, Stevens C J, Dise N B, et al. Impacts of atmospheric pollution on the plant communities of British acid grasslands [J].Environmental Pollution, 2011,159:2602-2608.
[18] Vandermeiren K, De Bock M, Horemans N, et al. Ozone effects on yield quality of spring oilseed rape and broccoli [J].Atmospheric Environment, 2012,47:76-83.
[19] Feng Z Z, Sun J S, Wan W X, et al. Evidence of widespread ozone-induced visible injury on plants in Beijing, China [J].Environmental pollution, 2014,193:296-301.
[20] Ashmore M, Toet S, Emberson L. Ozone - a significant threat to future world food production [J]. New Phytologist, 2006,170:201-204.
[21] Avnery S, Mauzerall D L, Liu J F, et al. Global crop yield reductions due to surface ozone exposure: 1. Year 2000 crop production losses and economic damage [J]. Atmospheric Environment, 2011,45:2284-2296.
[22] Avnery S, Mauzerall D L, Liu J F, et al. Global crop yield reductions due to surface ozone exposure: 2. Year 2030 potential crop production losses and economic damage under two scenarios of O3pollution [J]. Atmospheric Environment, 2011,45:2297-2309.
[23] Felzer B S, Cronin T, Reilly J M, et al. Impacts of ozone on trees and crops [J]. Comptes Rendus - Géoscience, 2007,339:784-798.
[24] Sitch S, Cox P M, Collins W J, et al. Indirect radiative forcing of climate change through ozone effects on the land-carbon sink [J].Nature, 2007,448:791-795.
[25] Fowler D, Pilegaard K, Sutton M A, et al. Atmospheric composition change: Ecosystems-Atmosphere interactions [J].Atmospheric Environment, 2009,43:5193-5267.
[26] Nikolov N, Zeller K F. Modeling coupled interactions of carbon,water, and ozone exchange between terrestrial ecosystems and the atmosphere. I: Model description [J]. Environmental Pollution,2003,124:231-246.
[27] Zhang L, Brook J R, Vet R. A revised parameterization for gaseous dry deposition in air-quality models [J]. Atmospheric Chemistry and Physics, 2003,3:2067-2082.
[28] Bassin S, Calanca P, Weidinger T, et al. Modeling seasonal ozone fluxes to grassland and wheat: Model improvement, testing, and application [J]. Atmospheric Environment, 2004,38:2349-2359.
[29] Stella P, Personne E, Loubet B, et al. Predicting and partitioning ozone fluxes to maize crops from sowing to harvest: the Surfatm-O3model [J]. Biogeosciences, 2011,8:2869-2886.
[30] Rannik Ü, Altimir N, Mammarella I, et al. Ozone deposition into a boreal forest over a decade of observations: evaluating deposition partitioning and driving variables [J]. Atmospheric Chemistry and Physics, 2012,12:12715-12758.
[31] Wesely M L. Parameterization of surface resistance to gaseous dry deposition in regional-scale numerical models [J].Atmospheric Environment, 1989,23:1293-1304.
[32] Wesely M L, Hicks B B. A review of the current status of knowledge on dry deposition [J]. Atmospheric Environment,2000,34:2261-2282.
[33] Zhang L M, Brook J R, Vet R. On ozone dry deposition-with emphasis on non-stomatal uptake and wet canopies [J].Atmospheric Environment, 2002,36:4787-4799.
[34] Tuzet A, Perrier A, Loubet B, et al. Modelling ozone deposition fluxes: The relative roles of deposition and detoxification processes [J]. Agricultural and Forest Meteorology, 2011,151:480-492.
[35] Fares S, Matteucci G, Scarascia Mugnozza G, et al. Testing of models of stomatal ozone fluxes with field measurements in a mixed Mediterranean forest [J]. Atmospheric Environment, 2013,67:242-251.
[36] 段文军,王 成,张 昶,等.深圳夏季3种生境城市森林内臭氧浓度变化规律 [J]. 中国环境科学, 2017,37(6):2064-2071.
[37] 李 硕,郑有飞,吴荣军,等.冬麦田臭氧干沉降过程的观测 [J].应用生态学报, 2016,27:1811-1819.
[38] 潘小乐,王自发,王喜全,等.秋季在北京城郊草地下垫面上的一次O3干沉降观测试验 [J]. 大气科学, 2010,34:120-130.
[39] 朱治林,孙晓敏,董云社,等.鲁西北平原玉米地涡度相关O3通量日变化特征 [J]. 中国科学:地球科学, 2014,44:292-301.
[40] 国家气象局.农业气象观测规范(上卷) [S]. 气象出版社.北京:1993.
[41] Personne E, Loubet B, Herrmann B, et al. SURFATMNH3: a model combining the surface energy balance and bidirectional exchanges of ammonia applied at the field scale [J].Biogeosciences, 2009,6:1371-1388.
[42] Emberson L D, Simpson D, Tuovinen J P, et al. Towards a model of ozone deposition and stomatal uptake over Europe [D]. EMEP/MSC-W Note 6/2000, Norwegian Meteorological Institute, Oslo,available at: www. emep.int/reports/dnmi note 6 2000.pdf. 2000.
[43] Tuovinen J P, Ashmore M R, Emberson L D, et al. Testing and improving the EMEP ozone deposition module [J]. Atmospheric Environment, 2004,38:2373-2385.
[44] Jones H G. Plants and Microclimate: A quantitative approach to environmental plant physiology [D]. 2nd Edn., Cambridge University Press, Cambridge, UK. 1992.
[45] Baldocchi D D, Meyers T P. Trace gas exchange above the floor of a deciduous forest. 1. Evaporation and CO2efflux [J]. Journal of Geophysical Research, 1991,96:7271-7285.
[46] van Pul W A J, Jacobs A F G. The conductance of a maize crop and the underlying soil to ozone under various environmental conditions [J]. Boundary-Layer Meteorology, 1994,69:83-99.
[47] Mészáros R, Zsély I G, Szinyei D, et al. Sensitivity analysis of an ozone deposition model [J]. Atmospheric Environment, 2009,43:663-672.
[48] Stella P, Loubet B, Lamaud E, et al. Ozone deposition onto bare soil: A new parameterisation [J]. Agricultural and Forest Meteorology, 2011,151:669-681.
[49] Massman W J. Toward an ozone standard to protect vegetation based on effective dose: a review of deposition resistances and possible metric [J]. Atmospheric Environment, 2004,38:2323-2337.
[50] Fares S, McKay M, Holzinger R, Goldstein A H. Ozone fluxes in a Pinus ponderosa ecosystem are dominated by non-stomatal processes: evidence from long-term continuous measurements [J].Agricultural and Forest Meteorology, 2010,150:420-431.
[51] Gerosa G, Vitale M, Finco A, et al. Ozone uptake by an evergreen Mediterranean Forest (Quercusilex) in Italy. Part I:Micrometeorological flux measurements and flux partitioning [J].Atmospheric Environment, 2005,39:3255-3266.
[52] Gerosa G, Finco A, Mereu S, et al. Comparison of seasonal variations of ozone exposure and fluxes in a Mediterranean Holm oak forest between the exceptionally dry 2003 and the following year [J]. Environment Pollution, 2009,157:1737-1744.
[53] Altimir N, Kolari P, Tuovinen J P, et al. Foliage surface ozone deposition: a role for surface moisture [J]. Biogeosciences, 2006,2:209-228.
[54] Fares S, Robin W, Park J H, et al. Ozone deposition to an orange orchard: Partitioning between stomatal and non-stomatal sinks [J].Environmental Pollution, 2012,169:258-266.
[55] Vitale M, Gerosa G, Ballarin-Denti A, et al. Ozone uptake by an evergreen Mediterranean forest (Quercus ilex L.) in Italy — Part II:flux modelling. Upscaling leaf to canopy ozone uptake by a process-based model [J]. Atmospheric Environment, 2005,39:3267-3278.
[56] Hogg A, Uddling J, Ellsworth D, et al. Stomatal and nonstomatal fluxes of ozone to a northern mixed hardwood forest [J].Tellus Series B - Chemical and Physical Meteorology, 2007,59:514-525.
[57] Morani A, Nowak D, Hirabayashi S, et al. Comparing i-Tree modeled ozone deposition with field measurements in a periurban Mediterranean forest [J]. Environmental Pollution, 2014,195:202-209.
[58] Nemitz E, Sutton M A, Wyers G P, et al. Surface/atmosphere exchange and chemical interaction of gases and aerosols over oilseed rape [J]. Agricultural and Forest Meteorology, 2000,105:427-445.
[59] Kurpius M R, Goldstein A H. Gas-phase chemistry dominates O3loss to a forest, implying a source of aerosols and hydroxyl radicals to the atmosphere [J]. Geophysical Research Letters,2003,30:doi:10.1029/2002GLO16785.
[60] Steinkamp J, Lawrence M G. Improvement and evaluation of simulated global biogenic soil NO emissions in an AC-GCM [J].Atmospheric Chemistry and Physics, 2011,11:6063-6082.
[61] Demore W B, Molina M J, Watson R T, et al. Chemical kinetics and photochemical data for use in stratospheric modelling [J].Evaluation, 1983,6:62-83.
[62] Walton S, Gallagher M W, Duyzer J. Use of a detailed model to study the exchange of NOxand O3above and below a deciduous canopy [J]. Atmospheric Environment, 1997,31:2915-293.
