Fe(II)活化O2高级氧化降解罗丹明B染料
2018-03-02张成武李天一廉静茹秦传玉吉林大学地下水资源与环境教育部重点实验室吉林长春130021吉林大学环境与资源学院吉林长春130021
张成武,李天一,廉静茹,郭 超,秦传玉* (1.吉林大学地下水资源与环境教育部重点实验室,吉林长春 130021;2.吉林大学环境与资源学院,吉林 长春 130021)
近年来随着印染工业的发展,大量印染废水被排入环境中,此类废水具有高色度、难降解、生物毒性大等特点,传统的废水处理技术很难高效降解印染废水.而高级氧化技术(AOPs)因其强氧化性、处理速率快、效率高等优点受到广泛关注.高级氧化技术是指利用反应中生成的具有强氧化性的自由基将有机污染物矿化分解成小分子物质的氧化方法[1-2].传统Fenton试剂是由溶液中的Fe2+与H2O2之间发生电子传递而产生大量羟基自由基,进而对有机污染物进行降解[3-4].但是H2O2化学性质不稳定易分解,导致其利用率低,需向反应体系中大量添加,而大量的H2O2还具有一定的生物毒性和环境副作用,上述这些问题都对其高效应用产生一定的限制.因此开发绿色经济的高级氧化体系降解废水中有毒有害污染物是当务之急.氧气是环境中广泛存在的绿色氧化剂,廉价易得.Sedlak课题组和Hug课题组均提出二价铁在与氧气反应过程中会产生活性自由基[5-7],但该体系反应条件较为苛刻,并且其生成活性自由基量较少,无法应用于实际污水处理过程.
在上述体系的基础上,学者们对提高羟基自由基产量进行大量研究,发现可以向体系中投加配合物,通过配体络合作用提高Fe(II)还原能力,加快电子传递速率,提高体系中活性自由基产率[8-9].通过研究对比了草酸[10]、EDTA[10]、维生素C[11]、多聚磷酸盐[12-13]等配合物对Fe(II)/O2体系的影响,发现上述几种配合物都会提高Fe(II)与O2反应产生活性自由基的量,并使反应可以在中性条件下发生.但是过量的有机配合物会消耗产生的活性自由基,其浓度需严格控制.而无机配合物多聚磷酸盐因不会消耗反应中产生的活性自由基,更有利于体系中污染物的降解.
三聚磷酸钠(STPP)是日常生活中常见的一种多聚磷酸盐,多用于食品改良及pH值调节等.其本身无毒,价格低廉,对环境副作用小[14].因此,从反应高效性及绿色环保方向考虑,选取STPP作为Fe(II)/O2体系的理想配体,构建Fe(II)/O2/STPP体系.该体系在废水处理中具有较好的应用前景,目前这方面的研究较少,特别是有关其对染料污染物的降解效果及相关影响因素的研究还鲜有报道.罗丹明B(RhB)是一种常见的人工合成染料,具有“三致”效应.本研究采用罗丹明B为目标污染物,对比研究不同pH值、曝气量、金属阳离子等因素对体系降解能力的影响,并通过自由基掩蔽实验研究该体系中活性自由基的种类及其对污染物降解的贡献配比.
1 材料与方法
1.1 试剂与仪器
试剂:罗丹明B(RhB,国药集团化学试剂有限公司,分析纯),STPP(Na5P3O10,国药集团化学试剂有限公司,分析纯),维生素C(C6H8O6,国药集团化学试剂有限公司,分析纯),对苯醌 (C6H4O2, 国药集团化学试剂有限公司,分析纯),硫酸亚铁铵((NH4)2Fe(SO4)2·6H2O,国药集团化学试剂有限公司,分析纯),乙二胺四乙酸二钠(C10H14O8N2Na2,EDTA,国药集团化学试剂有限公司,分析纯),无水乙醇(CH3CH2OH,北京化工厂,分析纯).
主要仪器:紫外可见分光光度计(EVOLUTION 220,美国热电(上海)科技仪器有限公司),pH计(YSI pH100,美国黄泉仪器有限公司),精密增力电动搅拌器(JJ-1,金坛市江南仪器厂)、数显恒温水浴锅(HH-1,金坛市江南仪器厂)
1.2 实验方法
实验在250mL顶空瓶中进行,取200mL质量浓度为10mg/L的罗丹明B溶液,再加入一定量的配合物,搅拌至完全溶解,用0.1mol/L的NaOH/H2SO4调节溶液至中性,向体系中以固定流量进行曝气并加入5mmol/L的硫酸亚铁铵使反应进行,开始计时,每隔4min取样分析,加入无水乙醇终止反应.每组设3个平行样取平均值,实验数据的标准误差不超过5%.
实验中所用溶液均为蒸馏水配制,如无特殊说明,体系内STPP浓度为20mmol/L,空气流量为150mL/min.
1.3 分析方法
罗丹明B测定方法为在553nm波长下,用紫外-可见分光光度计测定,通过标准曲线换算为浓度值,并根据式1计算其降解率
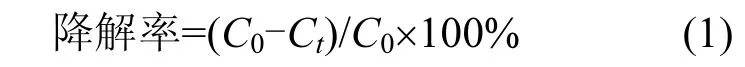
式中:C0为染料初始浓度,Ct为取样测定时的染料浓度.
体系中不同价态铁离子含量变化通过邻菲罗啉分光光度法测定[15]. Fe2+与邻菲罗啉可形成稳定的桔红色络合物,通过测定其在510nm处吸光度可换算出溶液中Fe2+浓度;测定总铁时,通过预先加入盐酸羟胺将体系中所有Fe3+还原为Fe2+;溶液中Fe3+的浓度通过式2计算得到.
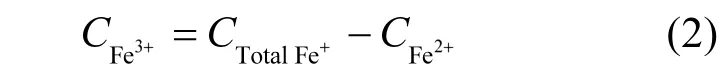
式中:CtotalFe为溶液中总铁浓度,CFe2+为溶液中Fe2+浓度,CFe3+为溶液中Fe3+浓度.
2 结果与讨论
2.1 配合物对罗丹明B降解效果的影响
实验选取几种目前研究较为常见的Fe(II)配合物,考察其对Fe(II)/O2体系降解污染物的影响.如图1所示,相对于对照组Fe(II)/O2,不同配合物的投加均有利于罗丹明B的降解.在20min内,Fe(II)/O2/Vc体系与Fe(II)/O2/EDTA体系对罗丹明B降解率在13%左右,Fe(II)/O2/STPP体系对污染物降解率达到80%.实验结果表明STPP对体系的促进效果明显优于Vc与EDTA.其可能原因是相比于Vc与EDTA,STPP的投加更加有效降低了Fe2+/Fe3+的氧化还原电位,使氧分子更容易单电子还原成O2˙-,促进体系中活性自由基的产生.

图1 不同配合物对Fe(II)/O2体系降解罗丹明B的影响Fig.1 Effect of different complexes on the degradation of rhodamine B by Fe (II)/O2 system
2.2 体系组分对罗丹明B降解效果的影响

图2 体系不同组分对罗丹明B降解的影响Fig.2 Effect of system composition on degradation of rhodamine B
实验考察了Fe(II)/O2/STPP体系中不同组分对罗丹明B降解的影响.从图2可以看出,短时间的单纯曝气并不会影响罗丹明B的浓度,对照组Fe(II)/O2、STPP/O2、Fe(II)/STPP/N23组体系随着曝气时间增加,罗丹明B几乎没有降解.但在Fe(II)/O2/STPP体系中罗丹明B降解率显著增加.这表明污染物的降解需要在Fe(II)、O2、STPP共存,体系所形成的Fe(II)-STPP配合物是反应进行的关键.
2.3 STPP浓度对罗丹明B降解效果的影响
考察不同STPP浓度对罗丹明B降解效果的影响,如图3所示,固定Fe(II)浓度,随着STPP投加量的增加,罗丹明B降解速率加快,但反应终点污染物降解效果相差不大,且降解过程均符合准一级动力学.这表明反应中投加的STPP为催化剂,其作用为加快反应速率.当STPP浓度从1:4增加到1:5,污染物降解曲线几乎完全重合,所以当体系中Fe(II):STPP=1:4时,反应速率最快,可以推断Fe(II) 与STPP形成的配合物为四配体络合物,并且还可以发现由于STPP为无机配合物,过量的投加并不会消耗体系中的活性自由基,更有利于其在实际处理中的应用.

图3 不同STPP浓度对罗丹明B降解的影响及其动力学拟合Fig.3 Effect of STPP concentrations on degradation of rhodamine B and its dynamic fit
2.4 初始pH值对罗丹明B降解效果的影响
图4为不同初始pH值对体系降解罗丹明B的影响.从图中看出,根据准一级动力学拟合得到pH值在5、7和9时罗丹明B的降解速率分别为0.0108min-1、0.1019min-1和0.0277min-1.显然,该体系在中性下降解罗丹明B的能力更强,这更有利于该体系在实际废水中的应用.在偏酸和偏碱条件下,污染物的降解效率均有所降低.其可能原因是碱性条件下降低了活性自由基氧化能力.而在酸性条件下,溶液pH值的降低会使投加的配合物逐步发生质子化,质子化后的配合物与Fe(II)形成的络合物十分稳定,不易失去电子,因此导致体系对罗丹明B降解能力下降[12].

图4 不同pH值对罗丹明B降解的影响及其动力学拟合Fig.4 Effect of pH values on degradation of rhodamine B and its dynamic fit
2.5 曝气量对罗丹明B降解效果的影响
考察该体系降解过程中对不同曝气量的要求.由图5可以看出,在密封条件下,罗丹明B在降解20%之后便不再变化,原因为溶液自身含有的溶解氧被耗尽,进一步说明了氧气为该反应发生的必要条件.通过向体系外加曝气发现,随着曝气量的增加,罗丹明B降解速率不断增加,曝气量大于150mL/min后,反应速率达到最大,此时氧气不再是反应的限制因素.

图5 不同曝气量对罗丹明B降解的影响Fig.5 Effect of aeration rateon degradation of rhodamine B
2.6 不同阳离子对罗丹明B降解效果的影响
通过在原有体系中投加CaCl2、MgCl2、FeCl3考察废水处理中常见的阳离子对体系降解罗丹明B的影响.如图6所示,相比于原有体系,Ca2+、Mg2+、Fe3+的投加降低了罗丹明B的降解速率,但没有对最终降解效果产生明显影响.产生这个结果的原因可能是Ca2+、Mg2+、Fe3+3种阳离子的加入会干扰Fe(II)与STPP的配位络合作用,降低污染物降解速率.

图6 不同金属离子对罗丹明B降解的影响Fig.6 Effect of metal ions on degradation of rhodamine B
2.7 Fe(II)/O2/STPP体系降解罗丹明B机理分析
2.7.1 体系降解污染物过程中铁离子价态变化 在实验过程中考察了罗丹明B降解过程中铁的不同价态的变化.由图7可以看出,反应开始之后溶液中的二价铁的含量快速降低,同时三价铁的含量迅速升高,并且在20min后,溶液中几乎不存在Fe(II).结合体系中罗丹明B的降解曲线,可以看到此时罗丹明B几乎不再降解,说明体系中活性自由基是由Fe(II)与氧气反应生成的.并且在整个反应体系中铁离子总量不变,这说明STPP加入可以避免铁在中性条件下的絮凝,这有利于其在实际废水中的应用.
2.7.2 不同掩蔽剂对体系降解罗丹明B的影响 Fe(II)与氧气反应产生的活性自由基以·OH和O2˙-为主,其主要理化性质如表1,为了考察这不同自由基对污染物降解的贡献配比,设计了自由基掩蔽实验,分别选取叔丁醇和对苯醌作为·OH和的猝灭剂[16-17].结果如图8所示,可以看到相对于Fe(II)/O2/STPP体系而言,两种掩蔽剂的加入对罗丹明B的降解均有抑制作用,说明罗丹明B的降解是两种自由基共同作用的结果.其中叔丁醇的加入极大抑制了罗丹明B的降解.这表明该体系中对污染物起主要作用的为·OH.·OH的强氧化性使染料分子显色基团断裂,达到脱色矿化的目的.

图7 罗丹明B降解过程中铁离子含量变化Fig.7 The change of iron content during the degradation of rhodamine B

图8 不同掩蔽剂对罗丹明B降解的影响Fig.8 Effect ofdifferent scavengers on degradation of rhodamine B
因此,推导其可能的产生途径如下[18-19]:一为单电子还原途径,氧气先得到一个电子变成具有弱氧化性可继续得到质子和电子生成H2O2,进而与溶液中二价铁反应产生⋅OH;二为双电子还原途径,氧气直接得到两个质子和电子生成H2O2,然后与二价铁反应产生⋅OH.
3 结论
3.1 Fe(II)/O2/STPP体系中各组分均为绿色无毒的无机物质,对环境副作用小,且在常温常压下能有效氧化降解罗丹明B染料废水,20min内降解率达到80%.
3.2 体系反应条件温和,在中性条件(pH=7)下反应速率最快,且废水中常见金属阳离子(Ca2+、Mg2+、Fe3+)对反应没有明显影响.
3.3 通过对体系中铁离子浓度变化的监测及不同自由基猝灭实验,可以得到推论:体系中Fe(II)作为电子供体,O2作为电子受体,反应中对降解起作用的活性自由基以⋅OH和为主.
[1] Cheng M, Ma W, Li J, et al. Visible-light-assisted degradation of dye pollutants over Fe(III)-loaded resin in the presence of H2O2at neutral pH values [J]. Environmental Science & Technology,2004,38(5):1596-1575.
[2] 田凯勋,杨 超,肖 泉,等.超声强化零价铁/过硫酸钾体系降解2,4,6-三氯苯酚废水 [J]. 中国环境科学, 2017,37(10):3729-3734.
[3] 冯 勇,吴德礼,马鲁铭.黄铁矿催化类Fenton反应处理阳离子红X-GRL废水 [J]. 中国环境科学, 2012,32(6):1011-1017.
[4] Jia L, Shen Z, Guo W, et al. QSAR models for oxidative degradation of organic pollutants in the Fenton process [J].Journal of the Taiwan Institute of Chemical Engineers, 2015,46:140-147.
[5] Keenan C R, Sedlak D L. Factors affecting the yield of oxidants from the reaction of nanoparticulate zero-valent iron and oxygen[J]. Environmental Science & Technology, 2008,42:1262-1267.
[6] Lee C, Sedlak D L. Enhanced formation of oxidants from bimetallic nickel-iron nanoparticles in the presence of oxygen [J].Environmental Science & Technology, 2008,42(22):8528.
[7] Hug S J, Leupin O. Iron-catalyzed oxidation of arsenic(III) by oxygen and by hydrogen peroxide: p H-Dependent formation of oxidants in the Fenton reaction [J]. Environmental Science &Technology, 2003,37(12):2734-2742.
[8] Welch K D, Davis T Z, Aust S D. Iron Autoxidation and Free Radical Generation: Effects of Buffers, Ligands, and Chelators [J].Archives of Biochemistry & Biophysics, 2002,397(2):360-369.
[9] Guan X, Dong H, Ma J. Influence of phosphate, humic acid and silicate on the transformation of chromate by Fe (II) under suboxic conditions [J]. Separation & Purification Technology,2011,78(3):253-260.
[10] Keenan C R, Sedlak D L. Ligand-enhanced reactive oxidant generation by nanoparticulate zero-valent iron and oxygen [J].Environmental Science & Technology, 2008,42:6936-6941.
[11] 高志婷.低价铁活化分子氧降解典型有机污染物的研究 [D].武汉:华中师范大学, 2013.
[12] Wang L, Wang F, Li P, et al. Ferrous-tetrapolyphosphate complex induced dioxygen activation for toxic organic pollutants degradation [J]. Separation and Purification Technology, 2013,120:148-155.
[13] Wang L, Cao M, Ai Z, et al. Design of a Highly Efficient and Wide pH Electro-Fenton Oxidation System with Molecular Oxygen Activated by Ferrous–Tetrapolyphosphate Complex [J].Environmental Science & Technology, 2015,49(5):3032-9.
[14] Smith L A, Simmons S L, Mckeith F K, et al. Effects of Sodium Tripolyphosphate on Physical and Sensory Properties of Beef and Pork Roasts [J]. Journal of Food Science, 2010,49(6):1636-1637.
[15] 姚群峰,徐顺清,周宜开,等.邻菲啰啉分光光度法测定铁的价态[J]. 中国卫生检验杂志, 2000,10(1):3-5.
[16] Garciasegura S, Centellas F, Brillas E. Unprecedented Electrochemiluminescence of Luminol on a Boron-Doped Diamond Thin-Film Anode. Enhancement by Electrogenerated Superoxide Radical Anion [J]. Journal of Physical Chemistry C,2012,116(29):15500–15504.
[17] Kim J, Lee C W, Choi W. Platinized WO3as an environmental photocatalyst that generates OH radicals under visible light [J].Environmental Science & Technology, 2010,44(17):6849-6854.
[18] Biaglow J E, Kachur A V. The generation of hydroxyl radicals in the reaction of molecular oxygen with polyphosphate complexes of ferrous ion [J]. Radiation Research, 1997,148(2):181-187.
[19] Minotti G, Aust S D. Redox cycling of iron and lipid peroxidation[J]. Lipids, 1992,27(3):219-226.
