载溴石油焦脱除烟气痕量Hg0的动力学机理
2018-03-02刁永发东华大学环境科学与工程学院上海201620
肖 艺,刁永发,田 力,陆 遥,詹 乐 (东华大学环境科学与工程学院,上海 201620)
燃煤电厂排放的汞是全球汞污染一个重要的人为来源[1],针对燃煤过程汞排放控制标准的空缺, 我国于2011年制定的《火电厂大气污染物排放标准》(GB 13223-2011)[2]首次将汞纳入控制范畴,并规定了燃煤电厂烟气汞排放限值为0.03mg/m3.在燃煤烟气上游注入碳基吸附剂控制痕量Hg0是目前较为成熟的技术[3].然而,由于活性炭价格昂贵等方面的原因,研究一种可替代活性炭的低成本吸附剂,尤其是应用廉价的碳基材料进行载溴和载硫等进行改性成为吸附剂技术的热门研究方向[4-10].
石油焦是传统石油提炼和油砂开采过程中的工业废弃物,由于有机硫含量高且高温煅烧也很难去除,使石油焦的使用范围受到限制,除非作为一种廉价而污染环境的劣质能源[11].有学者[12-15]试图将石油焦进行载溴和载硫改性后用于脱除燃煤烟气中的痕量Hg0,即将石油焦粉末与化学药剂混合后在700℃以上高温下活化,改性后的石油焦吸附剂具有较高的脱汞性能.然而,此种活化改性的方法需在高温炉中进行,对设备要求较高,同时伴随活化和改性过程会产生新的次生环境污染物,这势必造成环保压力而提高成本.
在本课题组的前期研究工作中发现,采用化学-机械溴化法[16]对石油焦进行改性得到的负载1wt.%Br2的新型载溴石油焦吸附剂的脱汞效率与商业溴化活性炭(DARCO Hg-LH, Cabot Corporation Company)相当,达到99%以上[17];通过对新型吸附剂表面化学性质的研究发现,石油焦中的有机硫主要以噻吩硫的形式存在,能促进元素溴的负载从而为Hg0的吸附提供更多的活性位点,形成复杂的化合物如Cn-S-Cn-Hg-Br、Cn-S-Cn-Hg和Cn-Hg-Br等[18].本研究在前期研究基础上,对新型载溴石油焦的孔结构、微晶结构和化学特性进行了探讨,并在实验室固定床脱汞装置上进一步考察反应床层温度梯度和初始汞浓度梯度下载溴石油焦脱汞的宏观吸附过程.采用吸附等温模型,从动力学的角度对前期的研究成果和吸附过程做进一步确证和补充.研究结果为载溴石油焦吸附剂的实际应用提供基础数据及理论依据.
1 材料与方法
1.1 吸附剂制备与表征
原始石油焦采用球磨机磨成粉末,过100目筛后,置于干燥箱中110℃干燥24h,记为PC.称取PC样品2g和一定量小玻璃珠放入一个球状玻璃器皿内,采用吸管定量法将20mg液溴滴入玻璃器皿,迅速盖紧并密封.然后将玻璃器皿置于翻转振荡器上震荡30min,使液溴与石油焦充分反应,再将玻璃容器打开静置30min,使没有反应的溴挥发掉.以上操作必须在通风橱中进行.最后将静置好的载溴石油焦放入200℃的真空干燥箱保持30min,使与石油焦结合不稳定的溴继续挥发干净以方便安全储运和测试.样品取出自然冷却后装入样品瓶,记为Br-PC.
本研究采用比表面积及孔径分析(BET)、X射线衍射(XRD)和X-射线光电子能谱 (XPS)对石油焦载溴前后进行表征和分析,以更深入了解载溴石油焦的特性.
1.2 固定床汞吸附系统
固定床汞吸附系统如图1,主要由配气部分、汞发生器、固定床吸附反应器、洗气装置和在线汞分析仪5部分组成.汞发生器通过调节循环水浴的温度使元素汞挥发,载气高纯氮气以30mL/min的速率通过汞发生器将元素汞带入气体预混箱,载气支路与平衡器支路气体流量均由D07-19B质量流量计控制,以实现系统内模拟烟气中入口汞含量保持恒定,总气流量为2L/min,在气体预混箱中充分混合后,分成两路,一部分气体通过尾气排出,另一部分进入固定床反应器.固定床反应器为处于管式炉中的石英玻璃管.

图1 固定床汞吸附实验装置Fig.1 Schematic diagram of Hg0 adsorption system
实验过程中,将50mg载溴石油焦均匀铺在石英管反应器内的玻璃棉上.含有一定量元素汞的混合气体通过吸附剂后,经过洗气装置随后进入VM3000汞分析仪在线实时监测.设定通过吸附剂样品的气流为主路气流,不通过吸附剂样品的气流为旁路气流.每次测试样品之前将主路的阀门关闭,使气体通过旁路进入汞分析仪在线实时监测,待汞出口浓度稳定30min后记录稳定后的汞入口初始浓度,用Hg0in表示;然后关闭旁路阀门,同时切换到主路,记录出口浓度,用Hg0out表示.在各路气体管道的尾端采用装有活性炭过滤芯的吸附箱将尾气处理后再排入大气中.
本研究采用单位累积汞吸附量来评价汞的吸附性能,可由式(1)表示:
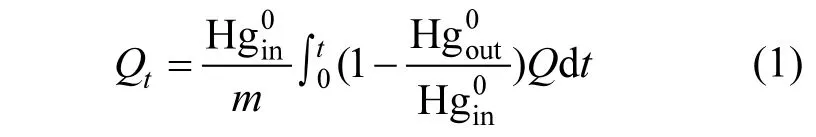
式中:Qt表示从吸附开始到t时刻这段时间内载溴石油焦单位累积汞吸附量,μg/g;Q表示气体流过吸附剂时单位时间内的流量,m3/min;t表示气体流过吸附剂时的时间,min;m表示吸附剂总量,g.
2 结果与讨论
2.1 载溴石油焦孔结构特性
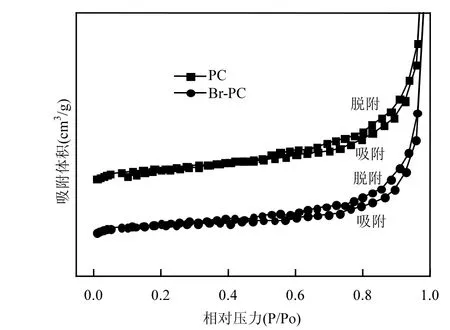
图2 PC和Br-PC的N2吸附等温线Fig.2 N2 adsorption isotherm of PC and Br-PC
图2为石油焦样品载溴前后样品的N2吸附等温线.有研究[19]表明吸附剂在吸附汞蒸气时,微孔能为汞提供吸附活性位点,中孔主要作为元素汞的传输通道,大孔作为元素汞的进入通道.从图2中可以看出两个样品的吸附曲线呈现I型等温线,I型等温线的线型表明样品中微孔孔隙发达,能为Hg0的吸附提供必要的活性位点.从表1可以看出,溴负载到石油焦上以后,样品的比表面积和平均孔径均有所下降,总孔容基本不变,这表明溴成功负载到石油焦上.

表1 PC和Br-PC的孔结构参数Table 1 Porous structure parameters of PC and Br-PC
2.2 载溴石油焦微晶结构
根据XRD谱图信息,可以确定样品是无定型还是晶体:无定型样品为大包峰,没有精细谱峰结构;晶体则有丰富的谱线特征[20].图3中PC衍射角2θ主要存在26°和43°2个大包峰,而Br-PC在13°位置出现了1个新的大包峰,表明了石油焦载溴前后为无定型态,溴元素负载到石油焦表面后,负载的物质并非直接以溴的晶体形态存在其表面,而主要以非晶体形式存在,即以化学负载为主.这与前人[10,20]研究的改性活性炭吸附剂的微晶结构一致.

图3 载溴前后石油焦XRD分析Fig.3 XRD spectra of PC and Br-PC
2.3 载溴石油焦表面化学特性
对载溴石油焦样品采用XPS进行测试,获得Br3d窄扫描光谱图,如图4所示.有研究表明,结合能在65.7~70.0eV的Br3d一般与无机类化合物结合,结合能高于70eV的Br3d一般与有机化合物结合[21].因此,图4中结合能在66~72eV出现的谱峰为溴元素失去电子后结合在石油焦活性位点上,而结合能在72~76eV的Br3d为溴元素失去电子后结合在噻吩环上与硫相邻的碳原子上[18].
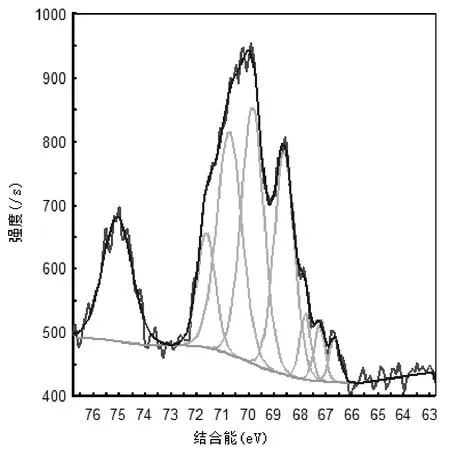
图4 Br-PC中Br3d的XPS窄扫描图谱Fig.4 High resolution XPS spectra over Br3d of Br-PC
一般活性炭载溴后的Br3d特征峰的结合能在65.7~70.0eV[7],而石油焦载溴后在72~76eV出现了新的能量峰.这进一步说明了溴在石油焦上的负载方式为化学吸附,石油焦中的有机硫促进了溴元素的负载,使更多的溴负载到了与石油焦中噻吩硫相邻的碳原子上.
2.4 汞吸附量实验
通过汞吸附量实验考察固定床温度梯度对载溴石油焦脱汞的影响,在N2气氛下,设定初始汞浓度为(29.5±0.5)µg/m3,固定床温度分别为100、150和200℃时3个工况下吸附的汞量随时间变化的规律,比较一定初始汞浓度下温度梯度对吸附剂吸附量的影响;通过汞吸附量实验考察了初始汞浓度梯度对载溴石油焦的影响,设定固定床温度为150℃,初始汞浓度分别为(29.5±0.5)和(57.5±0.5)µg/m32个工况下吸附的汞量随时间变化的规律,比较初始汞浓度梯度对吸附剂吸附量的影响.数据采集时间为120min.

图5 温度对Br-PC汞累积吸附量的影响Fig.5 Effect of temperature on mercury removal of Br-PC

图6 初始汞浓度对Br-PC汞累积吸附量的影响Fig.6 Effect of inlet Hg0 concentration on mercury removal of Br-PC
从图5中可以看出,温度由100℃升至150℃时,载溴石油焦的汞吸附量大大增强,随后温度升至200℃时,吸附量较150℃时有所下降.说明随着温度的升高,分子的运动速率加快,使汞在载溴石油焦表面的有效碰撞增多从而提高了物质的反应速率,载溴石油焦吸附汞量也随之增加.但当温度达到并维持在200℃以后,吸附剂上的溴部分挥发出来[17],有效溴元素的损失降低了吸附剂的汞累积能力,从而导致单位汞吸附量较150℃时有所下降.
从图6中可以看出,提高初始汞浓度,载溴石油焦汞累积吸附量也随之增大,这主要是因为汞浓度越大,单位空间内活性分子数量越多,从而增加单位时间内有效碰撞几率,载溴石油焦的单位汞累积吸附量增加.
2.5 动力学吸附机理
目前研究碳基吸附剂吸附过程的动力学模型主要有:准一级动力学模型、准二级动力学模型、颗粒内扩散模型和Elovich动力学模型,这些模型常用来拟合吸附剂对痕量Hg0的吸附过程[22-25].已有学者通过应用这几种动力学模型拟合,获得了吸附剂吸附过程的动力学参数,从而对吸附剂脱汞的机理进行了探讨[26-29],研究表明应用数学模型来研究碳基吸附剂脱除Hg0的反应动力学特性是一种有效手段,能帮助我们更加透彻和直观地讨论吸附过程的作用机制.本研究采用这4种动力学模型,从动力学角度分析固定床温度梯度和初始汞浓度梯度下载溴石油焦对汞的动力学吸附机理.
2.5.1 颗粒内扩散模型 颗粒内扩散是零价汞分子通过浓度梯度和范德华力的作用向碳基吸附剂内部的活性位点扩散的过程.其表达式为[20]:
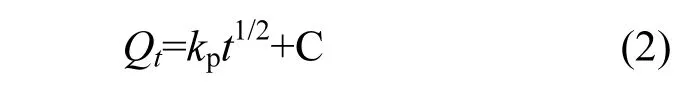
式中: t为反应时间, min;kp为颗粒内扩散速率常数,µg/(g·min1/2);C为与边界层有关的常数, μg/g.
从表2的内扩散模型对初始汞浓度梯度的拟合结果可以看出随着汞浓度升高,kp值升高,内扩散速率增强,从而汞累积吸附量增加.从温度对载溴石油焦吸附剂的影响来看,温度在150℃时,kp值和R2的值达到最高,说明在这个温度下,内扩散方程的拟合程度最高,内扩散控制作用最强,吸附速率和吸附容量也最大.在温度达到200℃时,吸附剂的吸附速率及吸附容量都较150℃时有所下降,主要是由载溴石油焦中溴在石油焦表面的温度稳定性决定的[18],这说明吸附剂中有效溴元素的含量也同时影响汞在吸附剂上的内扩散进程.

表2 内扩散模型拟合结果Table 2 Kinetic data obtained from intraparticle diffusion model
2.5.2 准一级动力学模型 准一级动力学模型源于质量平衡方程,描述的是Hg0穿越滞流层向表面扩散及被氧化后的氧化态汞由吸附剂外表面向气流扩散的过程,能准确描述外部传质过程,常采用Lagergren方程[20]计算吸附速率:
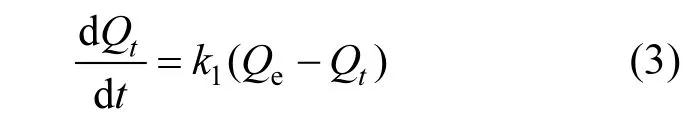
式中:Qt和Qe分别为t时刻和平衡态时的吸附量,µg/g;k1为一级吸附速率常数,min-1.
从表3准一级方程的拟合参数可以看出,相比内扩散模型,所有工况下对实验结果的拟合结果更好,R2值都达到0.999以上.这说明外部传质作用比内扩散作用更明显.浓度越高k1值越大,说明提高汞的浓度有利于吸附剂脱汞的外部传质,物理吸附作用增强. 从表3温度对吸附剂的影响来看,温度达到150℃时R2值最大,说明在此温度下准一级动力学方程的拟合程度最好,温度在100℃时, k1值最大,说明此温度下物理吸附作用较强,随着温度的升高,k1值降低说明物理吸附作用随之减弱,而平衡吸附量在150℃时达到最大,说明此时物理吸附不是吸附剂脱汞的控制步骤,化学吸附起主导作用.
2.5.3 准二级动力学模型 准二级动力学模型是基于Langmuir吸附等温线获得的[22-25]描述化学吸附的动力学模型,其方程表达式为:

式中:Qt和Qe分别为t时刻和平衡态时的吸附量,µg/g;k2为二级吸附速率常数,g/(μg⋅min).

表3 准一级动力学模型拟合结果Table 3 Kinetic data obtained from pseudo-first order kinetic model
从表4中可以看出,在初始汞浓度梯度和反应床温度梯度下,载溴石油焦对Hg0的吸附相关系数R2均大于0.999,且拟合效果优于相应准一阶动力学模型,说明准二阶动力学模型能很好的拟合实际反应中的化学吸附过程.准二阶动力学模型基于Langmuir吸附等温方程,说明在载溴石油焦表面,Hg0的吸附同时遵循Langmuir吸附等温方程.同时提高汞的入口浓度,k2值明显增大,说明汞浓度的提高有利于吸附剂对汞的吸附.温度在150℃时,吸附剂中汞的平衡浓度Qe及k2值达到最大,说明在此温度下,化学吸附占主导地位,温度达到200℃以后,Qe及k2值有所下降,说明载溴石油焦中的溴部分挥发出来[18],从而影响了吸附剂的化学吸附进程.
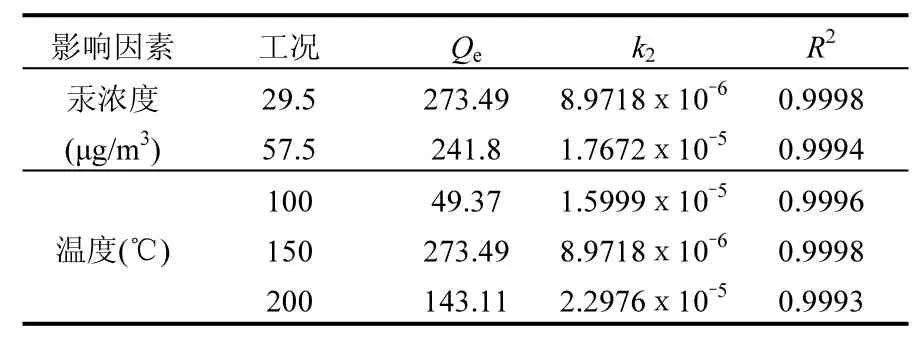
表4 准二级动力学模型拟合结果Table 4 Kinetic data obtained from pseudo-second order kinetic model
2.5.4 Elovich动力学模型 Elovich方程是基于Temkin吸附等温线获得[22-25]的另一个动力学方程,其表达式为:
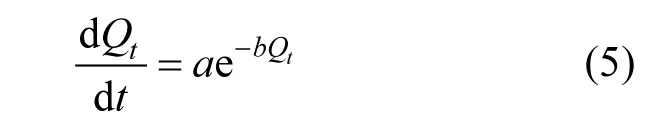
式中:Qt为t时刻的吸附量, µg/g;a和b为Elovich常数,分别表示初始吸附速率(µg/(g·min))及解吸常数(g/µg).
从表5的Elovich方程拟合的结果可以看出,拟合的相关系数R2均在0.9996以上,拟合结果均优于内扩散方程和准一级动力学方程,在工况初始汞浓度29.5µg/m3且反应温度150℃下,其相关系数与准二级动力学方程相当,这说明化学吸附是整个吸附过程中的控制步骤,这个结果与前期通过XPS研究的吸附剂表面化学机理一致[18],可能生成的产物有HgBr2和HgBr等.在温度达到200℃时,吸附剂的吸附速率及吸附容量都较150℃时有所下降,主要是由载溴石油焦中溴在石油焦表面的温度稳定性决定的[17],在持续200℃下,载溴石油焦中的溴部分挥发出来从而影响了吸附剂的化学吸附进程.

表5 Elovich 动力学模型拟合结果Table 5 Kinetic data obtained from Elovich kinetic model
2.5.5 动力学模型拟合结果分析 由以上4种动力学模型拟合结果得出,反应温度为150℃下改性石油焦吸附剂的脱汞性能最好且随时间变化单位累积汞吸附量最高,实际燃煤电厂中,吸附剂注入技术中的反应温度为140℃左右,与实验值接近,因而载溴石油焦吸附剂可在燃煤电厂的吸附剂注入技术中作为一种优良的碳基吸附剂.

表6 4种动力学方程及拟合相关系数Table 6 Kinetic equation and correlation coefficient obtained from 4kinetic models
表6为对固定床温度为150℃下,汞入口浓度为(29.5±0.5)µg/m3的动力学方程及拟合相关系数做进一步分析.结果表明,描述化学吸附的Elovich方程的相关系数达到0.9999,说明Elovich模型能准确描述改性石油焦吸附剂脱除痕量Hg0的吸附过程.研究结果与前期通过XPS研究的吸附剂表面化学机理一致[18],所生成的化合物为HgBr和HgBr2.溴在石油焦表面的温度稳定性也决定了吸附剂的吸附容量,也同时影响化学吸附的进程.另外,准一级动力学模型也具有很好的拟合相关性,这说明在化学吸附的过程中,传质作用也不容忽视.在改性石油焦吸附剂的内部,化学吸附与传质过程同时进行,使改性石油焦吸附剂内部的气态和固态汞浓度成非线性分布.
本研究是在理想状态下纯氮气气氛中进行的,在实际的燃煤烟气中,烟气组分如O2、SO2、NO和HCl等对吸附剂的吸附效果有一定的影响,以后的研究应对其他烟气组分对吸附剂的影响和机理做进一步研究.
3 结论
3.1 通过BET、XRD和XPS表征发现,改性过程中石油焦中的有机硫促进了溴的负载,元素溴以化学吸附的方式负载到石油焦的表面.
3.2 载溴石油焦脱汞的最佳温度在150℃,此时吸附速率和单位累积汞吸附量最佳,这与吸附剂注入技术中实际燃煤烟气温度为140℃左右接近,说明载溴石油焦具有实际应用价值.同时初始汞浓度的增加能提高载溴石油焦汞吸附速率和单位累积汞吸附量.
3.3 从4种吸附动力学模型拟合度相关系数R2来看,描述化学吸附的准二级动力学模型及Elovich方程的拟合度略高于颗粒内扩散模型和准一级动力学模型,这说明载溴石油焦脱汞的过程为化学吸附起主导作用,汞在吸附剂表面的吸附同时遵循Langmuir吸附等温线方程和Temkin吸附等温线方程,烟气中的痕量Hg0通过化学吸附的方式吸附在载溴石油焦表面的活性位点上,生成的化合物主要为HgBr和HgBr2.
[1] 吴晓云,郑有飞,林克思.我国大气环境中汞污染现状 [J]. 中国环境科学, 2015,35(9):2623-2635.
[2] GB 13223-2011.环境保护部.《火电厂大气污染物排放标准》编制说明 [R]. 2009.
[3] Yang H, Xu Z, Fan M, et al. Adsorbents for capturing mercury in coal-fired boiler flue gas [J]. Journal of Hazardous Materials,2007,146(1):1-11.
[4] 谭增强,邱建荣,向 军,等.氯化锌改性竹炭脱除单质汞的特性与机理分析 [J]. 中国环境科学, 2011,62(10):1944-1950.
[5] Karatza A D, Lansia D, Musmarra C, et al. Study of mercury absorption and desorption on sulfur impregnated carbon [J].Experimental Thermal and Fluid Science, 2000,21:150-155.
[6] Suresh Kumar Reddy K, Al Shoaibi A, Srinivasakannan C.Elemental mercury adsorption on sulfur-impregnated porous carbon – A review [J]. Environmental Technology, 2013,35:18-26.
[7] 孙 巍,晏乃强,贾金平.载溴活性炭去除烟气中的单质汞 [J].中国环境科学, 2006,26(3):257-261.
[8] Bisson TM, MacLean LC, Hu Y, et al. Characterization of mercury binding onto a novel brominated biomass ash sorbent by X-ray absorption spectroscopy [J]. Environ. Sci. Technol,2012,46:86-93.
[9] 王 力,陈江艳,赵 可,等.ZnCl2溶液对褐煤半焦表面性质及其中高温脱汞性能的影响 [J]. 中国环境科学, 2016,36(3):702-708.
[10] 吕维阳,刘盛余,能子礼超,等.载硫活性炭脱除天然气中单质汞的研究 [J]. 中国环境科学, 2016,36(2):382-389.
[11] Mountain of Petroleum Coke From Oil Sands Rises in Detroit,ENERGY & ENVIRONMENT, New York Times (May 17, 2013).http://www.nytimes.com/2013/05/18/business/energy-environme nt/mountain-of-petroleum-coke-from-oil-sands-rises-in-detroi t.html.
[12] Lee Y, Rhim Y J. Carbon-based novel sorbent for removing gas-phase mercury [J]. Fuel, 2006,85:219-226.
[13] Morris EA, Jia CQ. Effects of O2on Characteristics of Sulfur Added to Petroleum Coke through Reaction with SO2[J]. Ind.Eng. Chem. Res, 2010,49:12709-12717.
[14] 洪亚光,段钰锋,朱 纯,等.载溴高硫石油焦活性炭脱汞实验研究 [J]. 中国电机工程学报, 2014,34(11):1762-1768.
[15] 洪亚光,段钰锋,朱 纯,等.高硫石油焦喷射脱汞实验研究 [J].工程热物理学报, 2014,(7):1439-1442.
[16] Gupta R P, Xu Z, Clark I, et al. Bromination process [P]. United States Patent No.20100126345.
[17] Xiao Y, Pudasaineeb D, Gupta RP, et al. Bromination of petroleum coke for elemental mercury capture [J]. Journal of hazardous materials, 2017,336:232–239.
[18] Xiao Y, Pudasaineeb D, Gupta RP, et al. Elemental mercury reaction chemistry on brominated petroleum cokes [J]. Carbon,2017,124:89-96.
[19] Rong Y, Liang DT, Tsen L, et al. Bench-scale experimental evaluation of carbon performance on mercury vapour adsorption[J]. Fuel, 2004,83(17/18):2401-2409.
[20] 周 强.改性吸附剂喷射脱汞的实验及机理研究 [D]. 南京:东南大学, 2016.
[21] Naumkin AV, Kraut-Vass A, Gaarenstroom SW, et al. X-ray photoelectron spectroscopy database: NIST standard reference database version 4.1, [EB/OL]. http://srdata.nist.gov/xps/Default.aspx.
[22] Camargo C L M, Resende N S D, Oliveira A G D, et al.Investigation of adsorp-tion-enhanced reaction process of mercury removal from simulated natural gas by mathematical modeling [J]. Fuel, 2014,129(4):129-137.
[23] 王 欣.活性炭纤维低温吸附脱除汞的试验研究 [D]. 武汉:华中科技大学, 2006.
[24] Goswami S, Ghosh U C. Studies on adsorption behaviour of Cr(VI) onto synthetic hydrous stannic oxide [J]. Water S A, 2006,31(4):597-602.
[25] Reid C, Thomas K. Adsorption of gases on a carbon molecular sieve used for air separation: Linear adsorptives as probes for kinetic selectivity [J]. Langmuir, 1999,15(9):3206-3218.
[26] 高洪亮,周劲松,骆仲泱.模拟燃煤烟气中汞在活性炭上吸附的动力学研究 [J]. 中原工学院学报, 2006,16(6):1-5.
[27] 任建莉,周劲松,骆仲泱,等.模拟烟气中束吸附系统的数学模型[J]. 浙江大学学报:工学版, 2006,40(10):1827-1832.
[28] Zhou Q, Duan Y F, Hong Y G, et al. Experimental and kinetic studies of gas-phase mercury adsorption by raw and bromine modified activated carbon [J]. Fuel Processing Technology,2015,134:325-332.
[29] Khunphonoi R, Khamdahsag P, Chiarakorn S, et al. Enhancement of elemental mercury adsorption by silver supported material [J].Journal of Environmental Sciences, 2015,32:207-216.
致谢:本研究的样品制作是在加拿大阿尔伯塔大学徐政和院士实验室完成的,同时得到课题组Rajender Gupta教授和博士后Deepak Pudasaineeb的指导和帮助,在此表示感谢.
