鳗鱼钙螯合肽制备工艺研究
2018-03-01吴长平钟芳芳霍国昌赵谋明苏国万
吴长平,钟芳芳,霍国昌,赵谋明,苏国万
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.江门市江户泉食品有限公司,广东江门 529000)
钙是人体不可或缺的重要元素,主要由日常饮食中摄入,如牛奶和奶制品。但如果人体钙摄入不足,或肌醇六磷酸、纤维素、脂肪等其他成分降低钙的溶解性影响吸收,会产生低钙血症和骨质流失,增加骨质疏松的风险。王惠君[1]跟踪研究了我国九个省份居民近10年钙摄入量情况,发现18~49岁成年男性和女性的日常钙摄入量仅为推荐摄入量的50%左右。而儿童和婴儿的钙摄入量则更低。因此,我国居民补钙刻不容缓,迫在眉睫。
目前市面上补钙剂大概可分为三类[2],第一类是无机钙,钙含量高,但吸收率低;第二大类是有机酸钙,此类补钙剂溶解性好,但大量被机体吸收后会诱发负反馈调节系统,反而抑制钙的吸收;第三类是近几年兴起的氨基酸螯合钙,氨基酸和小肽能与金属离子结合生成M-多肽/氨基酸的形式进入细胞,然后在细胞中主动分裂,释放出Mn+便被细胞利用,从而促进金属离子吸收[3,4],是一种优质的补钙剂。酪蛋白磷酸肽(CPP)是最早用来促进金属离子吸收的多肽,但CPP相对较高的价格,以及乳糖不耐受症不可避免的限制了其作为补钙剂的普遍应用。因此,其他蛋白来源如鸡蛋黄卵黄高磷蛋白和鱼蛋白和大豆蛋白等酶解产物作为新型钙螯合肽是CPP理想的替代方案。
鳗鱼,又称日本鳗和白鳝等,味道鲜美,营养丰富。鳗鱼肉、皮中含有丰富优质蛋白,蛋白含量甚至高于猪、牛、鸡等餐桌上常见的肉类,且氨基酸均衡,其中人体生命活动必需的氨基酸占了将近40%[5]。
1980年,我国开始引进鳗鱼养殖,目前我国已成为养殖鳗鱼数量最多的国家,但以活鳗出口和鳗鱼粗加工为主[6]。在粗加工过程中会产生大量的下脚料(鳗鱼头和尾等),其重量约占原料鳗鱼本身重量40~55%,下脚料中含有丰富的蛋白质、脂肪和矿物质等,如果不加以利用,将造成资源的极大浪费,增加环境压力。
近年来,精深加工的鳗鱼产品悄然丰富起来,如用鳗鱼骨提取钙,作为高级营养补钙品的原料;以鳗鱼为原料,生产有保健功能的口服液;利用废弃的下脚料提取鱼油等。虽然深加工产品越来越多样化,但我国的水产品加工率仍然不容乐观,不到发达国家的15%[6]。因此对鳗鱼加工副产物-鳗鱼尾进行精深加工,开发出具有多种功能的新产品,不仅可提高低值蛋白资源的利用率,提高附加值,还可拓展其应用范围,具有重要的意义。
1 材料与方法
1.1 原料
鳗鱼尾:由江门市江户泉食品有限公司提供;冲洗干净放入绞肉机中绞成肉糜,置于-18 ℃冰箱中冷冻保存,备用。
酸性蛋白酶(酶活力4.57×104U/g,最适pH值4.0)、中性蛋白酶(酶活力8.82×104U/g,最适pH值7.0)、复合蛋白酶(酶活力1.86×105U/g,最适pH值7.0)、水解蛋白酶(酶活力1.75×105U/g,最适pH值8.0)、Alcalase 2.4 L(酶活力1.70×105U/g,最适pH值8.0)、碱性蛋白酶(酶活力5.68×104U/g,最适pH值8.0)均购于美国诺维信公司;木瓜蛋白酶(酶活力5.65×105U/g,最适pH值6.5)购于广州华琪生物科技公司;胰酶(酶活力2.30×105U/g,最适pH值8.0)购于重庆市祥盛生物制药有限公司,其余试剂均为分析纯;去离子水为实验室自制。
1.2 主要试验仪器
KND-103F型蛋白质测定仪,上海纤检仪器厂;SHA-C水浴恒温振荡器,江苏省金坛市农仪器有限公司;AL204电子分析天平,瑞士METTLER TOLEDO公司;GL-21M高速冷冻离心机,长沙湘仪离心机厂;雷磁pH计,上海仪电科学仪器有限公司;LABCONCO冻干机,美国LABCONCO公司。
1.3 试验流程
鳗鱼尾制备钙螯合肽的工艺流程如图1所示。

图1 鳗鱼钙螯合肽制备工艺流程Fig.1 The process of preparing calcium-chelating peptides from eel tail
流水清洗干净鳗鱼尾,放入绞肉机绞成肉糜后冷冻保藏备用。取一定量鳗鱼肉糜于250 mL锥形瓶中,按1:1(m/m)加入去离子水,调整pH值为添加酶制剂的最适pH值,分别加入酸性蛋白酶、中性蛋白酶、复合蛋白酶、水解蛋白酶、碱性蛋白酶、木瓜蛋白酶、Alcalase 2.4L和胰酶混匀密封,置于55 ℃恒温水浴摇床中震荡反应一定时间后,置于沸水中15 min灭酶,在8000 r/min,25 ℃下离心25 min,取上清液过200目绢布以分离凝固的油脂,抽滤除去悬浮的杂质得到澄清的酶解液,冷冻干燥得鳗鱼肽粉。将鳗鱼肽粉复溶成一定浓度的肽液,调整pH值,按一定质量比加入钙离子(以无水氯化钙的形式),震荡混匀后,恒温螯合,按1:9(V/V)加入无水乙醇,静置沉淀3 h[7]后,8000 r/min,4 ℃下离心25 min,取下层沉淀物冻干得鳗鱼钙螯合肽粉。
1.4 分析测定
1.4.1 粗蛋白测定
凯氏定氮法测定GB 5009.5-85[8]。

1.4.2 游离氨态氮含量测定
采用甲醛电位滴定法[9]来测定酶解液中游离氨态氮含量,用80 g去离子水为空白对照,取6 g酶解液,补水至80 g,以0.1 mol/L NaOH标准溶液滴定至其pH 8.2,再加入10 mL甲醛溶液,继续使用同浓度的NaOH溶液滴定至pH 9.2,此时,分别记录空白和样液pH从8.2滴至9.2所消耗的NaOH溶液的体积V0和Vi。水解产物中游离氨态氮的含量为:

进而计算其水解度[10]为:

式中,Vi、V0分别指样液和空白加入甲醛后pH从8.2滴定至9.2所消耗的NaOH标准溶液的体积,mL;Mi指测定样品中游离氨基酸时的取样量,g;AN指样品中的游离氨基酸态氮的含量,%;M1指鳗鱼酶解液的总质量,g;W2指鳗鱼肉糜的氮含量,g/g;M2指所加入的鳗鱼肉糜的质量,g。
1.4.3 肽得率的测定[10]
取酶解液10 mL,按照1:1(V/V)加入15%的TCA溶液,涡旋混匀后静置30 min,在8000 r/min,25 ℃的条件下离心10 min,分别测定TCA酸沉离心后上清液的总氮含量和氨基酸肽氮含量,则肽得率计算方法如下:1.4.4 钙螯合能力测定

采用EDTA配位滴定法[11]分别测定螯合物以及空白(200 mL水)中钙离子含量,钙离子螯合能力(mg/g)计算如下:
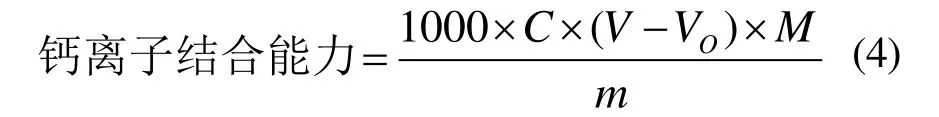
式中,C指EDTA溶液浓度,mol/L;V指滴定螯合沉淀所消耗的EDTA标准溶液体积,L;Vo指滴定空白所消耗的EDTA标准溶液的体积,L;M指钙的摩尔质量,g/mol;m指沉淀中所含肽的质量,g。
1.4.5 水解氨基酸组成的测定
采用A300氨基酸自动分析仪(Membra Pure,Bodenheim,Germany)进行水解氨基酸组成分析。取5 mL、6 M的盐酸在110 ℃条件下消化样品24 h,定容至50 mL,取2 mL溶液挥干后用稀释液稀释,溶液经0.22 µm滤膜过滤后测定。氨基酸的含量用mmol/g表示。
1.5 数据统计
每个实验重复3次,结果采用“平均值±标准偏差”表示。采用SPSS 19.0进行数据统计分析,差异显著性分析采用ANOVA,p<0.05为有显著性。采用Excel以及Origin 9.0软件作图。
2 结果与讨论
2.1 酶解工艺对酶解效果的影响
2.1.1 蛋白酶种类对鳗鱼尾酶解效果的影响
图2为不同蛋白酶水解鳗鱼尾的蛋白回收率、肽得率以及钙螯合能力。由图2可知,胰酶和Alcalase 2.4L的蛋白回收率及肽得率均高于其他酶制剂,碱性蛋白酶和木瓜蛋白酶次之。酶解反应具有特异性,每种酶制剂均具有特异酶切位点,即使是具有相似性质的酶制剂,在酶切位点上都会有一定的偏好。Alcalase 2.4L蛋白酶是一种丝氨酸型内切酶,酶切位点较多,因此肽得率和氮回收率都比较高;而胰酶的特异酶解位点包括由精氨酸的羧基组成的肽链,以及由赖氨酸、精氨酸、组氨酸等碱性氨基酸的羧基形成的肽键、酰胺键以及酯键[12],鳗鱼原料中的精氨酸、赖氨酸、组氨酸等碱性氨基酸的含量高达29.98%[4],约占了总氨基酸含量的三分之一。因此,相对于Alcalase 2.4L蛋白酶以及其他酶制剂而言,胰酶对鳗鱼原料具有更多的酶切位点,这也是胰酶水解产物回收率最高的原因之一。酸性蛋白酶水解产物的蛋白回收率以及肽得率均为最低,但钙螯合能力远远超过其他蛋白酶,高达75 mg/g,而其他酶制剂酶解所得的鳗鱼肽的钙离子螯合能力均低于50 mg/g。
洪慧等[13]人用碱性蛋白酶水解鲽鱼骨,获得了高螯合率的鱼骨胶原多肽螯合钙,夏光华[14]等人为了制备胶原蛋白小肽螯合钙,也预先用碱性蛋白酶和酸性蛋白酶对原料进行水解。多肽与金属离子的螯合反应复杂,多与多肽上所含的碱性或者是酸性基团相关,尤其是羧基和氨基[5]。本文中由酸性蛋白酶酶解所得的多肽与钙离子的螯合活性最佳,推测原因为在酸性条件下,水解反应释放了更多的呈酸性的基团,如羧基和磷酸基团等,在之后的螯合反应中对螯合活性有显著影响。
考虑到与钙离子螯合能力和肽得率等因素,将选用木瓜蛋白酶、碱性蛋白酶、胰酶、Alcalase 2.4L蛋白酶分别和酸性蛋白酶进行复配,进一步研究,由于复配的两种酶制剂的pH相差较远,确定为分段酶解。
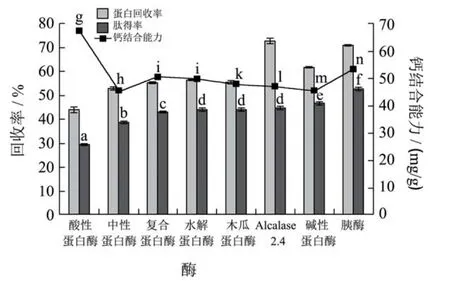
图2 不同蛋白酶对鳗鱼尾酶解效果的影响Fig.2 Effects of different proteases on the protein recovery,peptides yield and calcium chelating ability of eel tail
2.1.2 多种蛋白酶复配作用对鳗鱼尾酶解效果的影响

图3 多种蛋白酶的复配对鳗鱼尾酶解效果的影响Fig.3 Effects of multiple proteases on the protein recovery,peptides yield and calcium chelating ability of eel tail
单酶酶解中,酸性蛋白酶的酶解产物钙离子螯合活性最强,蛋白回收率和肽得率均为最低。图3表明,与木瓜蛋白酶、碱性蛋白酶、胰酶以及Alcalase 2.4L复配使用后,酶解产物的蛋白回收率以及肽得率均有比较明显的提高,但是钙离子螯合活性有所下降。陈达等[16]人在酶解牡蛎蛋白制备锌螯合物时,采用胃蛋白酶与胰蛋白酶复配酶解后,酶解产物的锌离子螯合活性较胃蛋白酶单独酶解也显著降低。因此推测多肽的金属离子螯合活性不仅与极性基团和氨基酸有关,而多肽的长度和结构也产生一定的影响。相较于酸性蛋白酶单一酶解,其他酶的加入丰富了酶切位点,导致酶解产物中多肽长度和结构变化,钙离子螯合活性降低,但同时多肽的回收率也有所提升。其中酸性蛋白酶与胰酶复配后,钙离子螯合活性无明显下降,肽得率和蛋白质回收率均显著提升。因此综合各个因素,最终选定所用胰酶与酸性蛋白酶为最优复配酶解方案,由于酸性蛋白酶的蛋白回收率和肽得率都均较低,以及产物钙离子螯合能力高的特性,决定先选用胰酶酶解,水解程度较大,之后再用酸性蛋白酶进行酶解,丰富酶切位点,得到钙离子螯合能力强的鳗鱼肽。
2.1.3 酶解时间对鳗鱼尾酶解效果的影响
如图4所示,随着酸性蛋白酶反应时间的继续增加,酶解产物的肽得率、蛋白回收率和钙螯合能力均有下降。分析试验结果可得出,酸性蛋白酶对蛋白回收率以及肽得率的贡献不大,并且随着反应不断进行,多肽会发生聚集,从而降低蛋白回收率。试验结果与前面的试验相符,Nie R[16]在研究中也发现类似的现象。先用胰酶酶解,获得较多的水溶性多肽之后,再用酸性蛋白酶酶解以得到钙螯合能力较强的鳗鱼肽,在预实验的基础之上,本文并未对胰酶的酶解时间进行优化。因此胰酶酶解3 h后,调整pH值,再加入酸性蛋白酶酶解2 h为较优的方案。

图4 多酶解时间对鳗鱼尾酶解效果的影响Fig.4 Effects of different enzymatic time on the protein recovery, peptides yield and calcium chelating ability of eel tail
2.1.4 加酶量对鳗鱼尾酶解效果的影响

图5 加酶量对鳗鱼尾酶解效果的影响Fig.5 Effects of different enzyme dosages on the protein recovery, peptides yield and calcium chelating ability of eel tail
由图5可知,各项指标随着酶量的增加先上升后呈现下降趋势,此实验结果与汪婧瑜等[17]的研究一致。随着酶添加量的不断增加,各项指标均出现了下降的趋势,这有可能是水解度增大,反应体系中多肽的种类越来越多,小分子肽之间吸附以及其他作用导致部分多肽和氨基酸聚集之后,随着分子量的增大,疏水基团增多而沉淀下来。酶添加量为7.5‰时,反应得多肽的钙离子螯合能力达到峰值,而肽得率和蛋白回收率均在酶添加量为10‰时达到峰值,再可综合考虑到经济效益,最终选取酶添加量为7.5‰为最优酶浓度。
2.2 螯合工艺对钙螯合能力的影响
2.2.1 pH值对钙螯合能力的影响

图6 不同pH值对钙螯合能力的影响Fig.6 Effects of different pH values on the calcium chelating ability of eel peptides
如图6所示,随着pH的增加,钙离子螯合能力先增加,当pH达到9.0时,则开始下降,说明pH对螯合活性的影响较大。pH小于7时,反应体系呈酸性,因此在反应体系中存在着大量游离的H+会与同样是带正电的的Ca2+抢夺供电子基团,与Ca2+存在竞争供电子基团的关系,并与肽类上的供电子基团螯合,表现为肽螯合Ca2+的活性降低;当pH大于7时,体系中的H+开始被OH-取代,肽类上的供电子基团处于待螯合状态,Ca2+能自由与其螯合,但是当pH继续上升,体系中OH-含量越来越高,达到某以特定OH-含量时,OH-将于Ca2+螯合,将Ca2+沉淀下来,肽能螯合Ca2+的含量自然也就减少,此结果与夏光华[14]和范露[7]等人的研究结果相近,因此确定pH为9.0为最佳螯合pH。
2.2.2 质量比对钙螯合能力的影响
随着反应系统中肽所占比例的增加,每克肽所螯合的钙的质量稍有降低,相比于刘闪[18]等人以及高菲[19]等人的研究结果,略有不同,二者的研究结果均为肽钙质量比大于1。据研究,肽与金属离子的反应比较复杂,涉及到两者间的配位、吸附等多种作用。近年来的研究结果表明,肽类上的显酸性或者碱性的基团以及氨基酸对肽的金属离子螯合活性贡献最大。而鳗鱼原料中碱性氨基酸的含量高达29.98%,酸性氨基酸含量8.87%[4],说明由鳗鱼酶解所得的鳗鱼肽能提供足够的螯合位点,在肽:钙质量比较低的情况下便能使螯合反应饱和,因此肽钙比1:2(g/g)为最优质量比。

图7 质量比对钙螯合能力的影响Fig.7 Effects of different mass ratios on the calcium chelating ability of eel peptides
2.2.3 温度对钙螯合能力的影响

图8 温度对钙螯合能力的影响Fig.8 Effects of different temperatures on the calcium chelating ability of eel peptides
随着温度的变化,钙离子螯合能力比较稳定,波动不大,说明温度的变化对螯合活性的影响不大,与各学者的结果相近[13~18]。但是温度的上升,鳗鱼肽的钙离子螯合能力稍有降低,这有可能是因为肽与钙离子的螯合生成肽-M形式的产物时,有新的键生成,会放出一定的热量,温度高不利于正向反应。也有可能是因为随着温度的上升,肽类结构发生了一些变化,导致反应活性位点的位置变得不易暴露,钙离子与其的螯合更难。因此30 ℃为最佳螯合温度。
2.3 鳗鱼肽及其钙螯合物的氨基酸组成分析
鳗鱼肽中谷氨酸的含量最高(12.88 g/100 g),其次是甘氨酸(8.88 g/100 g)和天冬氨酸(8.77 g/100 g),而苯丙氨酸、半胱氨酸、组氨酸、蛋氨酸的含量比较少,这是典型的胶原蛋白肽的氨基酸组成[20],说明鳗鱼肽中胶原蛋白肽占主要地位。相较于鳗鱼肽,鳗鱼钙螯合肽中谷氨酸和天冬氨酸的含量有一个大幅度的提升,分别为22.31 g/100 g,17.02 g/100 g,提高了73.21%和94.07%,说明在鳗鱼肽与钙的螯合反应中,谷氨酸和天冬氨酸等酸性氨基酸的贡献很大,可能是谷氨酸和天冬氨酸侧链的羧基在与钙的反应中贡献较大,这和前期酸性蛋白酶酶解产物钙螯合能力最强的现象完全吻合。
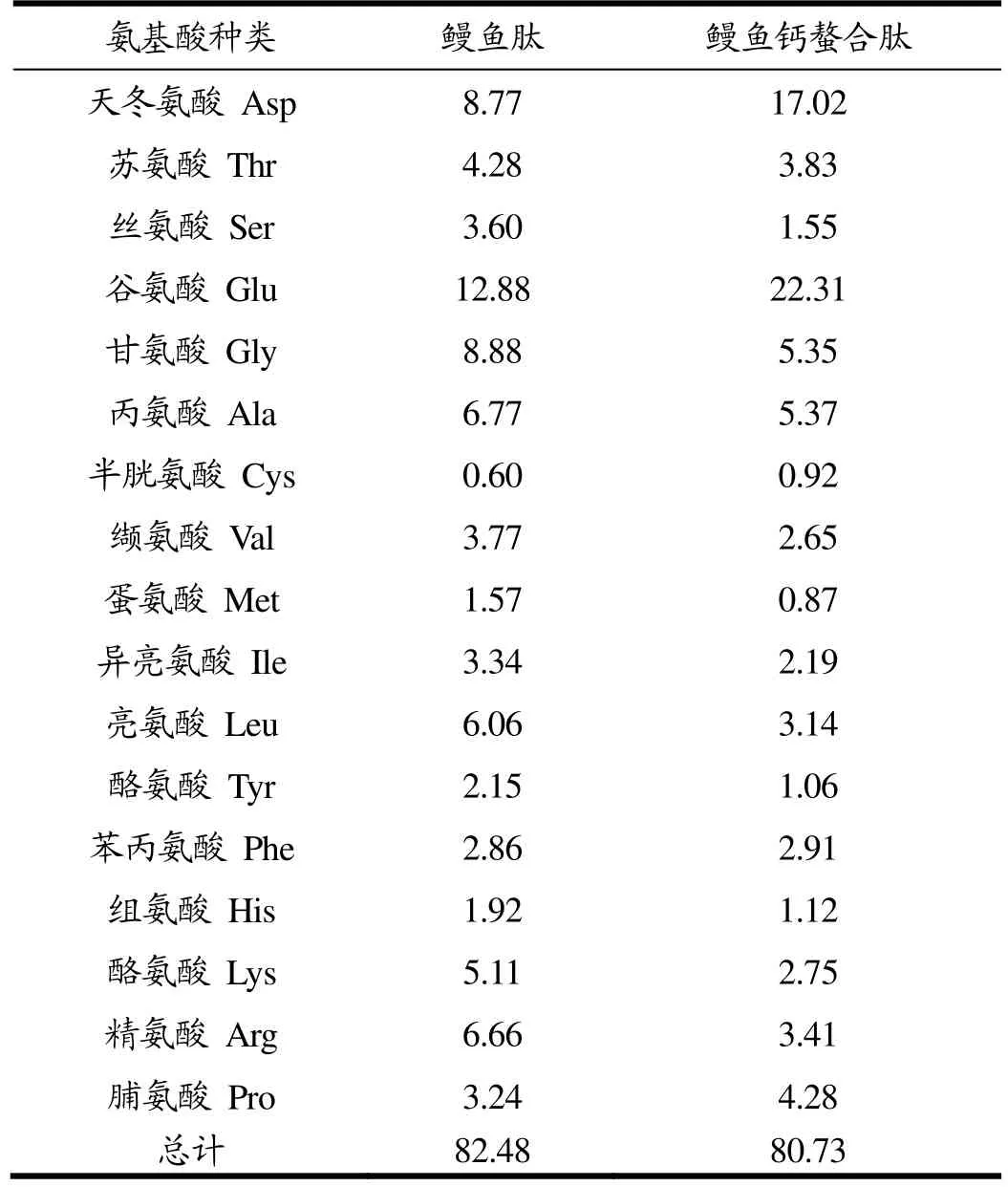
表1 鳗鱼肽及其螯合物的氨基酸组成Table 1 The amino acid composition of eel peptides and peptide-cacium chelate
3 结论
本文将鳗鱼加工下脚料鳗鱼尾在55 ℃,加酶量为7.5‰的条件下,用胰酶酶解3 h,酸性蛋白酶酶解2 h,蛋白回收率达到66.61%,肽得率为52.46%;冻干的鳗鱼肽粉在30 ℃,pH 9.0,肽钙比为1:2(g/g)条件下反应30 min,得到含钙量59.37 mg/g的鳗鱼钙螯合肽粉。在鳗鱼肽与钙的螯合反应中,谷氨酸和天冬氨酸等酸性氨基酸的贡献最大。本文优化了鳗鱼尾酶解工艺以及鳗鱼钙螯合肽粉的制备工艺,提升了鳗鱼尾的利用价值,拓宽了鳗鱼的产品领域,为鳗鱼钙螯合肽粉的工业化生产提供了一定的理论和技术指导。
[1] 王惠君,张兵,王志宏,等.1991-2009年中国九省区膳食营养素摄入状况及变化趋势(四)50-79岁居民蛋白质摄入状况及变化趋势[J].营养学报,2011,33(5):446-451
WANG Hui-jun, ZHANG Bing, WANG Zhi-hong, et al. The trend of nutrients intake of Chinese residents in nine provinces from 1991 to 2009(Ⅳ) the portein intake trend of chinese adults aged 50-79 years [J]. Journal of Nutrition,2011, 33(5): 446-451
[2] Goda T, Kishi K, Ezawa I, et al. The Maltitol-induced increase in intestinal calcium transport increases the calcium content and breaking force of femoral bone in weanling rats[J]. Journal of Nutrition, 1998, 128(11): 20-28
[3] Cousins R J. Regulation of zinc absorption: role of intracellular ligands. [J]. American Journal of Clinical Nutrition, 1979, 32(2): 339-345
[4] 刘兆钧.鳗鱼营养ABC[J].福建水产,1999,4:85-90
LIU Zhao-jun. Eel Nutrition ABC [J]. Fujian Aquatic Products, 1999, 4: 85-90
[5] 赵辉,徐大伦,周星宇,等.新鲜海鳗营养成分及其风味物质分析[J].食品科学,2010,31(20):278-281
ZHAO Hui, XU Da-lun, ZHOU Xing-yu, et al. Analysis of nutritional and flavor compounds in fresh muraenesox cinereus muscle [J]. Food Science, 2010, 31(20): 278-281
[6] 李书民,谭洪新,孙生智.中国鳗鱼产业发展困局及纾困对策[J].中国渔业经济,2013,31(1):24-28
LI Shu-min, TAN Hong-xin, SUN Sheng-zhi. The dilemma of China's eel industry and the countermeasures [J]. China Fishery Economy, 2013, 31(1): 24-28
[7] 范露,刘茹,熊善柏.鱼蛋白肽钙的分级及肽与钙的结合性能研究[J].食品研究与开发,2015,2:6-9
FAN Lu, LIU Ru, XIONG Shan-bo. Studies on classification of fish protein peptides-calcium and combination between peptide and calcium [J]. Food Research and Development,2015, 2: 6-9
[8] YANG Hui-fen, LI Ming-yuan, SHEN Wen. Physical examination of food hygiene standards manual [M]. Beijing:Standards Press of China, 1998
[9] 刘绍.食品分析与检验[M].武汉:华中科技大学出版社,2011
LIU Shao. Food analysis and inspection [M]. Wuhan:Huazhong University of Science and Technology Press, 2011
[10] 顾敏,赵谋明,王茜,等.青养蛋白抗氧化肽的制备及其胃肠道消化性的研究[J].食品工业科技,2013,34(23):196-200
GU Min, ZHAO Mou-ming, WANG Qian, et al. Research of frog antioxidant peptide and the activity of gastrointestinal digestion [J]. Science & Technology of Food Industry, 2013,34(23): 196-200
[11] Hirokawa T, Nishimoto K, Yang J, et al. Isotachophoretic separation behavior of rare-earth EDTA chelates and analysis of minor rare-earth elements in an iron ore by bidirectional isotachophoresis-particle-induced X-ray emission [J]. Journal of Chromatography A, 2001, 919(2): 417-426
[12] 马世昌.化学物质辞典[M].西安:陕西科学技术出版社,1999 MA Shi-chang. Chemical Dictionary [M]. Xi’an: Shaanxi Science & Technology Press, 1999
[13] 洪惠,罗永康,吕元萌,等.酶法制备鱼骨胶原多肽螯合钙的研究[J].中国农业大学学报,2012,17(1):149-155
HONG Hui, LUO Yong-kang, LV Yuan-meng, et al.Enzymatic preparation of chelated calcium from fish bone collagen polypeptide [J]. Journal of China Agricultural University, 2012, 17(1): 149-155
[14] 夏光华,申铉日,酒志强.罗非鱼皮胶原蛋白小肽螯合钙的制备、鉴定及抗氧化研究[J].食品科技,2013,6:242-246
XIA Guang-hua, SHEN Xuan- ri, JIU Zhi-qiang. Preparation,indentification and antioxidant activity of tilapia fish skin collagen polypeptide chelated calcium [J]. Food Science &Technology, 2013, 6: 242-246
[15] 陈达,霍敏晶,黄文芊,等.牡蛎蛋白酶解物螯合锌的工艺优化[J].农产品加工学刊,2012,10:5-7
CHEN Da, HUO Min-jing, HUANG Wen-qian. Optimization of technology for zinc binding activities of oyster protein hydrolysates [J]. Journal of Agricultural Science and Technology, 2012, 10: 5-7
[16] Nie R, Liu Y, Liu Z. The calcium-binding activity of fish scale protein hydrolysates [J]. Journal of Agricultural Chemistry & Environment, 2014, 3(1): 11-15
[17] 汪婧瑜,刘学铭,张业辉,等.乌鳢酶水解物螯合钙的制备及其结构分析[J].食品工业科技,2016,37(8):206-211
WANG Jing-yu, LIU Xue-ming, ZHANG Ye-hui, et al.Preparation and structural analysis of enzymatic hydrolysate chelated calcium from Channa Argus [J]. Science &Technology of Food Industry, 2016, 37(8): 206-211
[18] 刘闪,刘良忠,李小娜,等.白鲢鱼骨胶原多肽螯合钙的工艺优化[J].食品科学,2014,35(10):76-81
LIU Shan, LIU Liang-zhong, LI Xiao-na, et al. Optimization of the preparation of calcium-chelating polypeptides from silver carp bone collagen [J]. Food Science, 2014, 35(10):76-81
[19] 高菲,王维有,鲁军,等.海洋鱼骨胶原肽钙螯合物的制备及红外光谱表征[J].中国海洋大学学报:自然科学版,2015,45(1):47-54
GAO Fei, WANG Wei-you, LU Jun, et al. Preparation and infrared spectrum identification for marine fish ossein peptide chelated calcium [J]. Periodical of Ocean University of China,2015, 45(1): 47-54 Inwoo B, Kiyoshi O, Asami Y, et al.Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes [J]. Food Chemistry,2008, 108(1): 49-54
