脉冲电场协同酶法制备淀粉锌络合物及其显微结构的研究
2018-03-01韩忠王金花成军虎曾新安
韩忠,王金花,成军虎,曾新安
(1.华南理工大学食品科学与工程学院,广州广东 510640)(2.广东省天然产物绿色加工与产品安全重点实验室,广州广东 510640)
多孔淀粉(porous starch)是一种新型、环境友好型的天然多孔性材料,具有原料来源广泛、成本低、绿色环保、较大的比表面积、较低的堆积密度与良好的吸附性能等诸多优点,被广泛地应用到化工工业、医药卫生、食品工业与农业等领域,引起了国内外研究者的高度关注[1,2]。目前,用来制作多孔淀粉的原料主要是谷类淀粉和根茎类淀粉,而作为全世界尤其是亚洲地区主食之一的大米,其相关研究较少。亚洲人饮食相对而言多菜少肉,造成普遍的锌摄入量不足、吸收不良或者遗传缺陷;而锌元素是人体生理功能所需量仅次于铁排名第二的微量元素,它是机体酶的重要组成成分,间接地调控着基因的表达、免疫、细胞分化和机体生长等生命过程[3~5]。因此,从日常饮食中适当地补充锌元素及在食品工业中添加锌强化剂都是必不可少的。
高压脉冲电场技术(Pulsed Electric Fields,PEF)是一种对两电极间的流态食品反复施加高场强的短脉冲进行处理的技术,属于非热物理技术,能在有效保存食品天然理化性质的同时达到灭菌的效果[6],近来又被用于大分子物质的修饰改性、天然活性成分的提取和化学反应强化等方面[7~10]。从化学反应的角度来看,脉冲电场能够有效地降低各种反应所需的活化能,促进金属离子的螯合效率、淀粉酯化反应效率和美拉德反应初级阶段等[11~14]。因此,本文拟采用传统环保的双酶协同法制备具有强吸附性能的大米多孔淀粉[15],并借助高压脉冲电场促进锌元素与多孔的吸附络合反应,以达到高效富集锌元素的研究目的。
1 材料与方法
1.1 材料与试剂
金龙鱼南方优质丝苗米,益海嘉里粮油食品有限公司;大米淀粉参考Lumdubwong[16]方法改进优化制得;猪胰酶(Cat.No.P7545,活力8×USP/mg),美国Sigma-Aldrich公司;淀粉葡萄糖苷酶(Cat.No.A7095,活力300 Unit/mL),美国Sigma-Aldrich公司;乙酸锌,广州化学试剂厂,分析纯。
1.2 主要仪器
SY-2-500型脉冲电场处理装置,华南理工大学脉冲电场课题组自制;VECTOR33型红外光谱仪,德国Bruker公司;S3700型扫描电子显微镜日本日立公司;日立Z-2000塞曼原子吸收分光光度仪,日本日立公司。
1.3 实验方法
1.3.1 双酶法协同制备大米多孔淀粉
称取一定量大米淀粉,置于100 mL离心管中,加入一定量pH值为4.6的乙酸-乙酸钠缓冲溶液(固液比1:4),置于温度为50 ℃的振荡水浴锅中预热20 min。精确移取一定配比的两种酶加入淀粉悬浊液中,振荡,开始计时,经过一定时间,加入一定量4%氢氧化钠溶液灭酶。淀粉乳离心(5000 r/min,离心10 min)后,吸取1 mL上清液于25 mL的比色管测定吸光度。下层淀粉固体用蒸馏水洗涤、离心三次(5000 r/min,离心10 min),在45 ℃的条件下干燥24 h,之后用粉碎机对淀粉进行粉碎,过100目筛,得到多孔淀粉样品,置于封口袋中保存。
1.3.2 淀粉水解率的测定
吸取1 mL样品于25 mL的比色管中,然后加入2.00 mL DNS溶液。混匀后,置于沸水浴中显色2 min,然后迅速冷却至室温,并用蒸馏水定容到25 mL,摇匀。用准备好的空白液(1 mL缓冲液,2 mL DNS,同上述处理)调零,在540 nm波长下用1 cm比色皿测定吸光度,计算水解率。

式中,C-离心后上清液还原糖浓度,(mg/mL);N-样品稀释倍数;V-反应体系中液相体积,(mL);0.9-从葡萄糖到淀粉的转化系数;W-反应前底物重量,(mg)。
1.3.3 吸油率的测定
精确称量离心管质量m1(g),称取1 g左右淀粉置于离心管中,精确称取其质量m2(g),恒温下与5 mL色拉油搅拌混合20 min,在5000 r/min下离心20 min,弃去上清液,精确称量淀粉质量为m3(g)。按以下公式计算吸油率(%):

1.3.4 脉冲电场协同大米淀粉锌络合物的制备
称取10 g原淀粉(或多孔淀粉)与500 mL的乙酸锌溶液(0.1 mol/L)混合于烧杯中,并置于磁力搅拌水浴锅进行搅拌,在室温下将悬浊液泵入到脉冲电场处理室进行处理(电压20 V、脉宽40 μs、频率1 kHz、流速24 mL/min,有效处理时间分别为2.88×103μs、8.64×103μs、14.4×103μs)后,将悬浊液离心(5000 r/min),弃去上清液,下层淀粉固体用蒸馏水反复洗涤并离心三次后,置于45 ℃电热恒温鼓风干燥箱中干燥24 h,粉碎即得大米多孔淀粉锌络合物样品。
1.3.5 淀粉锌络合物的锌含量的测定
称取淀粉锌络合物约1~5 g于马福炉中灰化,0.5 mol/L的硝酸溶液定容后进行火焰原子吸收光谱法测定。
1.3.6 淀粉锌络合物结构测定
扫描电镜法(SEM)、红外光谱法(FT-IR)。
2 结果与分析
2.1 水解率与比表面积及吸油率之间的关系
比表面积的大小决定着物质的吸附性能,比表面积越大吸附性能就越强,秦莹采用灰色关联度分析,得出了可以通过水解率的测定推测比表面积的变化情况的结论[17],但是比表面积与多孔淀粉的吸附性不具有绝对的正相关性。因此,我们采用水解率和吸油率双重指标来衡量多孔淀粉吸附性的优劣。聂丽红等通过测定不同水解率多孔淀粉的比表面积,探究多孔淀粉水解率与比表面积的关系以及水解率与吸油率的关系[18],其结果如图1所示。
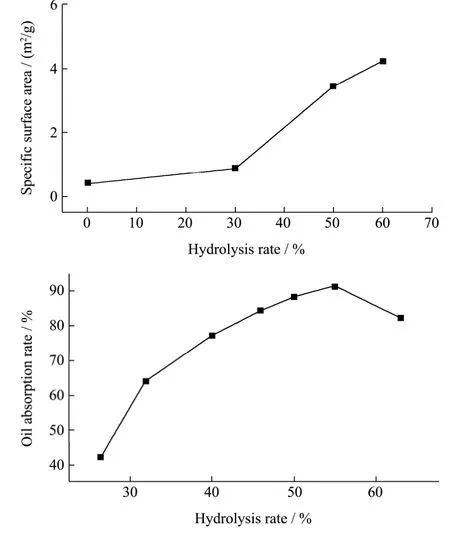
图1 水解率与吸油率及比表面积之间的关系Fig.1 Relationship between the hydrolysis rate (oil-absorption rate) and the specific surface area
由图1可知,随着水解率的上升,比表面积增大,在水解率达到30%以后,比表面积呈现较大增长,这是由于酶解导致淀粉颗粒粒度减小与小孔径增大的双重结果,但这只能体现淀粉水解产生还原糖的量,却不能完全体现成孔吸附性能的好坏。因此,我们再结合吸油率来表征多孔淀粉的吸附性能。随着水解率的上升,形成的空腔的体积越大,多孔淀粉的吸油率上升,当水解率为50%~55%时,多孔的空腔体积达到了淀粉颗粒的一半,此时吸油率最高;在水解率接近60%的时候,多孔淀粉的吸油率呈急剧下降趋势,意味着多孔淀粉的孔结构出现崩塌,失去多孔淀粉本身稳固的机械性质,吸附性能减弱。
2.2 复合酶法制备大米微多孔淀粉工艺条件的优化
2.2.1 酶含量对水解率和吸油率的影响
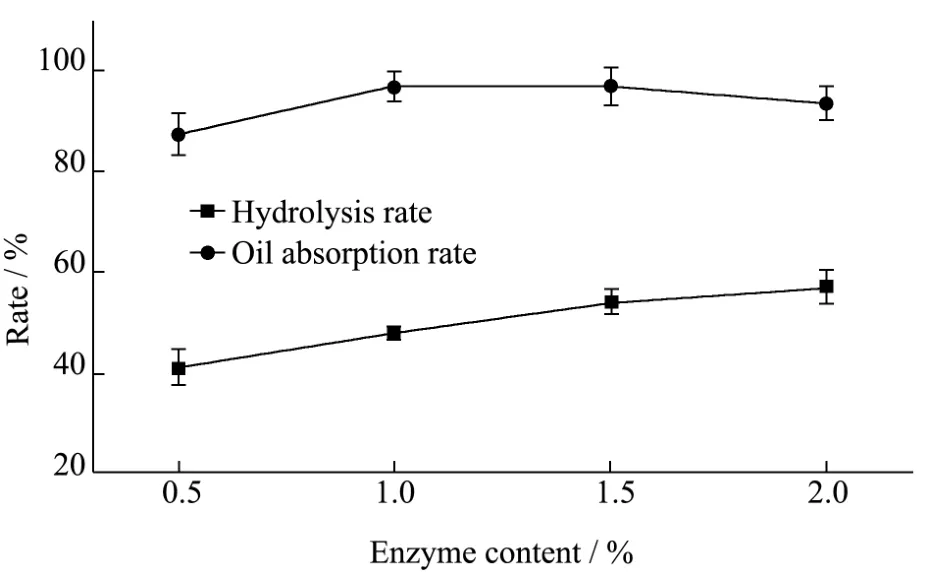
图2 酶含量对水解率和吸油率的影响Fig.2 Effects of enzyme content on the hydrolysis rate and oil-absorption rate
在底物浓度为20%(m/m),反应温度50 ℃,反应时间12 h,pH为4.6的乙酸-乙酸钠缓冲溶液,酶配比(α-淀粉酶:葡萄糖苷酶)为1:12的实验条件下,研究酶含量(0.5%、1.0%、1.5%和2.0%)对水解率和吸油率的影响,结果如图2所示。
由图2可知,随着酶含量的增加,水解率不断上升,吸油率先上升后下降,在酶含量为1.0%时,多孔淀粉水解率达到50%,孔空腔体积接近淀粉颗粒体积的一半,此时,吸油率达到最大。此后,随着水解率的增大,吸油率呈现下降趋势,与图1结果一致,由于淀粉水解过度导致的多孔结构崩塌所致,因此,制备多孔淀粉的最佳酶含量为1.0%。
2.2.2 酶配比对水解率和吸油率的影响
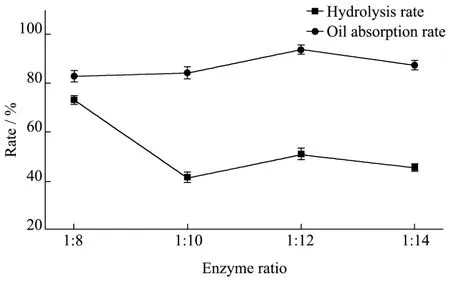
图3 酶配比对水解率和吸油率的影响Fig.3 Effects of the enzyme ratio on the hydrolysis rate and oil-absorption rate
在底物浓度为20%(m/m),反应温度50 ℃,反应时间12 h,pH为4.6的乙酸-乙酸钠缓冲溶液,酶含量为1.0%的条件下,研究酶配比(α-淀粉酶:葡萄糖苷酶)对水解率和吸油率的影响,结果见图3。
由图3可知,在酶配比为1:8时,水解率超出50%,淀粉结构被破坏,吸油率较低,当酶配比为1:12时,水解率达到50%左右,多孔淀粉吸油率达到峰值。酶配比的变化导致水解率和吸油率的变化主要是由于两种酶之间存在着协同作用,α-淀粉酶是采用随机切断糖链内部的α-1,4-链的水解方式,当其比例较高时就容易出现水解过度、成孔不均的现象,从而导致多孔淀粉的吸油率降低;所以,选择适宜的酶配比对多孔淀粉的成孔均匀性起着至关重要的作用,因此,制备多孔淀粉的最佳酶配比(α-淀粉酶:葡萄糖苷酶)为1:12。
2.2.3 酶解时间对水解率和吸油率的影响
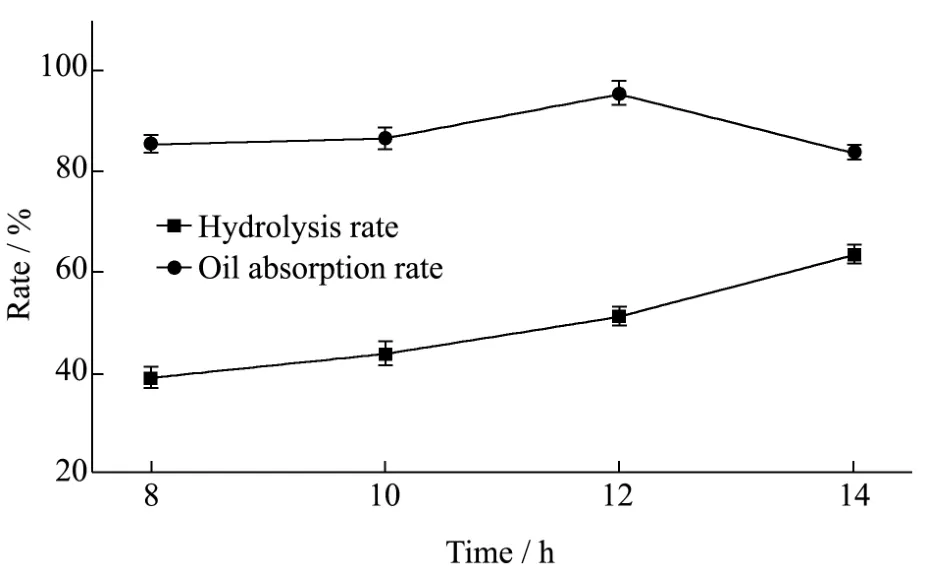
图4 酶解时间对水解率和吸油率的影响Fig.4 Effects of enzymolysis time on the hydrolysis rate and oil-absorption rate
在底物浓度为20%(m/m),反应温度50 ℃,酶配比(α-淀粉酶:葡萄糖苷酶)为1:12,pH 4.6的乙酸-乙酸钠缓冲溶液,酶含量为1.0%的条件下,研究处理时间(8 h、10 h、12 h和14 h)对水解率和吸油率的影响。由图4可知,随着酶解时间的增加,水解率逐渐增大,而吸油率呈现先上升后下降的趋势,当酶解时间为12 h时,水解率为50%左右,吸油率达到峰值.当酶解时间增加到14 h时,水解率继续增加,但吸油率已出现快速下降,这说明长时间的酶解导致多孔淀粉结构崩塌。因此,制备多孔淀粉的最佳酶解时间为12 h。
2.2.4 正交优化多孔大米淀粉的制备
在单因素试验的基础上,采用L9(33)正交试验来考察酶含量、酶配比和酶解时间对多孔淀粉吸油率的影响,正交实验水平因素表如表1所示。
由表2可知,三个因素对淀粉水解率的影响主次顺序依次为:酶含量>酶配比>酶解时间,最佳条件为A2B2C2,三个因素对淀粉吸油率的影响主次顺序依次为:酶解时间>酶配比>酶添加量,最佳条件为A2B2C2,综上所述,双酶协同制备大米多孔淀粉工艺的最佳条件为A2B2C2,即酶含量1.0%,酶配比(α-淀粉酶:葡萄糖苷酶)1:12,酶解时间12 h。经验证实验得:最佳条件下可制得水解率50%、吸油率96.3%的大米多孔淀粉。

表1 正交实验水平因素表Table 1 Orthogonal experiment level factors

表2 正交实验设计及实验结果Table 2 Orthogonal experiment design and results
2.3 脉冲电场协同制备大米多孔淀粉锌络合物
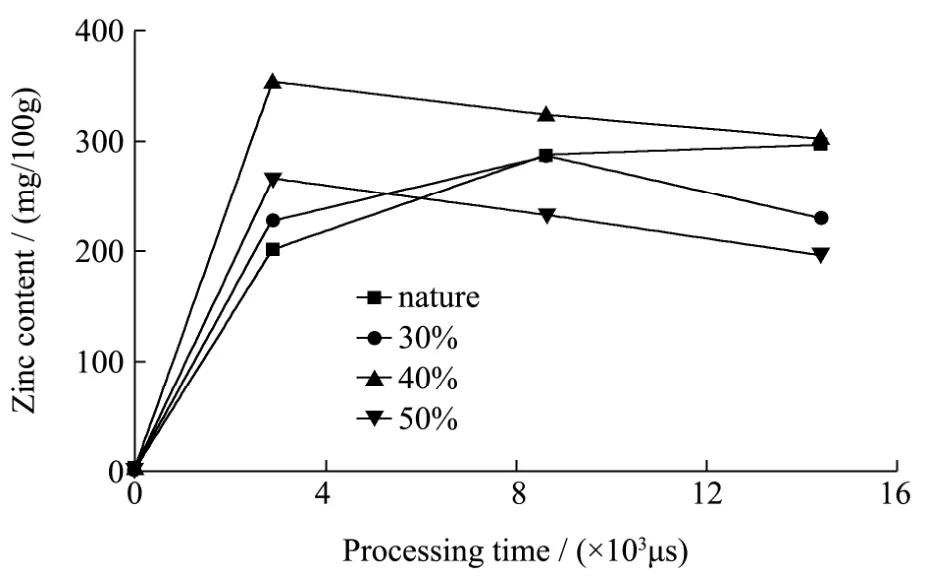
图5 不同脉冲电场处理时间对淀粉锌络合量的影响Fig.5 Effects of PEF treatment time on the znic content of starch-Zn complex
由图5可知,原淀粉本身的锌含量非常少,且随着电场处理时长的增加,淀粉的锌络合量呈现逐步增加的趋势,很明显地体现了脉冲电场处理对锌络合反应的促进作用。产生此现象的原因有二,其一为电场本身的电击穿作用导致的淀粉表面破损,使得参与金属离子络合反应的比表面积增大;其二,脉冲电场具有产生瞬时高能的作用,可以促使淀粉颗粒无定型通道的张开,从而牵引锌离子进入淀粉颗粒内部进行络合配位反应。
其中,从脉冲电场强化不同水解率的多孔大米淀粉的锌络合反应来看:40%水解率、电场处理2.88 ms的多孔淀粉锌络合物中锌含量最高,其次是30%水解率、电场处理8.64 ms的多孔淀粉锌络合物,50%水解率、电场处理2.88 ms的多孔淀粉锌络合物中锌含量最低;40%水解率的多孔淀粉锌络合物中锌含量都高于50%水解率淀粉的,且随着电场处理时间的增加而减少;这是由于低水解率的多孔淀粉具有多孔吸附和高无定形区金属离子配位点的双重特点所致,此外高水解率的多孔淀粉孔隙结构机械强度相对较低,在强电场作用下容易出现崩塌,从而导致其锌离子络合能力降低[20,21]。
?
2.4 脉冲电场协同制备大米多孔淀粉锌络合物的形态观察

图6 扫描电镜图Fig.6 Scanning electron microscopy photographs
时间的增加,淀粉颗粒表面变得粗糙甚至出现一些坑洞。图6e~f分别为40%水解率的多孔淀粉在脉冲电场(2.88 ms和8.64 ms)协同下进行锌络合反应之后的扫描电镜图由图可知,酶解淀粉具有更多的空隙,这是双酶协同水解淀粉颗粒的无定形区的结果[19],同时,比表面积的增大有助于其对锌元素的吸附及脉冲电场的强化络合作用。但随着脉冲电场处理时间的增加,相同水解率的淀粉空隙出现部分崩塌,与结果2.3中40%水解率的多孔淀粉在脉冲电场处理下,时间越长、锌络合量越低相符合。
2.5 大米多孔淀粉锌络合物的红外光谱分析(FT-IR)
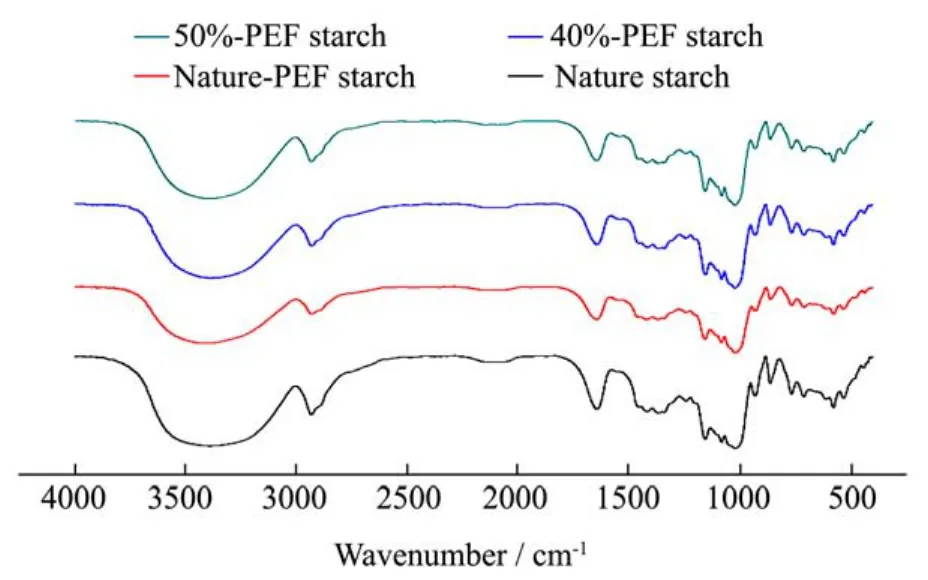
图7 大米淀粉及不同处理条件下淀粉锌络合物的红外衍射图Fig.7 Infrated diffraction patterns of rice starch and starch-Zncomplex with different treatments
红外光谱分析能够有效的鉴别有机物中的官能团,图7分别为原淀粉、原淀粉锌络合物、40%水解率-PEF多孔淀粉锌络合物,50%水解率-PEF多孔淀粉锌络合物的红外光谱图。
淀粉的结构特征在红外光谱图中的红外吸收峰位置及结构归属分别为:3377 cm-1为氢键缔合的O-H伸缩振动,该峰宽而强;2931 cm-1为CH2的C-H不对称伸缩振动吸收峰;1643 cm-1为H20的弯曲振动吸收峰;1340 cm-1~1500 cm-1为CH2的弯曲振动吸收峰;1150 cm-1~978 cm-1主要归属于淀粉各羟基的C-O伸缩振动和环醚C-O-C吸收峰;1018 cm-1、1081 cm-1和1157 cm-1分别是伯醇、仲醇和叔醇的C-O伸缩振动吸收特征峰;578 cm-1、761 cm-1和854 cm-1等处是-CH2的摇摆振动吸收特征峰。
原淀粉、原淀粉锌络合物、40%水解率-PEF多孔淀粉锌络合物和50%水解率-PEF多孔淀粉锌络合物的红外图谱吸收峰大部分是相同的,说明基本骨架相同。与原淀粉相比,原淀粉锌络合物淀粉、经脉冲电场作用的多孔淀粉锌络合物与乙酸盐作用主要影响羟基伸缩振动,伯醇的C-O伸缩振动吸收特征峰移动明显,而仲醇C-O伸缩振动吸收特征峰和叔醇C-O伸缩振动吸收特征峰变化不明显,说明Zn与淀粉羟基相互作用,伯醇OH参与反应,仲、叔醇-OH可能参与反应。与原淀粉相比,淀粉锌络合物的羟基伸缩振动变化明显,说明锌离子与淀粉羟基基发生反应。
3 结论
3.1 以水解率和吸油率为指标,通过单因素与正交试验得到了多孔大米淀粉最优工艺条件:酶含量1.0%、酶配比1:12、酶解12 h,此时,多孔大米淀粉的水解率为50%,吸油率为96.3%。同时,利用脉冲电场处理强化多孔淀粉锌络合反应,结果显示:水解率40%的多孔大米淀粉经脉冲电场(2.88×103μs)处理后的锌络合含量最高,为352.85 mg/100 g。
3.2 借助扫描电镜可观察到:酶解使淀粉呈现随机性的多孔,脉冲电场进一步加强了原淀粉与30%和40%水解率淀粉多孔的形成与吸附能力,而水解率达到50%的多孔淀粉在脉冲电场的处理下会出现空隙崩塌,导致其锌络合量下降。红外光谱显示:淀粉锌络合物相对于原淀粉而言,羟基伸缩振动变化明显,说明锌离子与淀粉羟基发生了配位反应。
[1] 张斌,陈国.多孔淀粉制备工艺及应用研究进展[J].食品工业科技,2012,2:399-403
[2] Rizzi G P. Modified porous starch: U.S. Patent 6,147,028 [P].2000-11-14
[3] Li B, Cui W, Tan Y, et al. Zinc is essential for the transcription function of Nrf2 in human renal tubule cells in vitro and mouse kidney in vivo under the diabetic condition[J]. Journal of Cellular and Molecular Medicine, 2014, 18(5):895-906
[4] Prasad A S, Bao B, Beck F W J, et al. Antioxidant effect of zinc in humans [J]. Free Radical Biology and Medicine, 2004,37(8): 1182-1190
[5] Bao B, Prasad A S, Beck F W J, et al. Zinc decreases C-reactive protein, lipid peroxidation, and inflammatory cytokines in elderly subjects: a potential implication of zinc as an atheroprotective agent [J]. The American Journal of Clinical Nutrition, 2010, 91(6): 1634-1641
[6] Barba F J, Parniakov O, Pereira S A, et al. Current applications and new opportunities for the use of pulsed electric fields in food science and industry [J]. Food Research International, 2015, 77: 773-798
[7] Lin Z R, Zeng X A, Yu S J, et al. Enhancement of Ethanol-Acetic Acid Esterification Under Room Temperature and Non-catalytic Condition via Pulsed Electric Field Application [J]. Food and Bioprocess Technology, 2012, 5(7):2637-2645
[8] Zhang T, Wang S, Liu D, et al. Optimization of exopolysaccharide extraction process from Tibetan spiritual mushroom by pulsed electric fields [J]. Journal of Jilin University (Engineering and Technology Edition), 2011,41(3): 52
[9] 唐超.脉冲电场臭氧协同处理装置设计及降解壳聚糖应用研究[D].广州:华南理工大学,2011
[10] Han Z, Zeng X A, Zhang B S, et al. Effects of pulsed electric fields (PEF) treatment on the properties of corn starch [J].Journal of Food Engineering, 2009, 93: 318-323
[11] Han Z, Zeng X A, Yu S J, et al. Effects of pulsed electric fields (PEF) treatment on physicochemical properties of potato starch [J]. Innovative Food Science and Emerging Technologies, 2009, 10(4): 481-485
[12] Zeng X A, Han Z, Zi Z H. Effects of PEF on quality of peanut oil [J]. Food Control, 2010, 21(5): 611-614
[13] Hong J, Chen R J, Zeng X A, et al. Effect of pulsed electric fields assisted acetylation on morphological, structural and functional characteristics of potato starch [J]. Food Chemistry,2016, 192: 15-24
[14] Hong J, Zeng X A, Buckow R, et al. Nanostructure,morphology and functionality of cassava starch after pulsed electric fields assisted acetylation [J]. Food Hydrocolloids,2016, 54: 139-150
[15] Shariffa Y N, Karim A A, Fazilah A, et al. Enzymatic hydrolysis of granular native and mildly heat-treated tapioca and sweet potato starches at sub-gelatinization temperature[J]. Food Hydrocolloids, 2009, 23(2): 434-440
[16] Lumdubwong N, Seib P A. Rice starch isolation by alkaline protease digestion of wet-milled rice flour [J]. Journal of Cereal Science, 2000, 31(1): 63-74
[17] 秦莹.木薯微孔淀粉成孔机理及其性能研究[D].南宁:广西大学,2006
[18] 聂丽红.营养强化剂一淀粉锌络合物的制备及特性研究[D].广州:华南理工大学,2010
[19] 李永平.多孔淀粉颗粒空腔结构及其晶体结构的研究[J].粮食加工,2016,4:44-48
[20] Ciesielski W, Lii C, Yen M T, et al. Interactions of starch with salts of metals from the transition groups [J]. Carbohydrate Polymers, 2003, 51(1): 47-56
[21] Ciesielski W, Tomasik P. Complexes of amylose and amylopectins with multivalent metal salts [J]. Journal of Inorganic Biochemistry, 2004, 98(12): 2039-2051
