猪繁殖与呼吸综合征病毒NSP12蛋白的表达与鉴定
2018-03-01张文超虞凌雪姜一峰黄勤峰李丽薇李慧春陈鹏飞杨德强童光志杜雅楠周艳君
张文超,虞凌雪,姜一峰,高 飞,黄勤峰,李丽薇,李慧春,陈鹏飞,杨德强,刘 欢,童光志,杜雅楠,周艳君
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.中国农业科学院上海兽医研究所,上海 200241)
猪繁殖与呼吸综合征病毒NSP12蛋白的表达与鉴定
张文超1,2,虞凌雪2,姜一峰2,高 飞2,黄勤峰2,李丽薇2,李慧春2,陈鹏飞2,杨德强2,刘 欢2,童光志2,杜雅楠1,周艳君2
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.中国农业科学院上海兽医研究所,上海 200241)
本研究扩增了高致病性猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)HuN4株的NSP12基因,将其克隆于pCold-I载体中,获得重组质粒pCold-I-NSP12,并转化于E.coli/BL21感受态细胞,在16℃条件下用1 mmol/L的IPTG诱导20 h后,用SDS-PAGE电泳检测表达产物,结果显示在大约18 kDa处出现目标蛋白。用PRRSV特异性阳性猪血清对表达蛋白进行Western blot鉴定,结果显示该蛋白可以被PRRSV阳性猪血清识别。将重组NSP12蛋白纯化后,免疫6周龄BALB/c小鼠制备多克隆抗体。在MARC-145细胞中,对获得的NSP12多抗血清分别进行Western blot和间接免疫荧光检测(indirect immuno fl uorescence assay,IFA)鉴定,结果显示本研究制备的NSP12多抗血清均可与感染的MARC-145细胞的PRRSV HuN4株以及在MARC-145细胞中特异表达的NSP12蛋白发生免疫反应。PRRSV NSP12蛋白的表达及其多克隆抗体的制备为进一步研究NSP12在病毒感染过程中的作用奠定了基础。
猪繁殖与呼吸综合征病毒;NSP12;原核表达;多抗
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种急性、高度接触性传染病[1]。PRRSV在1987年于美国首次报道[2],感染后临床症状主要为发烧、呼吸困难、耳朵发绀、厌食、肺损伤和流产等[3]。PRRS至今仍是全球养猪业的重要威胁[4]。PRRSV基因组全长约15 kb,包含ORF1a、ORF1b、ORF2~ORF7等10个开放性阅读框(open read frame,ORF)。其中ORF1a和ORF1b编码复制多聚蛋白pp1a和pp1ab,而复制多聚蛋白可进一步被自剪切成NSP1~NSP12一系列非结构蛋白(nonstructural protein,NSP)。目前已有研究证实非结构蛋白NSP1α、NSP1β、NSP2、NSP4、NSP11都有抑制I型干扰素表达的作用[5],其中NSP2突变频率较高,对病毒的复制有重要作用[6];NSP9是PRRSV中高度保守的RNA依赖的RNA聚合酶[7],主要参与病毒RNA转录和复制过程;NSP10是解旋酶;NSP11是核酸内切酶[8]。有研究认为Nsp9和Nsp10是HP-PRRSV毒力相关主要基因[9]。关于NSP12功能研究相对较少。Yu等[10]研究证明NSP12可以使转录激活因子727位丝氨酸(pSTAT1-S727)磷酸化增加,且诱导IL-1β和IL-8的表达,但抑制机制尚未解析。王蓉等[11]研究认为NSP12、GP3和N蛋白对干扰素刺激应答元件(ISRE)启动子有抑制作用,这几个蛋白的共同作用可以抑制干扰素介导的抗病毒作用,从而为病毒复制获得时间。本实验室前期试验证实NSP12蛋白能够抑制IFN-β的表达,但其作用机理尚未完全明确[12]。为了进一步探讨NSP12蛋白的功能,本研究对NSP12蛋白进行了表达并制备特异性多抗,为后期研究NSP12蛋白在病毒感染中的作用提供试验材料。
1 材料与方法
1.1 病毒、载体与试验动物 PRRSV HuN4株、PRRSV阳性猪血清和真核表达载体pCAGGS-NSP12由本实验室构建并保存;冷休克表达载体pCold-Ⅰ购自TaKaRa公司;6周雌性BALB/c小鼠购自上海斯莱克公司。
1.2 主要试剂 RNA提取试剂盒、胶回收试剂盒及质粒提取试剂盒购自QIAGEN公司;反转录试剂盒、蛋白预染Marker购自Thermo公司;EX Taq购自TaKaRa公司;限制性内切酶XhoI和EcoR I购自NEB公司;弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司;BCA蛋白浓度测定试剂盒购自碧云天公司;HRP标记山羊抗猪IgG抗体购自Santa Cruz公司。
1.3 NSP12基因的扩增 根据GenBank中PRRSV HuN4株核苷酸序列(登录号:EF635006)[13],利用Primer premier 5.0软件设计1对针对NSP12基因的特异性引物(表1)。提取PRRSV HuN4株基因组RNA,反转录合成cDNA后,利用合成的NSP12-F/NSP12-R引物对进行PCR扩增,反应条件:95℃预变性5 min;94℃变性1 min,56℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。

表1 HP-PRRSV NSP12引物序列Table 1 Primers designed to amplify the HP-PRRSV Nsp12 gene
1.4 表达载体的构建 胶回收RT-PCR扩增获得的PCR片段,经XhoI和EcoR I双酶切后连接至经同样双酶切处理的冷休克表达载体pCold-I,连接产物转化于E.coli/BL21感受态菌株中,经挑菌、摇菌,提质粒,表达载体分别进行PCR、双酶切鉴定和质粒测序鉴定(由上海生物工程公司进行测序验证)。
1.5 蛋白的表达与鉴定 将阳性重组菌株接种于含有氨 抗性的培养基中,37℃振荡培养至OD260为0.6~1.0,加入终浓度为1 mmol/L的IPTG,在16℃恒温振荡诱导不同时间,分别收获诱导表达产物,进行SDS-PAGE电泳检测最佳诱导条件;将表达产物转印至NC膜上,用5%脱脂乳室温封闭3 h,利用1∶5000稀释的抗PRRSV阳性猪血清作为一抗,1∶10 000稀释HRP标记的羊抗猪IgG作为二抗,进行Western blot鉴定,通过化学发光法显色观察检测结果。
1.6 NSP12蛋白多抗的制备及鉴定 利用BCA浓度试剂盒测定纯化后的NSP12蛋白浓度,按100 μg/只的剂量与等量弗氏佐剂乳化,按常规小鼠免疫小时程序免疫6周龄BALB/c小鼠。经3次免疫后,采集并分离免疫鼠血清。分别利用PRRSV HuN4株感染48 h后的MARC-145细胞和将真核载体pCAGGS-NSP12转染48 h后的MARC-145细胞,经80%的冷乙醇固定后,对制备的NSP12多抗进行间接免疫荧光检测(indirect immunofluorescence assay,IFA)。同时分别提取HuN4株感染的MARC-145细胞总蛋白,以及真核载体pCAGGS-NSP12转染的MARC-145细胞总蛋白,对制备的NSP12多抗进行Western blot鉴定。
2 结果
2.1 pCold-NSP12表达载体的鉴定 以PRRSV HuN4株的cDNA为模板,利用特异性引物NSP12-F/NSP12-R扩增NSP12基因,结果显示,可以扩增出大小约为480 bp左右的目的片段。将其克隆至pCold I载体中,经XhoI/EcoR I双酶切酶切鉴定,结果显示,重组质粒可以被酶切成大小约为480 bp和4400 bp左右的两个片段,且测序结果与预期目标基因序列完全一致,将获得阳性表达质粒命名为pCold-NSP12。
2.2 NSP12蛋白的表达与鉴定 将阳性菌株诱导表达产物进行SDS-PAGE电泳,结果显示,在大约18 kDa的位置出现特异性蛋白条带,大小与预期相符,且该蛋白诱导36 h后表达量较高(图1)。将表达产物转印至NC膜上,利用抗PRRSV阳性猪血清作为一抗,进行Western blot鉴定,结果显示,抗PRRSV阳性猪血清能够特异性识别表达NSP12蛋白(图2)。

图1 NSP12重组蛋白的表达及纯化Fig.1 Prokaryotic expression and puri fi cation of the recombinant NSP12 protein

图2 pCold-NSP12免疫原性的检测Fig.2 Detection of recombinant NSP12 protein by Western blot
2.3 NSP12多抗的IFA鉴定 以表达纯化后的NSP12蛋白为抗原免疫Balb/c小鼠,经3次免疫后制备抗NSP12蛋白的多抗。利用抗NSP12蛋白的多抗对PRRSV HuN4株感染48 h后的MARC-145细胞进行IFA检测,结果显示该多抗可以特异性识别HuN4株感染的MARC-145细胞。为了进一步确定该多抗白多抗分别对PRRSV HuN4株感染的MARC-145细胞和真核表达质粒pCAGGS-NSP12转染的MARC-145细胞进行Western blot鉴定,结果显示,在大约18 kDa左右均可检测到特异性蛋白条带,表明该多抗可以特异性识别PRRSV所表达的NSP12蛋白(图4)。的特异性,利用抗NSP12蛋白的多抗对真核表达质粒pCAGGS-NSP12转染48 h后的MARC-145细胞进行IFA检测,结果显示,该多抗可以特异性识别pCAGGS-NSP12转染的MARC-145细胞(图3)。
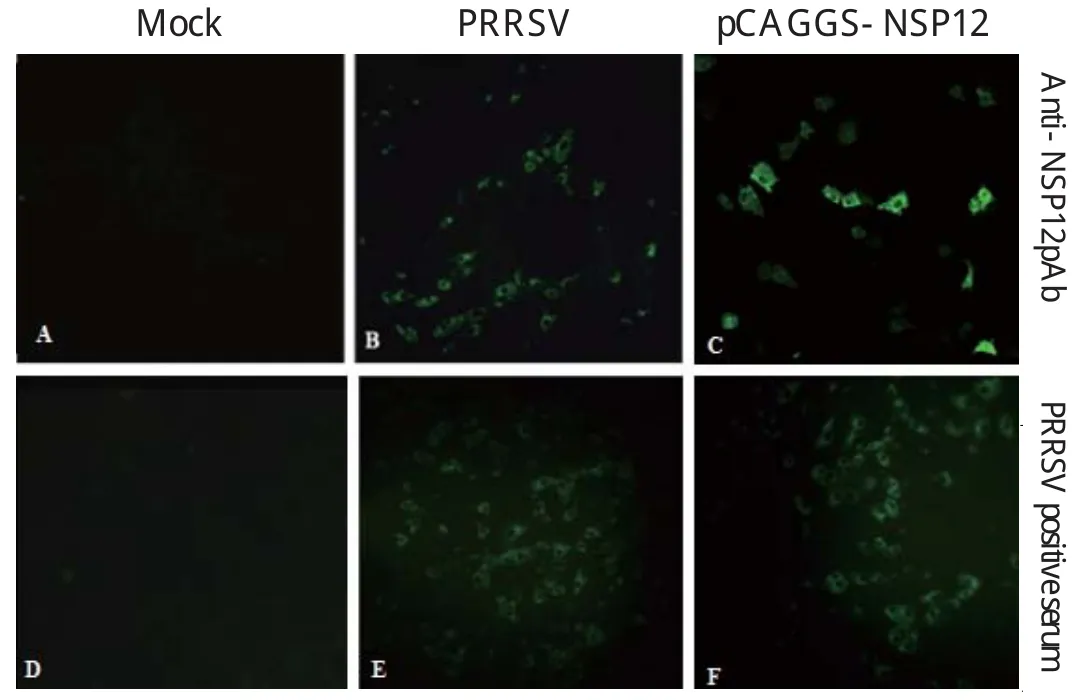
图3 抗NSP12蛋白多抗的IFA鉴定Fig.3 Detection the expression of NSP12 with the pAbs using IFA
2.4 NSP12多抗的Western blot鉴定 利用抗NSP12蛋
3 讨论
PRRSV是有囊膜的、单股正链RNA病毒[14],PRRSV感染具有免疫抑制和持续感染的特性[15],其原因可能是病毒感染会对干扰素信号通路产生抑制,进而抑制宿主天然免疫,延迟中和抗体的产生,从而使病毒难以清除,造成持续感染。NSP12蛋白作为PRRSV的一个非结构蛋白,其功能尚不完全清楚。有研究人员运用高通量测序的方法筛选并鉴定出PRRSV在其感染的靶细胞—猪肺泡巨噬细胞中与NSP12相互作用的蛋白HSP70,经分析认为NSP12可能与病毒复制有关[16]。同时在对与PRRSV病毒同属的马动脉炎病毒(Equine Arteritis virus,EVA)的研究中显示,NSP12对病毒的复制具有重要作用[17]。为了进一步探索PRRS病毒NSP12蛋白在病毒感染中的作用,本研究利用pCold-I载体成功地表达了NSP12蛋白。Western blot显示,表达的蛋白可被PRRSV猪阳性血清识别,表明其具有较好的免疫原性。在低温诱导的条件下,NSP12蛋白可以获得高效表达,其中少量呈可溶性表达,大部分是以包涵体的形式存在。将表达的蛋白经尿素溶解变性和透析复性后,可获得高纯度的NSP12蛋白。为了进一步确定该蛋白的活性,将纯化后的蛋白免疫小鼠,制备了针对PRRSV NSP12的多抗。经Western blot和IFA检测证实该多抗可以识别病毒在感染MARC-145细胞中表达的NSP12蛋白,也能识别单基因真核表达的NSP12蛋白。本研究表达的NSP12蛋白抗原性较好,获得的多抗特异性强,可以作为今后开展对NSP12蛋白功能研究的辅助工具。
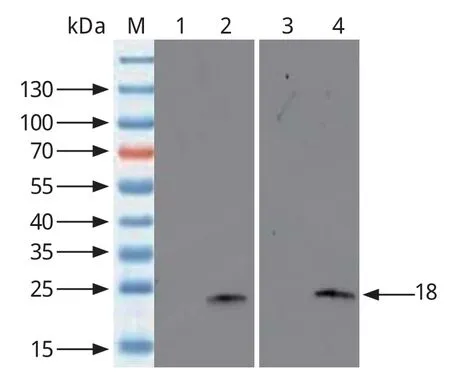
图4 NSP12蛋白多抗的Western blot鉴定Fig.4 Western blot analysis of the anti-NSP12 polyclonal antibody
[1]Wang T, Wang X, Li X,et al. Intranasal inoculation of sows with highly pathogenic Porcine reproductive and respiratory syndrome virus at mid-gestation causes transplacental infection of fetuses[J]. Vet Res, 2015,46(1): 142.
[2]Keffaber K K. Reproductive failure of unknown etiology[J]. Am Assoc Swine Pract Newsl, 1989, 1: 1-9.
[3]Tong G Z, Zhou Y J, Hao X F,et al. Highly pathogenic porcine reproductive and respiratory syndrome, China[J].Emerg Infect Dis, 2007, 13(9): 1434-1436.
[4]Nieuwenhuis N, Duinhof T F, van Nes A. Economic analysis of outbreaks of Porcine reproductive and respiratory syndrome virus in nine sow herds[J]. Vet Rec,2012, 170(9): 225.
[5]Sun Y, Han M, Kim C,et al. Interplay between interferon-mediated innate immunity and Porcine reproductive and respiratory syndrome virus[J]. Viruses,2012, 4(4): 424-446
[6]Fang Y, Snijder E J. The PRRSV replicase: exploring the multifunctionality of an intriguing set of nonstructural proteins[J]. Virus Res, 2010, 154(1): 61-76
[7]Zhou Y, Zheng H H, Gao F,et al. Mutational analysis of the SDD sequence motif of a PRRSV RNA-dependent RNA polymerase[J]. Sci China Life Sci, 2011, 54(9):870-879.,
[8]Snijder E J, Meulenberg J J. The molecular biology of arteriviruses[J]. J Gen Virol, 1998, 79(5): 961-979.
[9]Li Y, Zhou L, Zhang J,et al. Nsp9 and Nsp10 contribute to the fatal virulence of highly pathogenic Porcine reproductive and respiratory syndrome virus emerging in China[J]. PLoS Pathog, 2014, 10(7): e1004216.
[10]Yu Y, Wang R, Nan Y,et al. Induction of STAT1 phosphorylation at serine 727 and expression of proinflammatory cytokines by Porcine reproductive and respiratory syndrome virus[J]. PloS One, 2013, 8(4):e61967.
[11]Wang R, Nan Y, Yu Y,et al. Variable interference with interferon signal transduction by different strains of Porcine reproductive and respiratory syndrome virus[J].Vet Microbiol, 2013, 166(3): 493-503.
[12]王鑫. 猪繁殖与呼吸综合征病毒感染对I型干扰素表达影响的分析[D]. 北京: 中国农业科学院. 2016.
[13]Zhou Y J, Hao X F, Tian Z J,et al. Highly virulent Porcine reproductive and respiratory syndrome virus emerged in China[J]. Transbound Emerg Dis, 2008, 55(3-4): 152-64.
[14]Cavanagh D. Nidovirales: a new order comprising Coronaviridae and Arteriviridae[J]. Arch Virol, 1997,142(3): 629-633.
[15]Dong J, Xu S, Wang J,et al. Porcine reproductive and respiratory syndrome virus 3C protease cleaves the mitochondrial antiviral signalling complex to antagonize IFN-β expression[J]. J Gen Virol, 2015, 96(10): 3049-3058.
[16]Dong S, Liu L, Wu W,et al. Determination of the interactome of non-structural protein12 from highly pathogenic Porcine reproductive and respiratory syndrome virus with host cellular proteins using high throughput proteomics and identification of HSP70 as a cellular factor for virus replication[J]. J Proteomics, 2016, 146:58-69.
[17]Lehmann K C, Hooghiemstra L, Gulyaeva A,et al. Arterivirus Nsp12 versus the coronavirus nsp16 2′-O-methyltransferase: comparison of the C-terminal cleavage products of two nidovirus pp1ab polyproteins[J].J Genl Virol, 2015, 96(9): 2643-2655.
PROKARYOTIC EXPRESSION AND IDENTIFICATION OF NONSTRUCTURAL PROTEIN 12 OF PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME VIRUS
ZHANG Wen-chao1,2, YU Ling-xue2, JIANG Yi-feng2, GAO Fei2, HUANG Qin-feng2, LI Li-wei2,LI Hui-chun2, CHEN Peng-fei2, YANG De-qiang2, LIU Huan2, TONG Guang-zhi2, DU Ya-nan1,ZHOU Yan-jun2
(1. College of Veterinary Medicine, Inner Mongolia Agricultural University, Hohhot 010018, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The non-structural protein12 (NSP12) of Porcine reproductive and respiratory syndrome virus (PRRSV) was ampli fi ed and cloned into the pCold-I vector. The recombinant plasmid pCold-Nsp12 was then transformed into E.coli/BL21 cells and induced with 1 mmol/L isopropyl β -D-thiogalactoside (IPTG) at 16℃ for 20 h. The recombinant protein was purified and identified with SDS-PAGE as about 18kDa band and also recognized in Western blotting using PRRSV antisera. Subsequently, the purified recombinant Nsp12 protein was administered into 6-week-old BALB/c mice for production of polyclonal antibodies. The antisera collected from these immunized mice speci fi cally reacted with PRRSV HuN4 strain and NSP12 protein expressed in MARC-145 in IFA and Western blotting.The present study laid a basis for further study on the role of NSP12 in PRRSV infection.
Porcine reproductive and respiratory syndrome virus, NSP12, prokaryotic expression, polyclonal antibody
S852.659.6
A
1674-6422(2018)01-0032-05
2017-03-22
973 计划项目(2014CB542702);国家科技支撑计划课题(2015BAD12B01-1);国家生猪现代产业技术体系项目(CARS-36)
张文超,女,硕士研究生,预防兽医学专业
周艳君,E-mail:yjzhou@shvri.ac.cn;杜雅楠,E-mail:yanandu@126.com
