PRRSV N蛋白抗原肽的预测、合成以及针对该抗原肽抗体的制备和应用
2018-03-01张彦兵石元元李玉明魏建超邵东华李蓓蓓童光志马志永邱亚峰
相 笑,张彦兵,石元元,李玉明,刘 珂,魏建超,邵东华,李蓓蓓,童光志,马志永,邱亚峰
(中国农业科学院上海兽医研究所,上海 200241)
PRRSV N蛋白抗原肽的预测、合成以及针对该抗原肽抗体的制备和应用
相 笑,张彦兵,石元元,李玉明,刘 珂,魏建超,邵东华,李蓓蓓,童光志,马志永,邱亚峰
(中国农业科学院上海兽医研究所,上海 200241)
基于生物信息学、化学合成技术和免疫学技术,利用预测的抗原肽进行抗体的制备已被广泛地应用。本研究探讨了利用预测的抗原肽制备针对PRRSV N蛋白的特异性抗体。首先,利用生物学软件对高致病性猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)N蛋白进行抗原性预测,获得一个位于蛋白N端16个氨基酸的候选抗原肽。通过BLAST比对,发现该抗原肽在不同北美型毒株中高度保守。其次,采用Fmoc固相法进行抗原肽合成,并将合成的抗原肽通过MBS法偶联到KLH载体蛋白上。随后,将偶联好的抗原肽与弗氏完全佐剂或不完全佐剂混合,免疫新西兰大白兔,制备抗血清,并利用IgG亲和层析的方法纯化抗体。最后,利用ELISA、Western blot和间接免疫荧光法(indirect immuno fl uorescence assay,IFA)对抗体的特异性进行检测,结果显示,利用偶联好的抗原肽包被ELISA板,检测抗体的滴度,纯化抗体的滴度超过105;Western blot结果显示,该抗体(1∶2000)可以特异地识别PRRSV感染的Marc145细胞中的N蛋白,重要的是该抗体可以与不同毒株反应;IFA检测显示,该纯化的抗体(1∶100)可以检测PRRSV感染的细胞。因此,利用生物信息学软件预测的PRRSV N蛋白的抗原肽,能有效地应用于抗PRRSV N蛋白抗体的制备,制备的抗体不仅为研究PRRSV N蛋白奠定基础,而且为研究PRRSV与细胞相互作用提供了一个有效的工具。
猪繁殖与呼吸综合征病毒;核衣壳蛋白;抗原肽;抗体
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)属于套式病毒目(Nidovirales)、动脉炎病毒科(Arteriviridae)、动脉炎病毒属(Arterivirus),为单股正链不分节段的RNA病毒[1]。PRRSV首先由荷兰科学家分离得到,有囊膜,病毒粒子呈卵圆形或球形,为二十面体对称结构,直径大小为48~83 nm[2]。病毒基因组全长为15.4 kb,包括至少10个开放阅读框,分别为ORF1a、ORF1b、ORF2~ORF7[3,4]。ORF1a和ORF1b约占病毒基因组的80%,编码病毒的各个非结构蛋白,主要编码病毒复制酶。ORF2-5编码病毒囊膜糖蛋白;ORF6编码非糖基化膜基质蛋白,俗称M蛋白[5];ORF7编码N蛋白(又称核衣壳蛋白),理论分子量大小为13.8~15.0 kDa,具有一个糖基化位点,但非真正的糖基化蛋白。N蛋白是病毒粒子中含量最高的蛋白,约占病毒蛋白总量的20%~40%[6]。N蛋白可在PRRSV感染后最早诱导机体产生特异性抗体,这对PRRSV的早期诊断具有重要意义[7,8]。
除了在PRRSV诊断上的价值外,N蛋白在研究PRRSV与宿主细胞相互作用方面也具有重要的意义,该蛋白常常作为检测病毒感染的指示蛋白[9-11]。然而,目前用于检测PRRSV N蛋白的商业化的抗体屈指可数:比如SDOW17A单克隆抗体可以购买获得,但是该抗体仅能用于间接免疫荧光法(indirect immunofluorescence assay,IFA)检测,无法用于Western blot(WB)检测,这为PRRSV深入研究带来诸多不便。为此很多学者自制抗PRRSV N蛋白的抗体[12,13],主要利用原核表达等方法制备重组抗原,随后进行抗体的制备。虽然该方法可以获得针对PRRSV N蛋白的抗体,但是在不同实验室推广使用时往往受到蛋白表达、纯化等条件的限制,耗费时间长,并且特异性不一定好。因此,寻找更加高效的方法应用于抗体的制备显得尤为必要。
本研究基于生物信息学、化学合成等技术,获得用于抗体制备的PRRSV N蛋白抗原肽。随后,通过免疫大白兔制备多抗血清,通过ELISA检测、Western blot和IFA验证多克隆抗体的特异性。结果显示,利用合成的抗原肽制备的抗体,不仅可以用于ELISA和IFA分析,而且可以用于Western blot。因此,我们筛选出的抗原肽可以有效地用于针对PRRSV N蛋白的抗体的制备,为PRRSV感染的应用研究和基础研究提供了重要的工具。
1 材料与方法
1.1 毒株、载体、细胞以及主要试剂 HP-PRRSV(SY0608)毒株由本实验室保存;CH1R和JX1R分别为PRRSV经典毒株和高致病株的疫苗株,也由本实验室保存;真核表达载体p3XFLAG-CMV-14购自Sigma公司;Flag14-GP7质粒由本实验室构建保存;传代细胞系293T和Marc-145分别购自中科院上海细胞库和ATCC;脂质体2000、Opti-MEM 购于Invitrogen公司;HRP标记的羊抗鼠IgG、羊抗兔IgG购自Abcam公司;ECL发光试剂盒购于Pierce公司;封片剂购自Sigma公司;蛋白Marker购自Thermo公司;DMEM培养基购买自Hyclone公司;胎牛血清(FBS)购自Biological Industries公司。
1.2 抗原肽预测、合成及偶联 利用NovoFocusTM抗原预测软件(NovoPro公司)对PRRSV核衣壳蛋白(蛋白序列为Uniprot_A8D906)进行抗原预测,选取了位于PRRSV核衣壳蛋白N端40~56位氨基酸作为抗原多肽。为了便于多肽偶联到KLH蛋白上,我们在抗原多肽的C端加上半胱氨酸,最终抗原多肽序列为:N-GPGKKNRKKNPEKPHFPC-C。抗原多肽由吉尔生化采用Fmoc固相法进行合成,并经高效液相色谱(HPLC)和质谱(MS)进行纯化鉴定。
1.3 多克隆抗体的制备 为了验证抗原肽的抗原性,利用偶联的抗原免疫大白兔进行多克隆抗体的制备。在免疫前1 d进行兔的耳静脉采血,用作ELISA检测时的阴性血清。将偶联好的抗原肽与弗氏完全佐剂乳化后,皮下多点免疫新西兰大白兔(500 μg/只)进行首免。随后,每2周利用弗氏不完全佐剂和偶联的抗原肽(250 μg/只),进行加强免疫。第7次免疫1周后采血,制备多抗血清。利用间接ELISA对抗体的滴度进行测定,结果显示该多抗血清ELISA效价超过105,具体的结果详见表1。最后,利用IgG亲和层析的方法获得纯化的抗体(1.0 mg/mL)。
1.4 蛋白样品制备
1.4.1 真核表达质粒的转染 待293T细胞在细胞板长到70%~80%满时,将空载体p3XFLAG-CMV-14以及实验室保存的构建好的Flag14-GP7质粒分别转染至293T细胞中,转染5 h后换液,换成2%含FBS的DMEM培养基,24 h后收取目的蛋白。
1.4.2 不同时间点感染PRRSV的蛋白样品 使用0.1 MOI剂量的HP-PRRSV(SY0608毒株)感染Marc-145细胞,感染2 h后换成2%含FBS的DMEM培养基,待换液12、24、36、48 h后,分别收取目的蛋白,同时设空白对照组。
1.4.3 感染PRRSV不同毒株的蛋白样品 将3种不同毒株HP-PRRSV (SY0608)、CH1R、JX1R分别感染Marc-145细胞,感染量均为0.1 MOI,感染24 h后收取蛋白样品。
1.5 多克隆抗体特异性检测
1.5.1 Western blot 用15%聚丙烯酰胺凝胶进行SDSPAGE,湿转法转印至PVDF膜。转印2 h后,用5%脱脂乳常温摇床封闭PVDF膜3 h;弃掉封闭液后用TBST漂洗,随后加入制备好的N蛋白抗体(1∶2000),4℃摇床孵育过夜;再用TBST洗3次,每次摇动漂洗10 min,加入HRP标记的羊抗兔二抗(1:5000),室温摇床孵育1.5 h;用TBST洗3次,每次摇动漂洗10 min,暗室中进行显影,使用ECL显色发光试剂盒进行显色。
1.5.2 间接免疫荧光分析(IFA) 将Marc-145细胞均匀铺至24孔板中,待长到80%时接入0.1 MOI HP-PRRSV(SY0608毒株),感染24 h后用多聚甲醛固定0.5 h。PBS漂洗3遍后,1% NP40进行作用15 min。再用PBS漂洗3次,每次1 min,用含2%羊血清的封闭液室温封闭30 min,室温孵育一抗1 h:自制的N蛋白抗体按1∶100稀释,商业化的抗PRRSV N蛋白抗体(SDOW17A)按1∶400稀释。PBS洗3次,每次5 min,室温避光孵育二抗1 h:自制的 N蛋白二抗使用羊抗兔 594 IgG (1:400稀释),其中 PRRSV感染的Marc-145细胞显示为红色;商业化的抗PRRSV N抗体(SDOW17A)的二抗使用羊抗鼠488 IgG(1∶400稀释),PRRSV感染的Marc-145细胞显示为绿色。随后用PBS摇床上洗3次,每次5 min。然后DAPI染色10 min,PBS洗3次,每次5 min,最后用封片剂进行粘片。
2 结果
2.1 针对抗原肽的多克隆抗体滴度检测 采用间接ELISA 测定抗体效价。当制备的N 蛋白抗体稀释比例为1∶3125时,Rabbit1的OD450值为2.292,Rabbit2的OD450值为2.335,均远远大于标准值0.3;当稀释比例不断增加,达到1∶100 000时,Rabbit1、Rabbit2 OD450分别为0.311、0.472,依旧大于0.3。同时对照组兔阴性血清稀释比例为1∶1000时,OD450为0.054,小于标准值0.2,说明制备的兔抗N蛋白多克隆抗体ELISA效价可达到105(表1)。
2.2 多克隆抗体特异性分析 为了验证该多克隆抗体的特异性,利用Western blot 方法对分别转染Flag14-GP7及空载体的293T细胞样品进行分析。结果显示,利用该抗原肽的抗体,仅在Flag14-GP7的细胞样品中,检测到约16 kDa大小的条带,结果见图1A。同时,利用抗Flag的抗体对上述样品进行分析,发现也仅在Flag14-GP7的细胞样品中,检测到约16 kDa大小条带,结果见图1B。因此,我们的结果显示该多克隆抗体可以特异地识别PRRSV N蛋白。
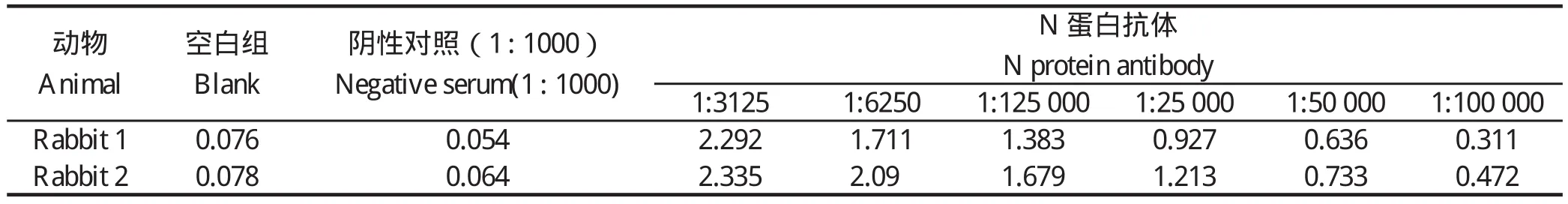
表1 ELISA 效价检测结果Table 1 ELISA titer of N protein antibody
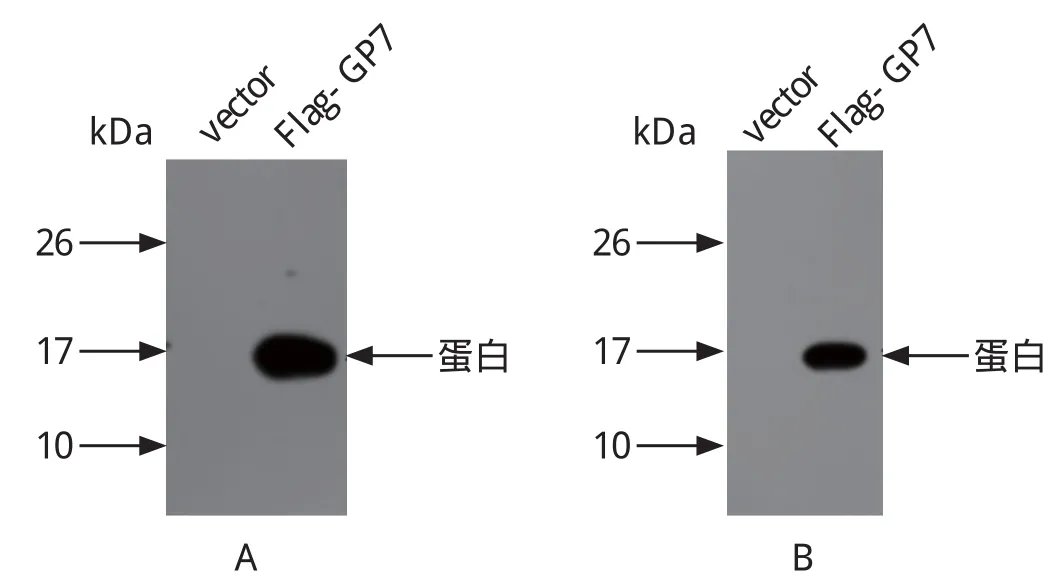
图1 N蛋白Western blot 分析Fig. 1 Western blot analysis of protein N
2.3 多克隆抗体的应用
2.3.1 HP-PRRSV感染的细胞中N蛋白检测 为了验证该多克隆抗体可以应用于检测PRRSV感染样品中N蛋白,利用Western blot分析感染HP-PRRSV 后不同时间点的Marc-145细胞样品。结果显示,该多克隆抗体可有效地识别HP-PRRSV感染样品中的N蛋白,并且随着时间的推移,N蛋白的表达量也逐渐增加(图2)。
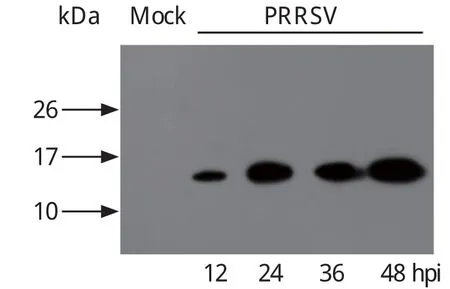
图2 PRRSV感染不同时间点N蛋白表达情况Fig. 2 The expression of N protein at different time poin after PRRSV infection
2.3.2 PRRSV不同毒株感染的细胞中N蛋白检测 为了验证该多克隆抗体可以识别PRRSV不同毒株中的N蛋白,我们利用Western blot对SY0608、CH1R、JX1R毒株感染的细胞样品进行了分析。结果显示,该多克隆抗体可以特异地识别上述毒株感染细胞中的N蛋白(图3)。
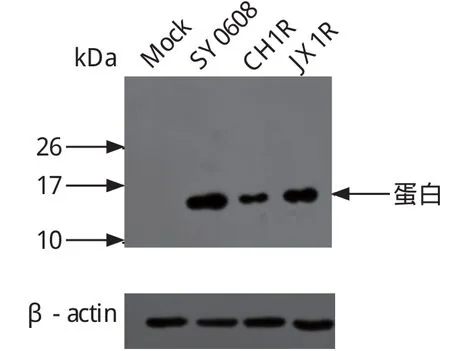
图3 不同PRRSV毒株感染Marc-145细胞后的N 蛋白表达情况Fig. 3 The expression of N protein in Marc-145 cells infected with different PRRSV strains
2.3.3 间接免疫荧光分析(IFA) 为了验证该多克隆抗体也可以应用于IFA,利用该多克隆抗体与商业化的抗体对PRRSV感染的细胞样品进行IFA。结果显示,在荧光显微镜下两种抗体都可以检测到PRRSV感染的细胞,并且阳性细胞完全吻合,结果见图4。
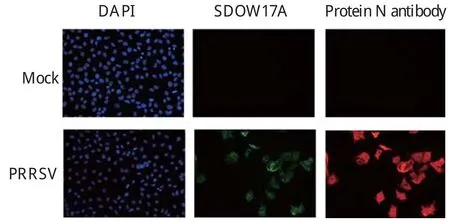
图4 N蛋白抗体间接免疫荧光效价检测结果Fig. 4 Indirect immuno fl uorescence assay of Flag14-GP7 PcAb
3 讨论
本研究成功筛选获得用于PRRSV N蛋白抗体制备的抗原肽。针对该抗原肽的多克隆抗体,不仅可以识别过表达的PRRSV N蛋白,而且可以有效地识别病毒感染的PRRSV N蛋白,还可以与不同毒株的N蛋白反应。因此,通过生物学预测获得的PRRSV N蛋白多肽可以应用于针对PRRSV N蛋白多克隆抗体的制备,为将来研制有效的抗PRRSV N蛋白商业化的抗体奠定了基础。
N蛋白作为PRRSV感染过程中含量最丰富的病毒蛋白,已成为病毒感染检测的指示蛋白。例如用于病毒感染的诊断[14]以及病毒与宿主相互作用过程中的病毒检测[15]。在这些研究中,针对PRRSV N蛋白抗体的制备,主要依赖于原核表达获得重组抗原。为了避免原核表达纯化的繁琐程序,本研究聚焦于HP-PRRSV N蛋白,利用生物信息学和蛋白合成技术,获得PRRSV N蛋白的抗原多肽。根据Blast软件比对的结果,该抗原多肽在“北美型”PRRSV毒株中高度保守,与“欧洲型”毒株的N蛋白同源比较低(约为60%,结果未显示)。研究显示针对该抗原肽的多克隆抗体可以用于不同毒株中N蛋白的检测,这一结果与我们Blast的结果吻合。尽管目前该多克隆抗体是否可应用于不同型PRRSV的检测还没有得到验证,但是本研究结果显示,至少该多克隆抗体可以用于“北美型”PRRSV N蛋白的检测。
PRRSV在世界范围内广泛存在,已成为危害我国养猪业的“头号元凶”。深入开展PRRSV与宿主相互作用的研究对揭示PRRSV的免疫致病机制具有重要的基础意义。然而目前开展这些研究往往受制于特异性的抗体。针对PRRSV N蛋白的商业化的抗体还非常有限,其中SDOW17A是其中比较成功的抗体,但是该抗体不能够应用于Western blot(至少不能够与“北美型” PRRSV N蛋白反应)。本研究利用该抗原肽获得的抗体不仅可以应用于IFA,同时还可以应用于Western blot,并且具有非常好的反应性。因此,本研究结果不仅为检测 PRRSV N蛋白提供了选择,而且弥补了SDOW17A抗体的不足,进而为制备新的用于PRRSV N蛋白检测的商业化抗体奠定了基础。
[1]Cavanagh D. Nidovirales: A new order comprising Coronaviridae and Arteriviridae[J]. Arch Virol, 1997,142(30): 629-633.
[2]Paton D J, Brown I H, Edwards S,et al. Blue ear disease of pigs[J]. Vet Rec, 1991, 128(26): 617.
[3]Zhou L, Yang H C. Porcine reproductive and respiratory syndrome in China[J]. Virus Res, 2010, 154: 31-37.
[4]Dea S, Gagnon C A, Rogan D,et al. Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome (PRRS) virus comparison of the North American and European isolates[J]. Arch Virol,2000, 145(4): 659-688.
[5]Fang Y, Snijder E J, The PRRSV replicase: exploring the multifunctionality of an intriguing set of nonstructural proteins[J].Virus Res, 2010, 154(1): 61-76.
[6]Pastemak A O, Spaan W J, Snijder E J,et al. Sequence requirements for RNA strand transfer during nidovirus discontinuous subgenomic RNA synthesis[J]. EMBO J,2001, 20(24): 7220-7228.
[7]Wang X, Bai J,Zhang L,et al. Poly(A)-binding protein interacts with the nucleocapsid protein of porcine reproductive and respiratory syndrome virus and participates in viral replication[J]. Antiviral Res, 2012,96(3): 315-323.
[8]Tan F, Wei Z, Li Y,et al. Identification of non-essential regions in nucleocapsid protein of porcine reproductive and respiratory syndrome virus for replication in cell culture[J]. Virus Res, 2011, 158(1-2): 62-71.
[9]Dea S, Gagnon C A, Antigenic variability of porcine reproductive and respiratory syndrome as defined by monoclonal antibodies to the matrix protein[J]. JCM,1996, 34(6): 1488.
[10]Nelson E A, Christopher J, Drew T,et al. Differentiation of US and European isolates of porcine reproductive and respiratory syndrome virus by monoclonal antibodies[J].JCM, 1993, 31(12): 3184-3189.
[11]Wootton S K, Nelson E A, Yoo D,et al. Antigenic structure of porcin reproductive and respiratory syndrome( PRRS )virus[J], Clin Diagn Lab Immun, 1998, 5(6):773-779.
[12]王晓丰, 李玉峰, 王先炜, 等, 1株抗欧洲型和美洲型PRRSV核衣壳蛋白单克隆抗体的制备与鉴定[J], 畜牧与兽医, 2010, 42 (12):30-34.
[13]夏平安, 尹彦涛, 李素平, 等. 猪繁殖与呼吸综合征病毒重组N蛋白的高效表达及间接ELISA方法的建立[J]. 中国兽医学报, 2009, 29(5): 537-541.
[14]董林, 王艳萍, 谢金文, 等. PRRSV重组N蛋白表达、纯化及间接ELISA检测试剂盒的研制[J], 中国兽医学报,2012, 32(3): 355-360.
[15]孙明霞. 猪繁殖与呼吸综合征病毒引起Marc-145细胞产生自噬对病毒复制的影响及其信号通路研究[D]. 南京:南京农业大学, 2013.
PREDICTION AND SYNTHESIS OF ANTIGEN PEPTIDE OF PRRSV N PROTEIN AND ITS APPLICATION FOR GENERATION OF ANTIBODY
XIANG Xiao, ZHANG Yan-bing, SHI Yuan-yuan, LI Yu-ming, LIU Ke, WEI Jian-chao, SHAO Dong-hua,LI Bei-bei, TONG Guang-zhi, MA Zhi-yong, QIU Ya-feng
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
To date, prediction of antigen peptides based on bioinformatics, chemical synthetic and immunological techniques has been commonly used for generation of antibodies. Here, we determined the possibility of generation of speci fi c antibody against PRRSV N protein by using predicted antigen peptide. First, one antigen peptide (16 amino acids) close to N terminal of was predicted from N protein of a highly pathogenic PRRSV strain. Then, the BLAST analysis showed that this peptide was conserved in different North American PRRSV strains. Secondly, this antigenic peptide was synthesized by using Fmoc solid phase method and coupled to the KLH vector protein by MBS method. Subsequently, New Zealand white rabbits were immunized with the conjugated antigenic peptide emulsi fi ed with Freund's complete or incomplete adjuvant. The antiserum was collected from the immunized rabbit and antibodies were puri fi ed using IgG af fi nity chromatography. The puri fi ed antibodies showed good signals at dilution of over 105 in ELISA. When used at dilution of 1:2000 in Western blotting, the antibodies reacted with N protein from Marc-145 cells infected with different PRRSV strains. The dilution of 1:200 of this antibody preparation was used in IFA for detection of PRRSV in infected cells. Collectively, the antigen peptide of the PRRSV N protein was predicted using bioinformatics software and used for generation of antibodies, which showed good reactivity in ELISA, Western blot and IFA.
Porcine reproductive and respiratory syndrome virus; nucleocapsid protein; antigen peptide; antibody
S852.43
A
1674-6422(2017)06-0019-06
2017-08-29
中央级公益性科研院所基本科研业务费(2014JB15、2015ZL065);国家自然基金(31502046);973计划项目(2014CB542702)
相笑,女,硕士研究生,预防兽医学专业
邱亚峰,E-mail:yafengq@shavri.ac.cn; 马志永,E-mail:zhiyongma@shvri.ac.cn
