哈茨木霉和黑曲霉粗酶液预处理改善秸秆产甲烷性能
2018-03-01赵肖玲郑泽慧蔡亚凡赵宇宾崔宗均王小芬
赵肖玲,郑泽慧,蔡亚凡,赵宇宾,罗 凯,崔宗均,王小芬
0 引 言
近年来,全球天然气的使用量持续增长,中国作为推动全球天然气需求增长的主要国家,到2030年左右将比欧盟和中东地区消耗更多的天然气[1]。沼气发酵工艺已在世界范围内被广泛应用于解决环境、农业和能源问题,产生了巨大的生态、社会和经济效益。农林废弃物等生物质通过厌氧消化生产沼气,作为一种可再生能源经过净化提纯,将CH4浓度提升至96%以上,可升级为生物甲烷,注入天然气管网或用作车辆燃料,扩大其利用范围,从而减少与化石燃料相关的温室气体的净排放量[2-3]。据资源统计,中国每年至少应有(3 000~4 000)×108m3的有机废弃物可供用于生产生物天然气,其中,可用于生产沼气的农业废弃物约1×108t[4]。
玉米秸秆是中国主要的木质纤维素废弃物,每年产生约2.5亿t,是厌氧发酵生产沼气的潜在原料[5-6]。在玉米秸秆发酵过程中,木质纤维素生物质的预处理和随后的水解是关键过程,水解被认为是有效厌氧发酵的速率限制步骤[7-9]。秸秆富含纤维素、半纤维素和木质素,三者在秸秆中相互缠绕,构成致密的空间结构,不易被微生物及酶直接利用,因此,在厌氧发酵之前需要进行预处理。
应用最广泛的预处理方法有物理预处理、化学预处理和生物预处理以及这些方法的组合[10-12]。物理方法如研磨、球磨、蒸汽爆破和超声已经在研究中得到了广泛的关注[13]。化学方法包括强碱如氢氧化钠、氧化钙和过氧化物的碱性预处理,以及酸性(如硫酸、乙酸和硝酸)预处理[14-15]。但由于物理预处理和化学预处理存在能耗高、设备要求严格、污染环境等问题,在实际应用中受到限制。生物预处理以其能源需求低、反应条件温和、不污染环境等优势,备受研究者青睐,因此,微生物和酶已经成为许多学者研究的课题[16,7]。
分解纤维素的微生物如哈茨木霉(Trichoderma harzianum)、球孢白僵菌(Colletotrichum gloeosporioides)和木霉属(Trichoderma sp.)等[17]可以通过分泌纤维素酶和半纤维素酶来水解木质纤维素材料。目前研究集中在纤维素酶或半纤维素酶对具有高纤维含量的底物厌氧发酵的影响,得到了有利的结果。Quiñones等[18]研究了酶在不同原料连续生物甲烷化过程中的应用,水解酶能够将沼气产量和甲烷体积分数分别提高10%~15%和5%~10%。同样,Karray等[19]采用酶法(黑曲霉)预处理枸杞,还原糖质量浓度达到 7.3 g/L,沼气产量比未经处理的高出33.01%。因此,酶预处理在厌氧发酵中是有利的。然而,酶的高成本限制了现有商业酶在沼气发酵中的应用,故而低成本酶在废弃物的厌氧发酵中的应用将是十分重要的。农业废弃物可以作为产酶培养基通过固态发酵产酶以降低酶的生产成本,这一路径为酶的低成本生产提供了技术保障。可供利用的底物包括小麦秸秆、玉米秸秆、甘蔗渣等木质纤维素材料[20-21]。
因此,低成本酶在玉米秸秆厌氧发酵中的预处理效果为本研究的重点,对发酵过程中碱度、VFA、sCOD的相互关系进行了研究,以及对酶作为外源添加剂对发酵系统中微生物的菌群结构变化进行了探讨,以期为提高木质纤维素原料沼气转化效率提供理论和技术支持。
1 材料与方法
1.1 哈茨木霉和黑曲霉的培养
试验所用的哈茨木霉(Trichoderma harzianum)(KY644130)和黑曲霉(Aspergillus sp.)(KY644131)为中国农业大学生物质工程研究中心筛选所得。扩大培养的培养基为玉米秸秆粉培养基(玉米秸秆粉 10 g,(NH4)4SO44 g,KH2PO42 g,MgSO4·7H2O 0.5 g,蛋白胨1 g,琼脂 20 g,去离子水 1 000 mL,pH 值 6.5),在 30 ℃培养3 d后制备孢子悬浮液,用于制备粗酶液的接种物。通过 CFU计数评估,菌悬液中活的孢子浓度为 2×109CFU/mL。
1.2 粗酶液的制备
产酶培养基为玉米秸秆粉-麦麸培养基(玉米秸秆粉:麦麸:营养液=2∶1∶6;其中营养液为(NH4)2SO42 g/L,MgSO45 g/L;KH2PO48 g/L;pH值自然),该培养基选用玉米秸秆和麦麸等农业废弃物作为产酶培养基的主要组成成分,在 25 ℃恒温培养 3 d,之后以固液比 1∶12的比例添加灭菌去离子水,在180 r/min摇床上浸提1 h,过滤离心后得到粗酶液。粗酶液具有水解纤维素和半纤维素的能力,其中哈茨木霉提取的酶T中CMCase酶活和木聚糖酶活分别为(12.38±0.69)和(230.53±23.03)U/mL,黑曲霉提取的酶A中CMCase酶活和木聚糖酶活分别为(3.32±0.68)和(891.77±27.36)U/mL,其中 1个酶活单位定义为1 h内形成1 mg还原糖所需要的酶量。
1.3 原料和接种物
产酶培养基所用的青绿玉米秸秆及厌氧发酵所用的干黄玉米秸秆均取自中国农业大学上庄实验站(北京市海淀区),用切碎机切碎至5~8 cm的小段,于105 ℃烘箱中干燥20 min,之后在80 ℃下干燥至含水率低于10%。最后,用研磨机研磨,得到玉米秸秆粉。
接种污泥取自中国农业大学涿州试验站连续运行的以玉米秸秆和猪粪为原料的沼气发酵罐。原料的基本性质如表1。
1.4 试验设计
1.4.1 预处理
试验设置3个处理组,处理1为添加酶T的预处理组,用酶T(Enzyme T)表示;处理2为添加酶A的预处理组,用酶A (Enzyme A)表示;以未加酶的预处理作为对照组,用CK表示。将50 mL粗酶液(酶T和酶A)分别加入装有 9 g干黄玉米秸秆粉的1 L蓝盖瓶中,在50 ℃恒温培养箱中预处理 6 d,对照组将粗酶液换为50 mL去离子水。

表1 原料与接种污泥的基本性质Table 1 Characteristics of raw materials and inoculum
1.4.2 厌氧消化
玉米秸秆经6 d的预处理,从恒温培养箱中取出,加入 300 mL接种污泥,添加去离子水补至发酵体积400 mL。发酵装置填充氮气,制造厌氧环境。发酵温度为(35±2)℃,每个处理 3个重复,空白组为只添加接种污泥的反应器。每天搅拌一次,发酵周期为20 d。
每天测量沼气产量和沼气中甲烷含量,定期取样测定反应体系的pH值、挥发性脂肪酸(volatile fatty acids,VFA)、可溶性化学需氧量(soluble chemical oxygen demand,sCOD)和碱度等指标,取厌氧发酵24 h的样品测定微生物群落结构,以检测酶作为外源添加剂对厌氧发酵系统中微生物群落的影响。
1.4.3 指标测定
使用美国公共卫生协会的标准方法[22]测量玉米秸秆及接种污泥的总固体(total solid,TS)、挥发性固体(volatile solid,VS)、干物质(dry matter,DM)、总碳(total carbon,TC)和总氮(total nitrogen,TN)。纤维素、半纤维素和木质素使用 Ankom 2000纤维分析仪(Ankom Technology Corp.,Fairport,NY,USA)测定[23]。
将样品在12000 r/min离心,样品pH值的测定使用日本 Horiba公司的 B-212型微量 pH计。粗酶液中的CMCase、木聚糖酶活(xylanase)使用DNS法测定[24]。VFA使用日本岛津LC-20A高效液相色谱仪测定[12]。sCOD使用COD快速检测仪(Lovibond E799718,德国)[16]测定。碱度的测定使用滴定法[25]。
Illumina Miseq测序和数据分析:
为了检测酶预处理对厌氧发酵系统中微生物的冲击,选用厌氧发酵24 h的样品测定细菌和古菌群落结构。高通量(Illumina Miseq)测序由Majorbio有限公司(中国上海)进行。使用细菌通用引物 338F和 806R(ACTCCTACGGGAGGCAGCAG和GGACTACHVGGGTWTCTAAT)和古菌通用引物524F和958R(TGYCAGCCGCCGCGGTAA和YCCGGCGTTGAVTCCAATT)扩增V3-V4区,使用Illumina Miseq对扩增子文库进行测序。由 Majorbio有限公司(中国上海)提供的 www.isanger.com对微生物门和属级进行菌群结构分析。
使用BMP-Test系统(WAL-BMP-Testsystem 3150,WAL,德国)测定每日产沼气量,精度为0.1%。用该仪器测定反应器中顶部空间的压力 ΔP,使用公式(1)计算日产沼气量[26]:

其中Vbiogas为日产沼气体积,mL;ΔP为反应器中压力与大气压的绝对压力差,kPa;Vheadspace为反应器顶部空间的体积,mL;C为摩尔体积,273.15 K时为22.41 L/mol,101.325 kPa;R为通用气体常数,8.314 L kPa/(K⋅mol);T为绝对温度,K。
使用配备有导热性检测器的气相色谱仪(GC-2014,Shimadzu,Japan)测定沼气中甲烷含量[12]。
日产甲烷量使用公式(2)计算:

式中Vmethane为日产甲烷体积,mL/g;Vbiogas为日产沼气体积,mL;4CHφ为日产沼气中甲烷含量,%;TSsubstratesadded为添加原料的总干物质质量,g。
1.5 数据分析
数据处理和统计分析使用 Microsoft Excel 2010(Microsoft Co.,Redmond,WA,USA),SPSS 20(IBM Co.,Armonk,NY,USA),Canoco for Windows 4.5(Biometris Plant Research International,Wageningen,The Netherlands)和 Origin 9.1(OriginLab Corporation,Northampton,MA 01060,USA)。方差分析使用Duncan的多范围检验,其显著性P<0.05。
2 结果与讨论
2.1 发酵过程中的VFA、pH值、碱度/VFA、sCOD/VFA的变化
厌氧发酵系统中各指标的变化可以检测发酵过程的好坏。甲烷发酵过程是微生物物质转化的过程,细菌将大分子有机物转化为乙酸、乙醇、H2等小分子物质,之后经过产甲烷古菌的代谢,最终转化为甲烷。因此,发酵环境的稳定对于产甲烷量的多少有直接的关系,pH值、VFA[27]、sCOD/VFA[28]、碱度/VFA[28]是体现厌氧发酵环境稳定性的指标。厌氧发酵过程中VFA、sCOD/VFA、碱度/VFA及pH值的变化如图1所示。在第0天,经酶T、酶A预处理后,原始发酵液中总VFA分别比CK组高272.42%和203.03%,酶T预处理后,乙酸和丙酸大量增加,两者占总VFA的92.68%,且乙酸占总VFA的72.25%。酶A预处理后丁酸大量增加,丁酸可以通过微生物代谢转化为甲酸和乙酸,被产甲烷菌直接利用[27]。发酵 1 d后,VFA含量发生较大变化,主要体现在酶T、酶A预处理组中VFA浓度的急剧下降,酶T处理组减少的挥发性脂肪酸主要为乙酸和丙酸,分别减少了 93.31%和96.81%,减少后体系中几乎不含乙酸和丙酸;酶A处理组减少的挥发性脂肪酸主要为乙酸和丁酸,减少量分别为89.49%和100%。而CK组VFA总量升高,主要体现在丙酸含量的增加。随着发酵的进行,丙酸为VFA的主要组成酸。

图1 厌氧发酵过程中VFA、sCOD/VFA、碱度/VFA及pH值的变化Fig.1 VFA, sCOD/VFA, alkalinity/VFA and pH value during anaerobic fermentation
在沼气发酵中,sCOD是了解发酵液中可被氧化的有机物数量及掌握发酵进程的极为重要的指标。sCOD/VFA比值的变化规律和碱度/VFA的变化趋势相同。发酵前2d波动较大,发酵1d升到8.69和7.18;后期维持稳定,保持在0.89~5.73之间。
2.2 酶预处理对玉米秸秆产甲烷的影响
图 2所示为厌氧发酵过程中日产甲烷量和累积产甲烷量变化情况。经过1 d的厌氧发酵,酶T处理组、酶A处理组产甲烷量分别为 59.34和 27.69 mL/g,显著高于CK组(P<0.05),比 CK组分别提高了 403.67%和134.99%。可见产甲烷量的增加来源于酶对玉米秸秆的预处理。预处理使VFA大量增加,乙酸、丙酸、丁酸含量的增加都为甲烷的生成提供了前体物质。随着有机酸的消耗,日产甲烷量逐渐下降。酶 T处理组的产气高峰出现在第1天(59.34 mL/g),显著高于CK组(P<0.05),之后出现3次产气高峰,但在发酵第8~14天日产甲烷量低于酶A处理组和CK组。酶A处理组在第5天产气达到最高(41.05 mL/g),与CK组差异不显著(P >0.05),且在整个发酵周期内出现6次产气高峰。CK组初始日产甲烷量低,第3天达到日产甲烷最大值39.56 mL/g。可见酶预处理提高了玉米秸秆的最大日产甲烷量。酶T、酶A预处理组的累积产甲烷量始终高于CK组,发酵20 d累积产甲烷量显著高于CK组(P<0.05),比CK组分别提高了7.79%和10.06%。酶T处理组在发酵前11天累积产甲烷量高于酶A处理组,之后降低,20天时累积产甲烷量与酶A处理组无显著性差异(P >0.05)。

图2 日产甲烷量及累积产甲烷Fig.2 Daily methane yield and cumulative methane yield
2.3 酶预处理对厌氧发酵系统中微生物的影响
沼气发酵过程需要经历水解、酸化、产氢产乙酸和产甲烷 4个生化过程,其中发挥关键作用的是一系列原核生物,包括水解酸化细菌、产氢产乙酸细菌和产甲烷古菌[13]。试验用哈茨木霉和黑曲霉利用农业废弃物经固态发酵所制得的粗酶液作预处理剂。作为一种外源添加剂,粗酶液中的物质是否会对厌氧发酵系统中的微生物产生不利的影响,一直是本研究关注的重点,故而使用高通量测序测定发酵24 h样品中的微生物来监测发酵液中细菌和古菌的动态变化。
2.3.1 酶预处理对厌氧发酵系统中细菌多样性的冲击
在门水平(图3a),与接种污泥中细菌相比,酶T处理组、酶A处理组和CK组中菌群多样性增加,体现在细菌所属门种类的增多。多样性增加,系统会越趋稳定。酶T、酶A处理组中拟杆菌门(Bacteroidetes)占比增加,分别比接种污泥增加了21.09%和15.27%,而CK组中拟杆菌门占比与接种污泥之间无显著性差异。拟杆菌门在厌氧发酵过程中起着非常重要的作用,是厌氧发酵的主要发酵细菌,主要参与大分子复杂有机物的水解,可将碳水化合物降解为单糖,最终水解酸化为小分子的乙酸、乳酸、琥珀酸等;将脂类水解为低级的脂肪酸和醇;也可以利用蛋白质,将其降解为氨基酸和部分有机酸[29]。厚壁菌门(Firmicutes)在接种污泥中占47.02%,在酶T处理组、酶A处理组和CK组中分别有不同程度的下降。厚壁菌门在厌氧环境中大量存在,如厌氧反应器及瘤胃中,是厌氧发酵过程中重要的酸化水解微生物,其通过分泌多种纤维素酶、脂肪酶、蛋白酶及其他的胞外酶,将复杂的大分子物质如蛋白质、脂肪、纤维素、半纤维素、糖类和氨基酸等有机物水解酸化。拟杆菌门和厚壁菌门是厌氧体系中主要存在的两大门类,其总和在酶T处理组、酶A处理组、CK组和接种污泥中分别占75.68%,68.18%,60.91%,80.76%。CK组中螺旋体门(Spirochaetae)和互养菌门(Synergistetes)占比增加,分别比接种污泥增加135.90%和168.78%,而酶T处理组中螺旋体门和互养菌门占比与接种污泥无显著性差异。其中螺旋体门曾在白蚁的瘤胃中发现,大部分属于密螺旋体属(Treponema),能够利用H2和CO2产生乙酸,为产甲烷阶段的嗜乙酸产甲烷菌提供原料[30]。Dubinina 等[31]研究发现,螺旋体科(Spirochaetaceae)可以利用多种碳水化合物包括纤维素和半纤维素。互养菌门是一类革兰氏阴性细菌,具有棒状或弧状的细胞形态,存在于很多厌氧环境中,如动物的肠胃、土壤、油井或废水处理厂中。目前已知的互养菌门的微生物均属于Synergistia纲,Synergisiales科[32]。
在属水平,Clostridium,VadinHA17,vadinBC27,Draconibacteriaceae及Ruminofilibacter为厌氧发酵系统中的主要细菌属。Clostridium在接种污泥中占20.35%,加入玉米秸秆后,该菌属占比下降,酶A处理组和CK组中该属分别占6.78%和7.21%。vadinBC27在CK组中有明显的减少,Terrisporobacter在CK组、酶T处理组和酶A处理组中明显减少。由图3b可见,在属水平,酶T处理组、酶A处理组和CK组中占比大于1%的细菌低于接种污泥,主要体现在 Clostridium属占比的显著降低(P<0.05)。从细菌菌群多样性热图(图3c)中可以看出,Fibrobacter和Treponema占比低于其他组。酶A处理组和CK组中菌群组成亲缘关系较近,其次是酶T处理组与酶A处理组和CK组菌群组成的亲缘关系较近。由日产甲烷量变化规律也可以看出,酶A处理组和CK组有相同的变化规律,整体呈现同时升高同时降低的趋势,而由于微生物菌群结构的不同,酶T处理组与酶A处理组和CK组的日产甲烷变化规律不同。在第3~5天,酶T处理组日产甲烷较高,在第4天出现明显的下降,但在第6天后,酶T处理组的日产甲烷下降,且低于酶A处理组和CK组,这也是在第12天,酶T处理组的累积产甲烷量开始低于酶A处理组的原因。由此,尽管酶T处理组在厌氧发酵前期(0~12 d)占有优势,但在发酵后期产气不及酶A预处理组。

图3 细菌菌群多样性Fig.3 Bacterial diversity
酶T处理组中有9个属的微生物丰度极显著高于CK组,其中Clostridium,vadinBC27,Ruminofilibacter都与纤维素的降解有关,可见酶 T处理组增加了促进纤维素降解微生物的菌群丰度,这在反应体系物质转化中具有重要的促进作用,可为产甲烷菌提供更多的前体物质。
酶A处理组中仅有5个属的微生物丰度极显著高于CK 组,分别为 vadinBC27,Ruminofilibacter和Christensenellaceae,以及未知细菌属;而 Treponema,Terrisporobacter,Turicibacter等5个属与CK组无显著性差异,说明酶A处理组与CK组中微生物菌群结构相近,且从日产甲烷量变化可以看出,酶A处理组和CK组的日产甲烷具有相同的变化规律。可见,酶预处理增强了与纤维素分解相关的细菌的丰度,对厌氧发酵是有利的。
2.3.2 酶预处理对厌氧发酵系统中古菌多样性的冲击
从古菌菌群结构中可以看出,厌氧发酵系统中的古菌在属水平上(图4a)主要为甲烷丝菌属(Methanosaeta)、深古菌门(Bathyarchaeota)、Methanosarcina、Deep sea Euryarchaeotic Group-DSEG以及Methanobacterium。
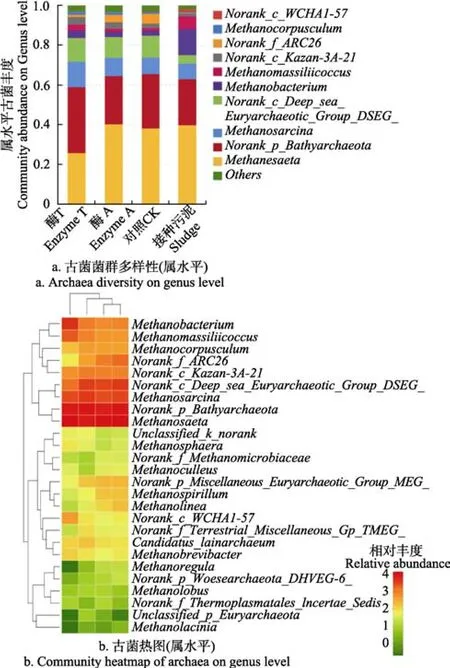
图4 古菌菌群多样性和热图分析Fig.4 Archaea diversity on genus level and heat map in archaea community
酶 T处理组的 Methanosaeta下降,Bathyarchaeota增加,其中甲烷丝菌属(Methanosaeta)为乙酸营养型古菌,专营性嗜乙酸,一般在中温环境中存在。深古菌(Bathyarchaeota)的一些类群具有丰富多样的代谢方式,既可以降解环境中的难降解大分子如芳香化合物、几丁质、纤维素和蛋白质等,通过发酵产生乙酸等小分子化合物,也可以利用CO2和H2通过自养产乙酸途径获取能量。深古菌产生的乙酸是重要的电子载体,可以被产甲烷菌和异养细菌所利用,是深部碳循环和生态系统的核心驱动者[33]。Deep sea Euryarchaeotic Group-DSEG在酶T处理组、酶A处理组和CK组中大量增加,推测该菌在纤维素分解中具有积极作用。接种污泥中甲烷杆菌属(Methanobacterium)和第七产甲烷古菌目马氏甲烷球菌科(Methanomassiliicoccus)在酶T处理组、酶A处理组和CK组中均有所降低。马氏甲烷球菌科为甲基型产甲烷古菌,拥有较为独特的代谢特性,与传统的专性甲基型产甲烷古菌不同,其缺少将CO2还原为甲基辅酶M 的完整途径[34],因此这类菌需要额外添加H2才能生长。基因组分析表明,它们含有一些基因,可利用H2还原甲醇、甲胺、二甲胺等底物,因此,Methanomassiliicoccus即非典型的甲基营养型产甲烷菌,又非典型的氢营养型产甲烷菌,属于两者的混合型[35]。
从古菌热图4b上看,接种污泥中Methanoregula(属于甲烷微菌目 Methanomicrobiales:氢营养型)和Methanolacinia 2种产甲烷古菌丰度低于其他组,但Methanobacterium高于其他组。菌群组成亲缘关系酶 A处理组与CK组最近,其次是酶T处理组与酶A处理组和酶T处理组与CK组。
在丰度前15的属中,酶T处理组中有8个属的微生物丰度极显著高于 CK组,2个属显著高于 CK组(P<0.05),1个属与CK组无显著性差异(P >0.05)。说明酶 T处理组的处理效果显著影响了厌氧发酵系统中产甲烷古菌的分布。酶A处理组中有4个属的微生物丰度极显著高于CK组,2个属显著高于CK组,6个属与CK组无显著性差异。说明酶A处理组中产甲烷古菌的分布与CK组中的产甲烷古菌差异不大,具有近的亲缘关系。
2.4 微生物与环境因子之间的关系及对产甲烷的影响
图5为微生物与环境因子之间的冗余分析。图5a为细菌在门水平与发酵初始指标及发酵结束后累积产甲烷量的相关关系。可以看出,酶T处理组、酶A处理组和CK组3组分别处于不同象限,说明三者的物种组成不相似。甲烷产量与VFA、乙酸、sCOD、丙酸、乳酸和甲酸均呈正相关,说明这些条件共同决定了甲烷的生成。pH值分别与VFA和碱度具有大小一致的夹角且在pH值两侧均呈正相关,说明VFA和碱度的动态平衡共同决定了发酵系统中pH值的稳定。厚壁菌门、WS6、变形菌门和拟杆菌门在酶T处理组中丰度高于酶A处理组和CK组,且与VFA和sCOD呈正相关,说明这些细菌对于VFA的利用和 sCOD的转化起到重要的作用。在属水平上(图5b),嗜乙酸的菌属Ruminofilibacter,Ruminococcaceae,vadinHA17和Draconibacteriaceae与乙酸呈正相关,体现了细菌的代谢特性与环境之间的相关关系。
古菌属水平上的相关关系如图 5c所示,除 ARC26和Methanosaeta外,其他古菌属均处在VFA,sCOD的正相关位置,在复杂的厌氧环境中,这些微生物能够利用VFA中的乙酸、丙酸等及sCOD直接或间接地产生甲烷,从而合力完成玉米秸秆的甲烷发酵。酶 T处理组与酶A处理组和CK组相比,产甲烷古菌的丰度更高,这也解释了发酵前12 d酶T处理组的累积产甲烷量高于酶A处理组和CK组。可见,发酵过程中微生物的菌群结构对于发酵效果及产甲烷量起着重要的作用。初始发酵条件能够影响发酵系统中的菌群结构,有效的预处理对于改善发酵起始条件具有重要的调节作用。
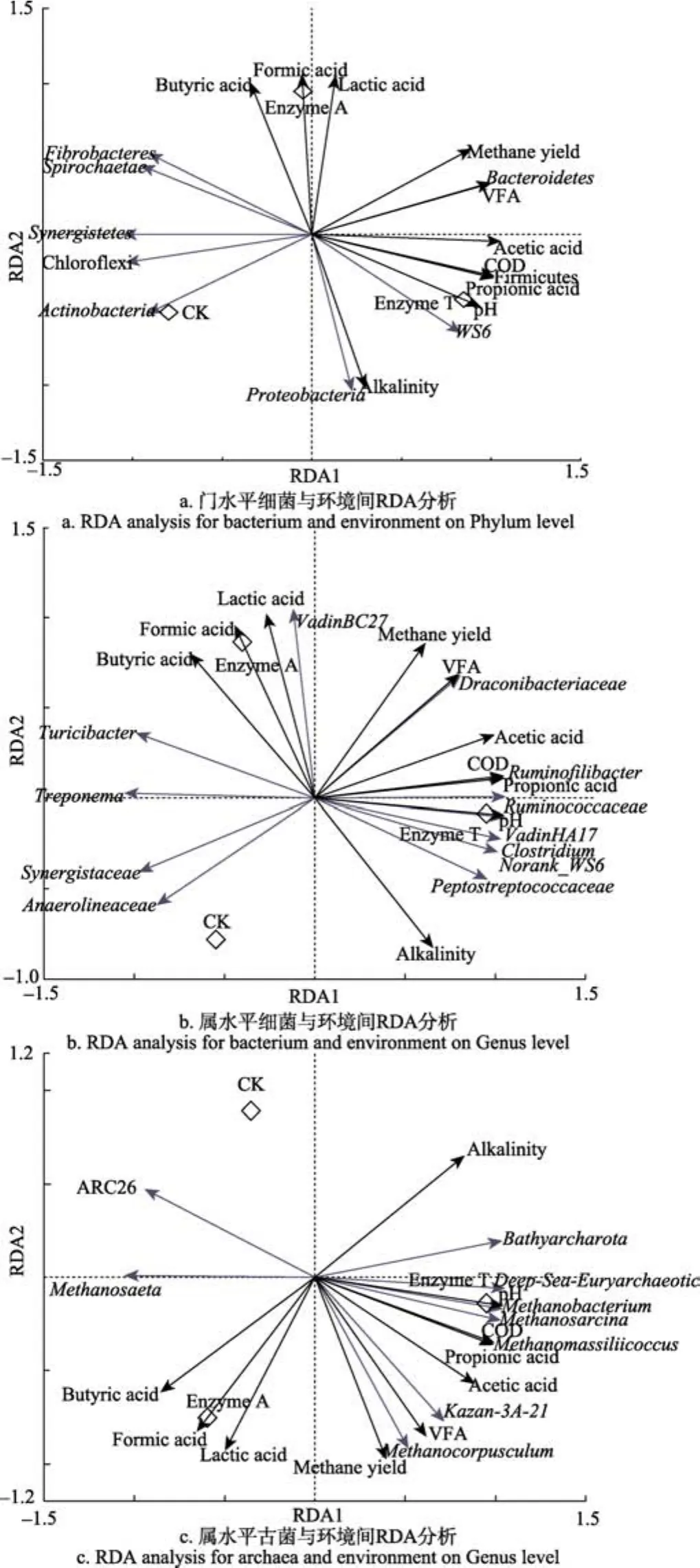
图5 微生物与环境间的RDA分析Fig.5 RDA analysis between microorganism and environment
3 结 论
本研究利用哈茨木霉和黑曲霉通过固态发酵从农业废弃物中生产木质纤维素分解酶,用于玉米秸秆厌氧发酵的前处理。研究发现:
1)在玉米秸秆的厌氧发酵过程中,酶T处理组、酶A处理组发酵起始VFA浓度增加,主要体现为乙酸的增加;后期丙酸为VFA的重要组成酸;sCOD/VFA具有和碱度/VFA相同的变化趋势。
2)经过6 d的预处理,酶T处理组和酶A处理组玉米秸秆厌氧发酵20 d的累积产甲烷量较对照组分别提高了7.79%和10.06%。纤维素酶的预处理在秸秆的甲烷转化中起到了积极的促进作用。
3)厌氧发酵24 h,酶T处理组中9个属的细菌丰度显著高于 CK组,其中 Clostridium,vadinBC27,Ruminofilibacter与纤维素的降解有关。酶预处理增强了厌氧发酵体系中分解纤维素细菌的丰度,从而促进纤维素分解,使之分解成产甲烷菌易于利用的营养物质。发酵系统中古菌主要为 Methanosaeta,Bathyarchaeota,Methanosarcina及Methanobacterium等。预处理影响了发酵系统中微生物的菌群结构,对改善发酵条件具有重要的调节作用。
[1] World energy outlook 2014 [R]. International Energy Agency,Paris, 2014.
[2] Pellegrino S, Lanzini A, Leone P. Greening the gas network-The need for modelling the distributed injection of alternative fuels [J]. Renew Sustain Energy Rev, 2017, 70: 266-286.
[3] Muñoz R, Meier L, Diaz I, et al. A review on the state-of-the-art of physical/chemical and biological technologies for biogas upgrading[J]. Rev Environ Sci Biotechnol, 2015,14: 727-759.
[4] 程序,朱万斌. 创建若干 10×108m3级生物天然气“气田”可行性分析[J]. 中外能源,2012 (7):24-28.Cheng Xu, Zhu Wanbin. Feasibility study into building 10×108m3biogas fields[J]. Sino-Global Energy,2012 (7): 24-28. (in Chinese with English abstract)
[5] Ward A J, Hobbs P J, Holliman P J, et al. Optimization of the anaerobic digestion of agricultural resources[J]. Bioresour Technol, 2008, 99: 7928-7940.
[6] Asam Z Z, Poulsen T G, Nizami A S, et al. How can we improve biomethane production per unit of feedstock in biogas plants? [J] Appl Energy, 2011, 88: 2013-2018.
[7] Liu Shan, Wu Shubiao, Pang Changle, et al. Microbial pretreatment of corn stovers by solid-state cultivation of Phanerochaete chrysosporium for biogas production[J]. Appl Biochem Biotechnol, 2014, 172: 1365-1376.
[8] Mustafa A M, Poulsen T G, Sheng K. Fungal pretreatment of rice straw with Pleurotus ostreatus and Trichoderma reesei to enhance methane production under solid-state anaerobic digestion [J]. Appl Energy, 2016, 180: 661-671.
[9] Lubken M, Koch K, Gehring T, et al. Parameter estimation and long-term process simulation of a biogas reactor operated under trace elements limitation [J]. Appl Energy, 2015, 142:352-360.
[10] Behera S, Arora R, Nandhagopal N, et al. Importance of chemical pretreatment for bioconversion of lignocellulosic biomass [J]. Renew Sustain Energy Rev, 2014, 36: 91-106.[11] Zheng Yi, Zhao Jia, Xu Fuqing, et al. Pretreatment of lignocellulosic biomass for enhanced biogas production [J].Prog Energy Combust Sci, 2014, 42: 35-53.
[12] Zhao Xiaoling, Liu Jinhuan, Liu Jingjing, et al. Effect of ensiling and silage additives on biogas production and microbial community dynamics during anaerobic digestion of switchgrass [J]. Bioresour Technol, 2017, 241: 349-359.
[13] Zou Shuzhen, Wang Hui, Wang Xiaojiao, et al. Application of experimental design techniques in the optimization of the ultrasonic pretreatment time and enhancement of methane production in anaerobic co-digestion [J]. Appl Energy, 2016,179: 191-202.
[14] Xiao Xiao, Zhang Ruihong, He Yanfeng, et al. Influence of particle size and alkaline pretreatment on the anaerobic digestion of corn stover [J]. BioResour, 2013, 8: 5850-5860.
[15] Feng Yongzhong, Zhao Xiaoling, Guo Yan, et al. Changes in the material characteristics of maize straw during the pretreatment process of methanation[J]. J Biomed Biotechnol,2012, doi:10.1155/2012/325426.
[16] Chandra R, Takeuchi H, Hasegawa T, et al. Improving biodegradability and biogas production of wheat straw substrates using sodium hydroxide and hydrothermal pretreatments [J]. Energy, 2012, 43: 273-282.
[17] Libardi N, Soccol C R, Góes-Neto A, et al. Domestic wastewater as substrate for cellulase production by Trichoderma harzianum [J]. Process Biochem, 2017, 57: 190-199.
[18] Quiñones T S, Plöchl M, Budde J, et al. Enhanced methane formation through application of enzymes: Results from continuous digestion tests [J]. Energ Fuel, 2011, 25: 5378-5386.
[19] Karray R, Hamza M, Sayadi S. Evaluation of ultrasonic, acid,thermo-alkaline and enzymatic pre-treatments on anaerobic digestion of Ulva rigida for biogas production [J]. Bioresour Technol, 2015, 187: 205-213.
[20] Lan Tianqing, Wei Dong, Yang Shangtian, et al. Enhanced cellulase production by Trichoderma viride in a rotating fibrous bed bioreactor [J]. Bioresour Technol, 2013, 133: 175-182.
[21] Adsul M, Ghule J, Singh R. Polysaccharides from bagasse:applications incellulase and xylanase production[J].Carbohydr Polym, 2004, 57: 67-72.
[22] APHA. Standard Methods for the Examination of Water and Wastewater[M]. American Public Health Association,Washington, DC, USA, 2005.
[23] Guo Peng, Mochidzuki K, Cheng Wei, et al. Effects of different pretreatment strategies on corn stalk acidogenic fermentation using a microbial consortium [J]. Bioresour Technol, 2011, 102: 7526-7531.
[24] 马旭光. 纤维质物料高含固率连续厌氧发酵工艺及其高效产甲烷机制[D]. 北京:中国农业大学,2014.Ma Xuguang. A Technology of Continuous High-solid Content Anaerobic Digestion of Lignocellulosic Feedstock and Mechanism of Efficient Methane Production[D]. Beijing:China Agricultural University, 2014. (in Chinese with English abstract)
[25] 楚莉莉,李轶冰,冯永忠,等. 沼液预处理对小麦秸秆厌氧发酵产气特性的影响[J]. 干旱地区农业研究,2011,29(1):247-251.Chu Lili, Li Yibing, Feng Yongzhong, et al. Effect of biogas slurry pretreatment on biogas production characteristics of anaerobic fermentation of wheat straw [J]. Agricultural Research in the Arid Areas, 2011, 29(1): 247-251. (in Chinese with English abstract)
[26] Zhao Xiaoling, Luo Kai, Zhang Yue, et al. Improving the methane yield of maize straw: Focus on the effects of pretreatment with fungi and their secreted enzymes combined with sodium hydroxide [J]. Bioresour Technol, 2017,https://doi.org/10.1016/j.biortech.2017.09.160.
[27] 连莉文,万秀林,郭学敏,等. 沼气发酵常规分析[M]. 北京:北京科学技术出版社,1984.
[28] Kuruti K, Begum S, Ahuja S, et al. Exploitation of rapid acidification phenomena of food waste in reducing the hydraulic retention time (HRT) of high rate anaerobic digester without conceding on biogas yield [J]. Bioresour Technol, 2017, 226: 65-72.
[29] 伯杰. 细菌鉴定手册[M] 第八版. 北京: 科学出版社,1984.
[30] Leadbetter J R, Schmidt T M, Graber J R, et al. Acetogenesis from H2plus CO2by spirochetes from termite guts [J].Science, 1999, 283: 686-689.
[31] Dubinina G, Grabovich M, Leshcheva N, et al. Spirochaeta perfilievii sp. nov., an oxygen-tolerant, sulfide-oxidizing,sulfur-and thiosulfate-reducing spirochaete isolated from a saline spring [J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61: 110-117.
[32] Jumas-Bilak E, Roudiere L, Marchandin H. Description of“Synergistetes” phyl. Nov. and emended description of the phylum “Deferribacteress” and of the family Syntrophomonadaceae, phylum “Firmicutes”[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59: 1028-1035.
[33] He Y, Li M, Perumal V, et al. Genomic and enzymatic evidence for acetogenesis among multiple lineages of the archaeal phylum Bathyarchaeota widespread in marine sediments[J]. Nature Microbiology, 2016, doi:10.1038/nmicrobiol.2016.35
[34] Lang K, Schuldes J, Klingl A, et al. Comparative genome analysis of “Candidatus Methanoplasma termitum” indicates a new mode of energy metabolism in the seventh order of methanogens[J]. Applied and Environmental Microbiology,2014, 81(4): 1338-1352.
[35] 张坚超,徐镱钦,陆雅海. 陆地生态系统甲烷产生和氧化过程的微生物机理[J]. 生态学报,2015,35(20):6592-6603.Zhang Jianchao, Xu Yiqin, Lu Yahai. Microbial mechanisms of methane production and oxidation in terrestrial ecosystems[J]. Acta Ecologica Sinica, 2015, 35(20): 6592-6603. (in Chinese with English abstract)
