核糖核酸酶抑制因子与整合素连接激酶相互作用通过ILK/AKT/mTOR通路抑制膀胱癌体内外生长
2018-03-01陈俊霞
邢 雷,庄 翔,陈俊霞
1.重庆医科大学附属第一医院内分泌乳腺外科,重庆 400016
2.重庆医科大学细胞生物学与遗传学教研室,重庆 400016
膀胱癌是泌尿系统高发的恶性肿瘤,全球每年约430 000例新发病例,但目前膀胱癌的治疗尚无有效靶点,因此,阐明膀胱癌发生、发展的关键环节与分子机制具有重要的意义[1]。核糖核酸酶抑制因子(ribonuclease inhibitor,RI)是细胞质内一个由460个氨基酸组成的酸性蛋白,既往研究发现,RI结构中含有7个串联的亮氨基酸残基重复片段(leucin-rich repeat,LRR),其为蛋白质相互作用提供了特有的巨大表面[2]。前期运用GST蛋白沉降技术与免疫共沉淀等已证明RI与整合素连接激酶(intergrin-linked kinase,ILK)在体内外直接结合[3]。ILK是一个丝氨酸/苏氨酸激酶家族的成员,其位于细胞黏着斑上,可以靶向催化蛋白激酶B(protein kinase B,PKB/AKT)并活化下游的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)[4]。ILK/AKT/mTOR通路已被发现参与调节细胞增殖、分化与凋亡等许多功能,其过度激活与多种肿瘤的恶性增殖密切相关[5-6]。但目前,RI是否可以通过与ILK相互作用调控ILK/AKT/mTOR通路并影响膀胱癌体内外生长尚未见报道,且RI在膀胱癌发生中的功能与机制尚未完全阐明。本研究通过探讨RI与ILK相互作用分析RI对膀胱癌体内外生长抑制的作用,并揭示潜在的分子机制,为RI作为膀胱癌诊断及治疗的新靶点提供理论依据。
1 材料和方法
1.1 主要试剂及细胞株
人膀胱癌EJ细胞系购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库;4周龄(20±3) g雄性SPF级BALB/C裸鼠由重庆医科大学实验动物中心提供(合格证号:SCXK Chongqing2007-0001);胎牛血清、RPMI-1640购自美国Gibco公司;LipofectamineTM2000购自美国Invitrogen公司;ILK基因过表达载体pCMV-3×flag-ILK与阴性对照空载pCMV-3×f l ag,RI基因过表达慢病毒LV5-RI homo与阴性对照LV5-NC由重庆医科大学分子医学与肿瘤研究中心保存[3];细胞计数试剂盒(cell counting kit-8,CCK-8)购自日本株式会社同仁化学研究所;细胞周期检测试剂盒购自美国Sigma公司;兔抗人RI多克隆抗体由本实验室保存;兔抗人AKT、p-AKT、GSK3β、p-GSK3β、PI3K、p-PI3K、PETN、p-PETN、mTOR、p-mTOR、β-catenin、β-actin及鼠抗人ILK购自美国Bioworld公司;荧光二抗、免疫组织化学试剂盒和DAB试剂购自北京中杉金桥生物技术有限公司。
1.2 细胞培养、转染与慢病毒感染
含10%胎牛血清的RPMI-1640培养基于37 ℃、CO2体积分数为5%的温箱中培养EJ细胞。取对数生长期的EJ细胞,接种于6孔板中。按照说明书,用LipofectamineTM2000分别转染ILK过表达载体pCMV-3×flag-ILK或空载阴性对照pCMV-3×flag至EJ细胞,48 h后以0.4 g/ L的G418筛选14 d,分别挑取单克隆细胞团扩大培养,细胞收获后分别命名为EJ-ILK或EJFLAG。另取生长增殖状态良好的EJ细胞接种于6孔板中,以MOI=20的RI过表达慢病毒LV5-RI homo或阴性对照LV5-NC感染EJ细胞,48 h后,以0.2 g/L的嘌呤霉素筛选细胞收获后分别命名为EJ-RI或EJ-LV5。
1.3 蛋白[质]印迹法(Western blot)分析蛋白表达
按照既往研究所述[7],收集各组细胞,RIPA裂解后获得细胞总蛋白裂解液,然后以每孔30 μg上样,经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳后转移至PVDF膜,用5%脱脂奶粉常温封闭PVDF膜2 h,4 ℃下1∶500稀释的一抗温育过夜,再以1∶2 000稀释的HRP标记的二抗于37 ℃下温育2 h,ECL发光显色,并用Quantity One软件进行定量分析。
1.4 免疫荧光检测与荧光共振能量转移技术(fluorescence resonance energy transfer,FRET)
各组细胞爬片或冰冻组织切片后,分别用80%冷丙酮固定10 min,加适量0.1%TritonX-100通透,冰上静置10 min后,PBS洗3遍,37 ℃下用3%牛血清蛋白封闭30 min,随后4 ℃的条件下用1∶100稀释的一抗温育过夜,用PBS洗细胞3遍,每次5 min,再用荧光二抗于37 ℃下温育2 h,除ILK使用488标记的羊抗鼠二抗,其余均用Cy3标记的羊抗兔二抗。细胞或组织荧光图像于Leica激光共聚焦显微镜下进行获取。FRET实验详细步骤按照既往研究所述[8],先用免疫荧光法对EJ细胞内RI与ILK蛋白进行荧光标记,Leica激光共聚焦显微镜下先分别观察受体Cy3-RI与供体488-ILK发出的红色和绿色荧光,然后再以543 nm强激发波长进行受体荧光Cy3-RI淬灭漂白,根据FRET检测原理,若受体与供体存在相互作用且距离小于10 nm,淬灭后供体荧光488-ILK的强度将增强。
1.5 CCK-8分析细胞增殖
在96孔板中接种各组细胞悬浊液,每孔约5×103个细胞,并置于37 ℃、CO2体积分数为5%的温箱中培养。使用CCK-8根据说明书进行实验:分别在培养24、48、72、96和120 h后,向每孔加入10 μL的CCK-8溶液,随后继续于37 ℃、CO2体积分数为5%的温箱中培养3.5 h,之后用酶标仪测定各孔450 nm处吸光度(D)值,本实验每组重复3次。
1.6 流式细胞术分析细胞周期
消化并收集各组细胞,并用预冷PBS洗涤3次,以800 r/min离心5 min后,用70%的乙醇溶液重悬细胞,并于4 ℃下用70%乙醇溶液固定过夜,随后以800 r/min离心5 min后将乙醇吸除,加入PBS缓冲液洗涤,再加入0.5 mL的50 μg/mL的PI溶液室温下避光染色30 min,PI标记后使用流式细胞仪分析细胞周期分布,本实验每组重复3次。
1.7 裸鼠移植瘤模型与免疫组织化学分析移植瘤组织
按照既往研究所述[7],消化并收集各组对数生长期的细胞,用PBS制备悬浊液,并以约2×106个细胞/只接种于4周龄雄性BALB/c裸鼠背部皮下组织,每组10只,30 d后处死裸鼠,获取移植瘤并称重,对移植瘤组织石蜡固定包埋或液氮冰冻处理。制作瘤组织的石蜡切片,随后用二甲苯梯度脱蜡,用3%H2O2溶液灭活过氧化物酶,枸橼酸钠抗原修复,5%山羊血清室温封闭20 min,随后4 ℃下1∶100稀释的一抗温育过夜,生物素化二抗37 ℃温育30 min,链霉素抗生素-过氧化物酶溶液37 ℃温育20 min,DAB显色,苏木精复染3 min,二甲苯脱水,封片。采用半定量结果判断,每张切片上观察5个高倍视野(×200),计数阳性细胞百分比,阳性细胞数小于5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。阳性着色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两者计分相乘即为阳性等级:0分为阴性,1~4分为弱阳性,5~8分为阳性,9~12分为强阳性。
1.8 统计学处理
应用SPSS 22.0软件进行统计学分析,结果以x±s表示,两样本均数比较采用双尾t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 RI与ILK在EJ细胞中的共定位
用免疫荧光技术,Alexa 594标记RI蛋白(红色),Alexa 488标记ILK蛋白(绿色),并用Dapi染核(蓝色),激光共聚焦扫描观察到RI在EJ细胞质与细胞核中均有表达,ILK主要分布在细胞质中,两者融合之后可以观察到黄色区域出现,RI与ILK在EJ细胞中存在共定位的现象(图1)。
2.2 RI与ILK的相互作用
用荧光染料Cy3标记RI(红色),荧光染料488标记ILK(绿色),先分别观察细胞中RI与ILK发出的红色与绿色荧光,随后以543 nm的强激发光对Cy3进行淬灭,阻遏488-ILK至Cy3-RI的能量转移,结果发现,淬灭Cy3之后,供体488-ILK的荧光强度明显增强(图2),说明488-ILK与Cy3-RI存在荧光能量的转移。

图 1 EJ细胞中RI与ILK的共定位Fig. 1 The co-localization of RI and ILK in EJ cells

图 2 FRET鉴定RI与ILK的相互作用Fig. 2 FRET assay demonstrated the interaction between RI and ILK
2.3 RI与ILK相互作用调控ILK/AKT/mTOR通路
EJ细胞中上调RI组(EJ-RI组)RI的相对表达量为1.17±0.13,对照组(EJ-LV5组)RI的相对表达量为0.36±0.09,EJ细胞中过表达RI显著升高RI的表达量(P<0.05)。EJ-RI组ILK的相对表达量为0.21±0.16,EJ-LV5组ILK的相对表达量为1.26±0.11,过表达RI显著抑制ILK的蛋白表达水平(P<0.05,图3)。
EJ细胞中过表达RI组与对照组相比,显著降低p-AKT、p-GSK3β、p-PI3K、p-PTEN、p-mTOR及β-catenin的蛋白水平;而过表达ILK组与对照组相比,显著升高p-AKT、p-GSK3β、p-PI3K、p-PTEN、p-mTOR及β-catenin的蛋白水平(P均<0.05,图4)。上述结果表明,膀胱癌EJ细胞中上调RI抑制ILK/AKT/mTOR通路活化,而上调ILK促进ILK/AKT/mTOR通路激活。
2.4 RI与ILK相互作用调节细胞增殖
连续观察120 h后,上调RI的EJ细胞(EJ-RI组)D450值为2.37±1.14,对照组(EJ-LV5组)D450值为3.61±0.05,上调RI显著抑制EJ细胞增殖与活力(P<0.05);而上调ILK的EJ细胞(EJ-ILK)D450值为4.42±0.09,对照组(EJ-FLAG组)D450值为3.31±0.12,上调ILK与对照相比细胞增殖与活力明显增强(P<0.05,图5)。

图 3 Western blot分析RI与ILK表达量变化Fig. 3 The relative protein levels of RI and ILK detected by Western blot
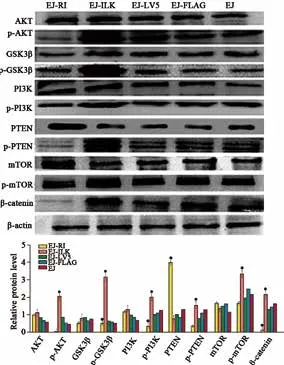
图 4 Western blot分析ILK/AKT/mTOR通路相关蛋白表达量变化Fig. 4 The relative protein levels of the molecules related to ILK/AKT/mTOR pathway detected by Western blot

图 5 CCK-8法检测细胞增殖与活力Fig. 5 CCK-8 assays tested cell proliferation and viability
2.5 RI与ILK相互作用调节细胞周期
上调ILK的EJ细胞(EJ-ILK组)G1期细胞为64.99%±3.13%,对照EJ-FLAG组G1期细胞为54.24%±1.15%。上调RI的EJ细胞(EJ-RI组)S期细胞为52.88%±2.18%,对照组(EJ-LV5组)S期细胞为30.88%±2.24%,上调RI将细胞周期有效阻滞于S期(P<0.05,图6)。

图 6 流式细胞术分析细胞周期Fig. 6 The cell cycle analysis was performed using fl ow cytometry
2.6 RI与ILK相互作用对裸鼠移植瘤生长的影响
各组稳定转染细胞接种于裸鼠每组10只,30 d后处死裸鼠并测量瘤重,结果显示,上调RI组(EJ-RI组)移植瘤瘤重为(0.51±0.14) g,对照组(EJ-LV5组)瘤重为(1.12±0.17) g,上调RI组与对照组相比瘤重明显降低(P<0.05)。而上调ILK组(EJ-ILK组)移植瘤瘤重为(2.03±0.16) g,对照组(EJ-FLAG组)瘤重为(0.83±0.18) g,上调ILK组与对照组相比瘤重显著增加(P<0.05,图7)。
2.7 RI与ILK相互作用对移植瘤ILK/AKT/mTOR通路蛋白表达的影响
移植瘤中,EJ-RI组RI表达呈强阳性,ILK及p-mTOR均呈阴性,p-AKT呈弱阳性。而EJ-ILK组RI表达呈弱阳性,ILK、p-AKT及p-mTOR均呈强阳性(图8)。

图 7 裸鼠膀胱癌移植瘤代表性图像及瘤重Fig. 7 Representative images of bladder cancer xenografts and tumor weights

图 8 免疫组织化学分析移植瘤组织中RI、ILK、p-AKT及p-mTOR的表达Fig. 8 Immunohistochemistry analysis for RI, ILK, p-AKT and p-mTOR in xenografts
移植瘤切片中,E J-R I组p-A K T、p-GSK3β、p-PI3K、p-PTEN、p-mTOR及β-catenin的荧光强度明显低于对照组,而EJILK组p-AKT、p-GSK3β、p-PI3K、p-PTEN、p-mTOR及β-catenin的荧光强度明显高于对照组(图9)。

图 9 免疫荧光分析移植瘤组织ILK/AKT/mTOR通路相关蛋白的表达Fig. 9 Immunof l uorescence staining for proteins related to ILK/AKT/mTOR pathway in xenografts
3 讨 论
蛋白质相互作用控制着细胞信号转导、跨膜转运、DNA合成及转录调控等生命过程,在生命活动中发挥重要作用。RI是一个具有多功能的蛋白质调节分子,通过抑制核糖核酸酶A(RNaseA)的活性调节mRNA、rRNA等的含量[9]。既往研究发现,RI能与具有低RNaseA活性的血管生成素(angiogenin,ANG)结合并发生相互作用[8]。RI灭活ANG的活性不仅强烈抑制肿瘤的血管生成,并能阻碍ANG介导的rRNA的转录与核糖体的生成[10-11]。另外,RI结构中具有特殊的LRR模体,即两段平行排列的α-螺旋中存在每隔7个规律性排列的亮氨酸残基,这为蛋白质相互作用提供了有效的平台[2]。根据蛋白质结构推测,RI可能具有除抑制RNaseA外的其他蛋白质相互作用的功能。
人类RI、ILK基因均定位于11号染色体短臂1区5带,具有高度同源性。前期研究运用GST蛋白沉降技术发现,RI与ILK在体外结合,并用进一步运用免疫共沉淀检测RI与ILK蛋白在真核细胞内的结合作用,证实RI与ILK蛋白在体内外均能直接结合[3]。本研究运用免疫荧光标记观察到,绿色荧光标记的ILK蛋白与红色荧光标记的RI蛋白在细胞质和细胞核均有明显的重叠,有研究表明,这种共定位现象的存在可在一定程度上说明两者存在相互作用[12]。另外,FRET实验也发现,荧光标记的RI与ILK蛋白间存在荧光能量的转移,提示RI与ILK蛋白在体内距离在10 nm之内,是这两个蛋白质分子存在直接相互作用的重要证据[13]。接下来,本研究在人膀胱癌EJ细胞系与裸鼠移植瘤模型中进一步观察RI与ILK相互作用产生的功能,发现过表达RI能在体内外显著抑制ILK蛋白的表达水平,抑制膀胱癌EJ细胞的增殖,导致细胞S期阻滞,并且抑制膀胱癌抑制瘤的体内生长。而过表达ILK解除了RI抑癌基因的功能,显示出相反的结果,提示RI与ILK的相互作用是互相拮抗的。
ILK介导的ILK/AKT/mTOR通路是调节细胞增殖、分化及凋亡的关键通路之一,已在多种肿瘤中发现其过度活化的现象[14-15]。有研究证实,ILK使AKT的Ser473位点磷酸化,并活化下游的mTOR促进真核启动因子对原癌蛋白的翻译;ILK还可以通过磷酸化GSK3的Ser9位点使其灭活,从而升高周期蛋白D1(cyclin D1)水平并促进增殖;另外,ILK还可以上调β联蛋白(β-catenin)并激活LEF/Tcf介导的转录[16-17]。本研究发现,过表达ILK在体内外显著升高p-AKT、p-GSK3β、p-PI3K、p-mTOR及β-catenin等蛋白的磷酸化水平,激活ILK/AKT/mTOR通路,而过表达RI降低了ILK的表达水平,显著抑制ILK/AKT/mTOR信号通路活化。既往研究发现,RI能显著抑制肿瘤细胞的侵袭、转移及上皮-间质转化(epithelialmesenchymal transition,EMT),下调RI促进了膀胱癌的生长、转移,但关于RI调节肿瘤生长转移的具体机制尚不清楚[18-19]。本研究提示,RI可能通过抑制ILK的表达与ILK/AKT/mTOR通路的活化发挥抑癌基因的作用。
综上所述,RI显著抑制膀胱癌体内外生长,可能部分通过与ILK相互作用,并抑制ILK/AKT/mTOR通路激活。本研究结果揭示了RI在膀胱癌中的新机制,为膀胱癌的诊断与治疗提供了新靶点。
[1] KAMAT A M, HAHN N M, EFSTATHIOU J A, et al. Bladder cancer [J]. Lancet, 2016, 388(10061): 2796-2810.
[2] FURIA A, MOSCATO M, CALì G, et al. The ribonuclease/angiogenin inhibitor is also present in mitochondria and nuclei[J]. FEBS Lett, 2011, 585(4): 613-617.
[3] 庄 翔, 张潞渝, 吕梦欣, 等. 核糖核酸酶抑制因子与整合素连接激酶的相互作用以及对体外血管生成的影响[J]. 基础医学与临床, 2016, 36(8): 1074-1079.
[4] BUITENHUIS M, VAN DER LINDEN E, ULFMAN L H,et al. Protein kinase B (PKB/c-akt) regulates homing of hematopoietic progenitors through modulation of their adhesive and migratory properties [J]. Blood, 2010, 116(13): 2373-2384.
[5] MCDONALD P C, FIELDING A B, DEDHAR S. Integrinlinked kinase--essential roles in physiology and cancer biology [J]. J Cell Sci, 2008, 121(Pt 19): 3121-3132.
[6] QU Y, HAO C, XU J, et al. ILK promotes cell proliferation in breast cancer cells by activating the PI3K/Akt pathway [J].Mol Med Rep, 2017, 16(4): 5036-5042.
[7] 庄 翔, 朱 军, 吕梦欣, 等. 特异性ILK siRNA对膀胱癌EJ细胞EMT及移植瘤生长的影响 [J]. 基础医学与临床,2016, 36(2): 191-198.
[8] 李 林, 舒 静, 刘玉林, 等. 核糖核酸酶抑制因子与血管生成素的相互作用[J]. 第三军医大学学报, 2014,36(14): 1454-1458.
[9] JOHNSON R J, MCCOY J G, BINGMAN C A, et al. Inhibition of human pancreatic ribonuclease by the human ribonuclease inhibitor protein [J]. J Mol Biol, 2007, 368(2): 434-449.
[10] PIZZO E, SARCINELLI C, SHENG J, et al. Ribonuclease/angiogenin inhibitor 1 regulates stress-induced subcellular localization of angiogenin to control growth and survival [J].J Cell Sci, 2013, 126(Pt 18): 4308-4319.
[11] FURIA A, MOSCATOM, CALÌ G, et al. The ribonuclease/angiogenin inhibitor is also present in mitochondria and nuclei[J]. FEBS Lett, 2011, 585(4): 613-617.
[12] LALONDE S, EHRHARDT D W, LOQUÉ D, et al. Molecular and cellular approaches for the detection of protein-protein interactions: latest techniques and current limitations [J].Plant J, 2008, 53(4): 610-635.
[13] LOU X Y, SONG N, YANG Y W. Fluorescence resonance energy transfer systems in supramolecular macrocycLnc chemistry [J]. Molecules, 2017, 22(10): E1640.
[14] SHIRLEY L A, MCCARTY S, YANG M C, et al. Integrinlinked kinase affects signaling pathways and migration in thyroid cancer cells and is a potential therapeutic target [J].Surgery, 2016, 159(1): 163-170.
[15] SATHE A, NAWROTH R. Targeting the PI3K/AKT/mTOR pathway in bladder cancer [J]. Methods Mol Biol, 2018,1655: 335-350.
[16] ALTOMARE D A, KHALEDA R. Homeostasis and the importance for a balance between AKT/mTOR activity and intracellular signaling [J]. Curr Med Chem, 2012, 19(22):3748-3762.
[17] PONTIER S M, HUCK L, WHITE D E, et al. Integrinlinked kinase has a critical role in ErbB2 mammary tumor progression: impLncations for human breast cancer [J].Oncogene, 2010, 29(22): 3374-3385.
[18] PAN X, XIONG D, YAO X, et al. Up-regulating ribonuclease inhibitor inhibited epithelial-to-mesenchymal transition and metastasis in murine melanoma cells [J]. Int J Biochem Cell Biol, 2012, 44(6): 998-1008.
[19] XIONG D, LIOU Y, SHU J, et al. Down-regulating ribonuclease inhibitor enhances metastasis of bladder cancer cells through regulating epithelial-mesenchymal transition and ILK signaling pathway [J]. Exp Mol Pathol, 2014,96(3): 411-421.
