吸烟相关性喉癌遗传易感基因的初步研究
2018-03-01王胜资
朱 奕,郭 荦,王胜资
1.复旦大学附属眼耳鼻喉科医院放疗科,上海 200031;
2.复旦大学附属眼耳鼻喉科医院实验中心,上海 200031
喉癌的发生率占全身恶性肿瘤的1%~5%[1]。2012年全球喉癌发病约138 102例,因喉癌死亡约73 261例[2]。流行病学调查显示,吸烟是促进喉癌发生的最为重要的外在因素[3]。然而肿瘤的发生除了外在因素的促进作用,还存在内在的遗传易感性。不同的遗传背景对肿瘤的易感存在一定差异。英国研究者Doll等[4]在20世纪50年代就通过大样本的调查和随访工作发现,肺癌最重要的危险因素是吸烟,但在随访中发现,同样的吸烟量和吸烟年限,却只有不到20%的调查者最终会发展为肺癌。这一研究结果提示,尽管暴露在同样的危险因素之下,不同的个体或种系对肿瘤的易感性存在着差异,即易感性是由遗传基因的差异决定个体患肿瘤的风险。单核苷酸多态性(single nucleotide polymorphism,SNP)是目前人类遗传变异中最常见的一种多态性,是指由单个核苷酸的变化引起的DNA序列多态性的改变,90%以上的遗传变异来自于此,平均每500~1 000个碱基对中就有1个。因此,目前对肿瘤等疾病遗传易感基因的研究重点为SNP的研究[5],包括癌基因与抑癌基因SNP、DNA修复基因SNP、代谢酶SNP及免疫相关基因SNP方面与肿瘤遗传易感性的探讨。本研究基于单碱基延伸反应和酶放大系统原理,根据待检测样品的SNP位点5’端序列,设计带有双重功能的SBE引物序列,并将其直接固定于生物传感器上,加入与突变碱基互补的、有生物学标记的ddNTP,在DNA多聚酶的催化下直接进行固相单碱基延伸反应,最后对其生物学信号进行检测。为了确保检测技术的准确性及操作的可重复性,我们对该次检测的22个位点中的rs1047768、rs17655、rs4771436、rs1048943、rs1052133、rs1801320、rs2298881、rs3212961和rs9928731位点进行了再次检测,结果显示,两次检测结果完全一致,确保了该实验技术的准确性。
目前关于喉癌的遗传易感基因的研究不十分全面细致,即使有报道也是单个基因或单个核苷酸片段的研究,故对于指导喉癌的早期预防检测等作用方面可用的信息较少。本研究根据文献将之前学者报道的与烟草相关的头颈部肿瘤的遗传易感基因进行总结,包括ERCC5、CYP1A1、OGG1、RAD51、ERCC1、MMP2和MMP3。对这些高危基因及SNP片段进行集中检测,希望发现与吸烟相关性喉癌密切关联的多个基因及片段。此外,由于烟草焦油中的苯比芘等有害物质能够促进DNA的改变,烟草本身具有改变基因活性及表型的能力,且大多数喉癌患者具有长期严重的吸烟史,因此,在进行喉癌遗传易感基因的研究设计中,必须考虑吸烟情况这一重要因素的影响。本研究要求试验组与对照组的观察对象的吸烟指数均大于400/年支,在控制了外在促进因素的前提下对内在易感基因进行研究,更全面和客观的了解喉癌的遗传易感基因,为喉癌的预防及早期干预提供客观可靠的实验室依据。
1 资料和方法
1.1 入组情况
所有入组者均具有长期吸烟史(其吸烟指数大于等于400/年支),排除了复发、远处转移患者以及有其他严重基础疾病者。试验组为经复旦大学附属眼耳鼻喉科医院治疗的男性喉癌患者94例,分别采集年龄、吸烟史、吸烟量、肿瘤分期、治疗方式和发病部位等资料。对照组为高危吸烟人群148例,均无肿瘤病史。
1.2 血样及DNA采集
所有参与者在研究开始之前均签署了知情同意书并采集5 mL的外周血,将样品储存在-20 ℃条件下备用。使用酚-氯仿提取法(QIAGEN DNA Mini和Blood Mini Kits)从全血中提取基因组DNA。根据文献报道的前期研究结果选取与吸烟相关性肿瘤发生密切相关的候选基因,分别为ERCC5、CYP1A1、OGG1、RAD51、ERCC1、MMP2和MMP3;进一步在基因库选取SNP片段,采用Sequenom SNP检测技术完成SNP基因片段检测。使用Sequenom®Assay Design 3.1版软件[购自生工生物工程(上海)股份有限公司]设计引物序列(表1)。PCR反应条件如下:95 ℃初始变性2 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s;最后在72 ℃延伸5 min,45个循环。使用Sequenom MassARRAY Assay Design 3.0软件设计了多重SNP MassEXTEND测定。使用具有标准方案的Sequenom MassARRAY RS1000平台检测基因型和等位基因,并使用Sequenom Typer 4.0软件分析数据。
选取的基因及片段包括ERCC5(rs1047768、rs17655、rs4771436)、CYP1A1(rs1048943、rs382604、rs4646903)、OGG1(rs1052133、rs2072668、rs2075747、rs3219008)、RAD51(rs1107029、rs1801320、rs4924500)、ERCC1(rs11615、rs2298881、rs3212961)、MMP2(rs243865、rs7202、rs9928731)和MMP3(rs522616、rs650108、rs679620)。
1.3 统计学处理
采用独立的双样本t检验,Cochran-Mantel-Haenszel检验和χ2检验来分析试验组和对照组的基线特征。采用SPSS 17.0软件包分析一般临床资料,以评估吸烟与疾病进展之间的相关性。使用χ2检验来检查Hardy-Weinberg平衡(Hardy-Weinberg equilibrate,HWE)。使用SPSS 17.0统计软件包分析基因型或等位基因与喉癌发生之间的关系。然后根据软件包分析的结果总结与吸烟相关的喉癌相关遗传易感基因。条件多变量逻辑回归模型用于计算OR和95%CI。分层分析在控制吸烟外部因素后基因型和等位基因对喉癌风险的影响。P<0.05为差异有统计学意义。
2 结 果
2.1 试验组及对照组基本临床资料
试验组及对照组基本临床资料见表2,差异均无统计学意义(P>0.05)。
2.2 T分期、N分期及临床分期与吸烟程度的相关性
T分期与吸烟程度之间没有显著相关性,但是N分期及临床分期与吸烟程度有显著相关性(表3)。
2.3 Hardy-Weinbery平衡检验
平衡检验结果显示,试验组与对照组21个位点的基因型分布均未偏离HWE所示(P>0.05),提示试验组与对照组均未受到遗传因素干扰(表4)。
2.4 SNP位点与喉癌发生的相关性分析情况
试验组94例喉癌患者中,93例检测成功,其中1例由于DNA质量原因检测失败;对照组148例全部检测成功。22个SNP片段中21个均检测成功,其中rs4646903片段由于质谱原因未检测成功。根据检测结果分别计算每个位点基因型及等位基因的表达频率,进行数据统计后结合P值及OR值分析检测结果。结果显示,MMP2-rs243865与MMP3-rs522616这两个基因位点与喉癌发生、密切相关,可能是喉癌发生、发展的遗传易感基因。而rs1047768、rs17655、rs4771436、rs1048943、rs382604、rs1052133、rs2072668、rs2075747、rs3219008、rs1107029、rs1801320、rs4924500、rs11615、rs2298881、rs3212961、rs7202、rs9928731、rs650108和rs679620基因位点的检测结果在试验组与对照组间的发生频率差异无统计学意义(P>0.05)。
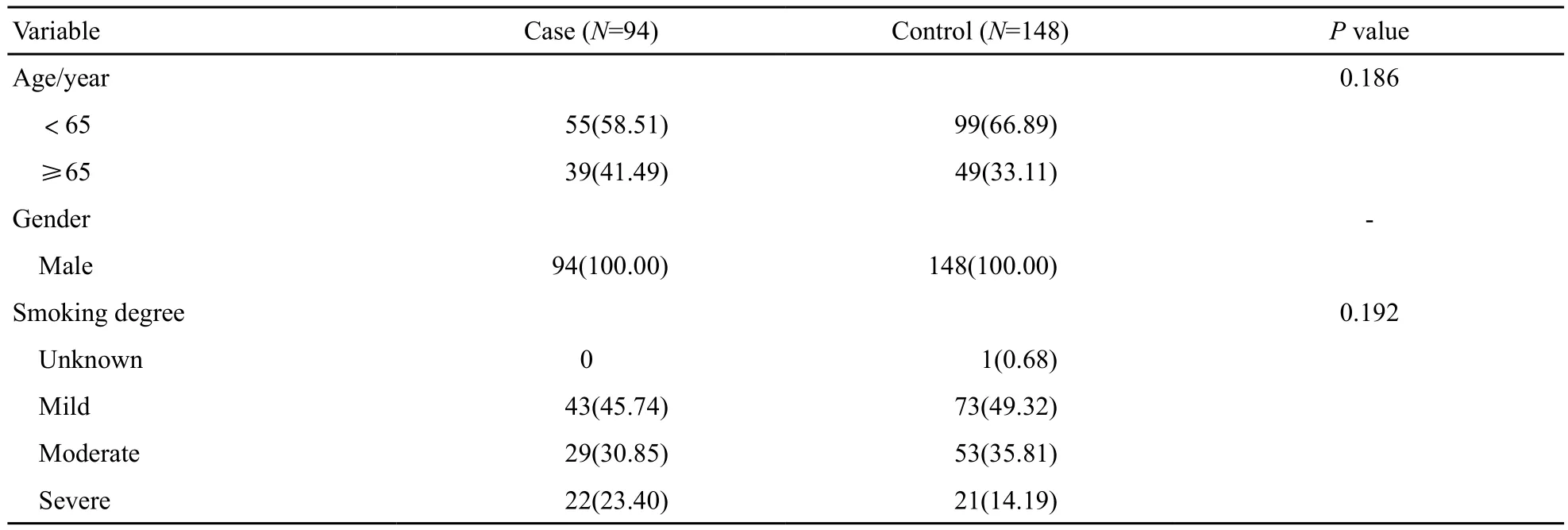
表 2 实验组及对照组一般资料Tab. 2 Case and control characteristics[n(%)]

表 3 实验组临床资料及吸烟情况Tab. 3 Clinical characteristics and smoking degree in patients[n(%)]
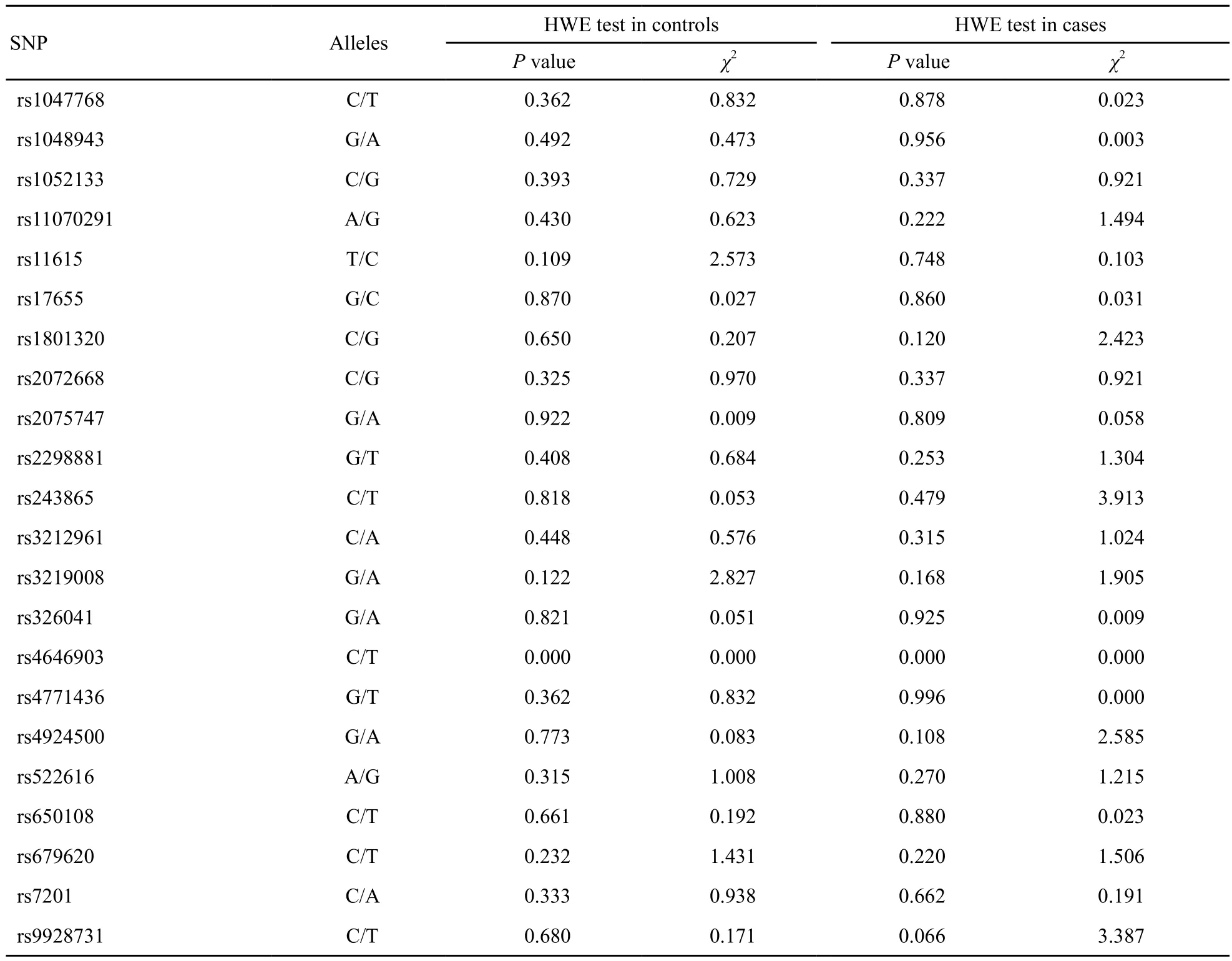
表 4 平衡实验Tab. 4 Hardy-Weinberg test
对rs243865基因型和等位基因与喉癌发生相关性分析结果显示,该位点基因型(CC/TT/CT)的表达频率在两组间差异均有统计学意义(P=0.04),等位基因(C/T)的表达频率在两组间差异亦有统计学意义(P=0.02)。表明在基因型方面TT表型罹患喉癌的危险度发生率是CC表型的8.97倍,而CT表型罹患喉癌的危险度是CC表型的1.44倍。在等位基因方面,T等位基因携带者罹患喉癌危险度是C等位基因携带者的1.92倍(表5)。
对rs522616基因型和等位基因与喉癌发生相关性分析结果显示,该位点基因型(AA/GG/AG)的表达频率在两组间差异均有统计学意义(P=0.03),等位基因(A/G)的表达频率在两组间差异亦有统计学意义(P=0.03)。表明在基因型方面,GG表型罹患喉癌的危险度发生率是AA表型的0.54倍,而AG表型罹患喉癌的危险度是AA表型的0.48倍,具有保护作用。在等位基因方面,该位点G等位基因携带者罹患喉癌的危险性是A等位基因携带者的0.66倍,具有保护作用(表6)。
2.5 吸烟情况及基因频率与喉癌发生的相关性
按照吸烟指数将试验组与对照组分为轻度(400~800/年支)、中度(800~1 200/年支)及重度吸烟组(>1 200/年支),并将基因分型与吸烟促进喉癌发生这个最为重要的外在因素联合分析(表4)。统计结果发现,rs11047768、rs2298881两个位点与吸烟及喉癌发生有显著相关性(P<0.05)。结合P值与OR值逐一分析后认为,rs2298881位点GT基因型携带者其罹患喉癌风险显著升高(P=0.025),是TT基因型携带者的5.91倍,且其OR值在轻、中、重度吸烟人群中随吸烟指数增加而逐渐增加,可认为该位点GT基因型携带者随着吸烟指数的增大,其罹患喉癌风险逐渐增加(表7)。
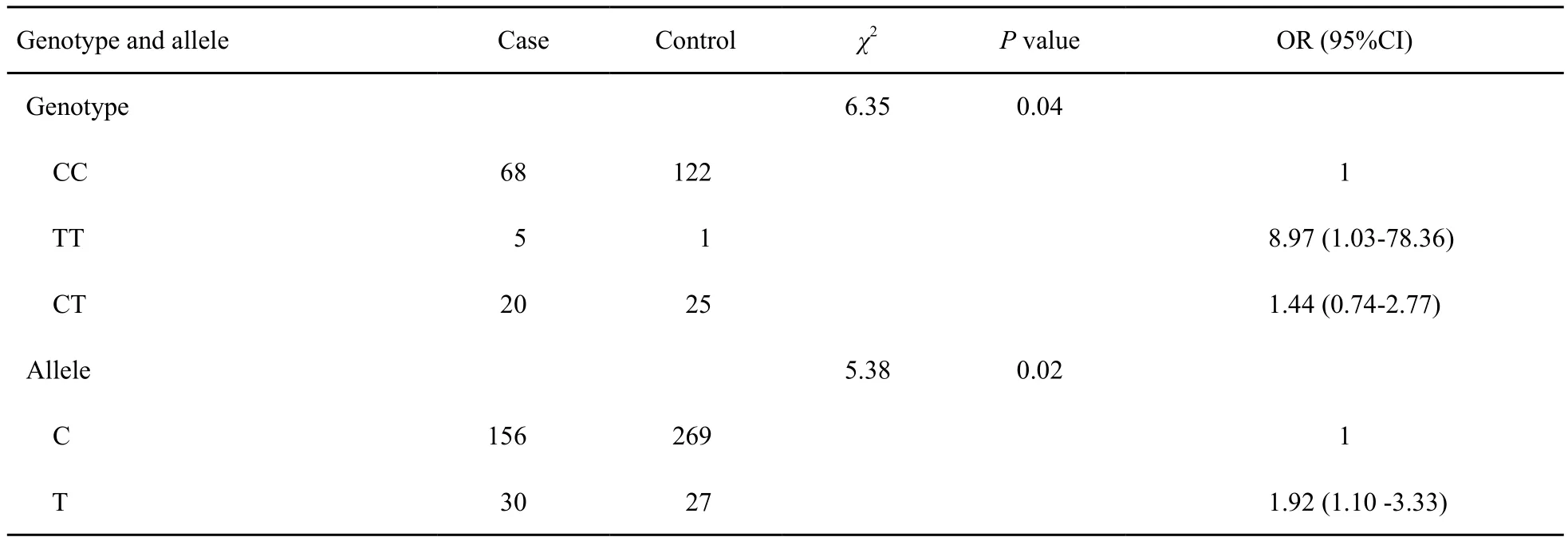
表 5 rs243865与喉癌发生的相关性Tab. 5 The association between rs243865 and laryngeal cancer

表 6 rs522616与喉癌发生的相关性Tab. 6 The association between rs522616 and laryngeal cancer
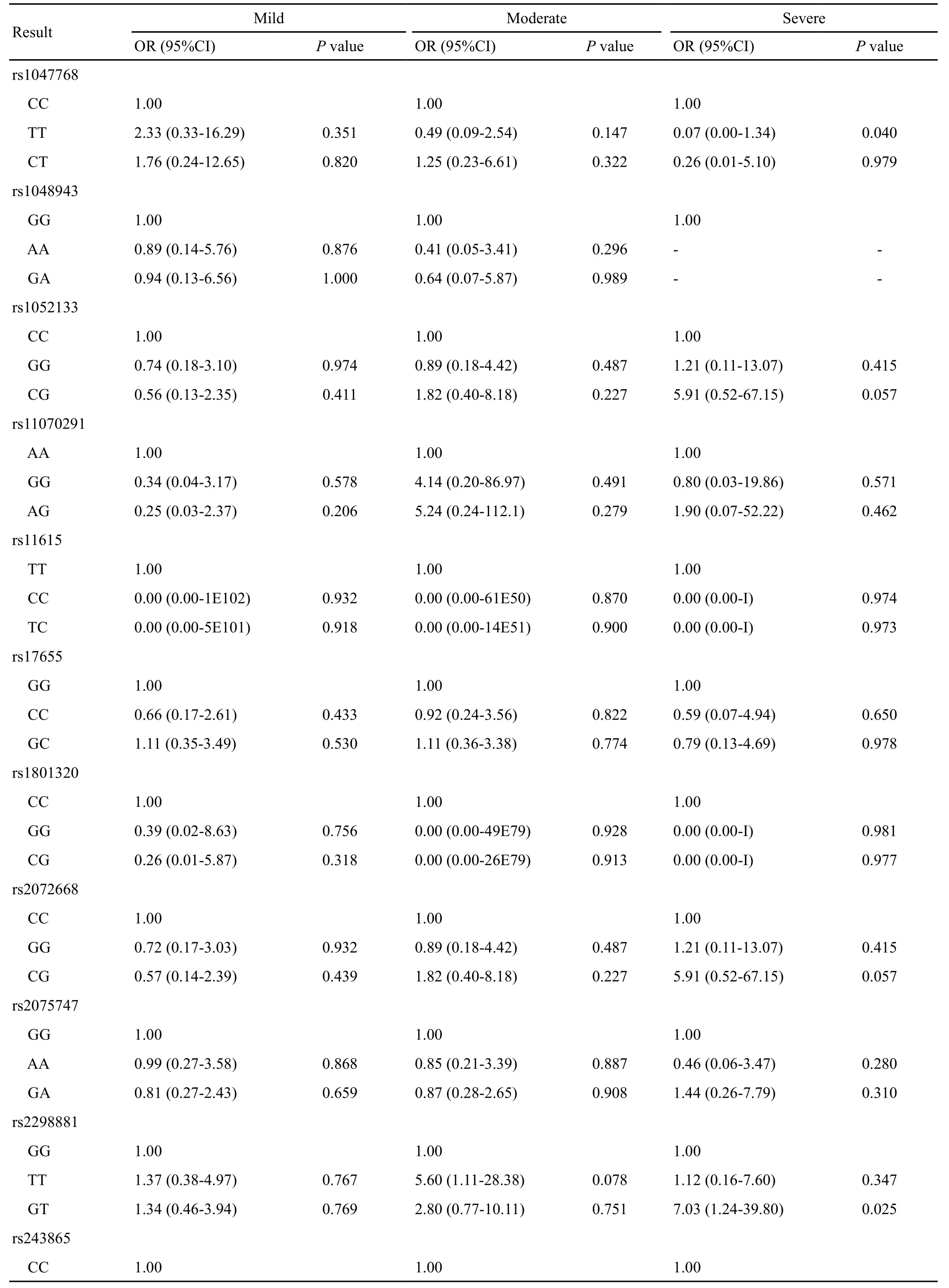
表 7 吸烟情况及基因频率与喉癌发生的相关性分析Tab. 7 Analysis of gene data stratified by smoking degree

续表7
3 讨 论
目前的研究对吸烟如何促进肿瘤发生的机制尚不十分明确,但国内外已有多项研究显示,吸烟对头颈部肿瘤的发生具有促进作用,是头颈部肿瘤发生的高危因素[6]。然而肿瘤的发生是多因素、多环节共同促进的结果,20世纪80年代,研究者意识到肿瘤可能是一种遗传学疾病,并且随着肿瘤各个分支学科的发展,研究者发现,原癌基因的激活和肿瘤抑制基因的失活在癌变过程中起重要的生物学作用,而癌相关基因的种系突变决定了该家族的肿瘤遗传易感性,与此相关基因的遗传多态性决定了个体对这些因素的易感性[7-9]。
在我们的临床数据调查中,发现与以往的流行病学研究结果一致的是喉癌患者多数为长期吸烟人群。我们选择了吸烟指数大于400/年支的患者作为调查研究对象,目的是为了进一步了解吸烟量与喉癌分期的关系,并且在控制了吸烟这一外在因素的情况下,对内在的遗传易感性的探讨更为精确。研究结果显示,吸烟是促进喉癌发生的重要因素,随着吸烟指数的增加和对烟草依赖程度的增加,喉癌发生后的N分期及临床分期越晚,说明吸烟不但能够促进喉癌的发生,还会促进喉癌的发展。2012年,Underwood等[10]的一项研究将试验设计为3组来讨论烟草对肿瘤的作用,分别为与烟草相关的肿瘤预后人群组、其他肿瘤预后人群组及正常无病人群组,得出的结论与本研究一致,认为烟草对于肿瘤的进展及复发有着非常重要的作用。
本研究结果提示,MMP2-rs243865与MMP3-rs522616这两个基因位点与喉癌的发生密切相关。MMPs是一组锌离子依赖性内肽酶,由23个成员组成,几乎能够降解所有的细胞外基质成份,而且与肿瘤的浸润、侵袭及转移密切相关。目前对MMP2基因的研究主要是集中在该基因启动子区域的1 306 bp的C/T(rs243865),在促癌因素的作用下促使-1306的C-T转换,使得其中1个Sp1位点暴露并被破坏,进而影响了该基因的转录活性,改变了正常的基因序列,扰乱了正常的生理功能,进而促进肿瘤发生、发展[11]。一项关于前列腺癌的研究分析了190例前列腺癌患者和200名健康人群,结果发现,1 306 bp的C/T(rs243865)位点的T等位基因携带者其罹患前列腺癌风险增加,差异有统计学意义[12]。该研究结果与本研究结论一致。但也有学者认为,携带CC基因型的人群其肺癌发病风险较高,是其他基因型的2倍[11]。这与本研究结果相悖,可能与肿瘤发生部位不同及病理类型不同有关,值得进一步探讨。与MMP3-rs522616的核苷酸序列结合的转录因子是C/EBP,其是CCAAT的增强子结合蛋白。该转录因子参与了全身多个组织的功能,与细胞增殖、分化及肿瘤细胞凋亡有关。转录因子C/EBP与rs522616的核苷酸序列相互作用促进G-A转化,增强MMP3的表达,促进肿瘤的易感性和浸润。MMP3-rs522616中的G-A转化可能是食管癌的易感基因,特别是在纯合子载体群体中[13]。此结果与本研究的结论一致。
在头颈部肿瘤中,与MMP2及MMP3相关性研究方面的报道较少,尤其是MMP2及MMP3在喉癌发生、发展中作用的研究并不多见,仅有的几项研究也是集中在MMP2及MMP3的表达水平与喉癌相关性分析方面。2013年的一项Meta分析纳入了13个头颈部肿瘤与MMP2、MMP3及MMP9的相关性研究结果,分析结果认为,MMP2-1306C/T及MMP3-11715A/6A位点改变能够促进头颈部肿瘤发生、发展[14]。Lotfi等[15]研究了MMP2及MMP9与喉癌的相关性,结果显示,与健康人群相比,喉癌患者的MMP2及MMP9水平明显升高,并且认为MMP2与喉癌患者的淋巴结转移情况相关,而MMP9则与肿瘤T分期明显相关。2014年有学者将48例喉癌患者的病理组织与15名非肿瘤人群的喉旁组织进行了对照研究,分析CD147、MMP2及MMP9的表达差异,结果显示,喉癌患者的组织中CD147、MMP2及MMP9的表达明显高于对照组(87.5 % vs 26.7 %、75.0% vs 6.7%、79.2%vs 33.3%);再根据CD147、MMP2及MMP9的表达情况将喉癌患者分层,分析5年生存率,结果显示,高表达组5年生存率仅为25.0%,而低表达组为83.3%;并且认为CD147、MMP2及MMP9的表达与喉癌的侵袭、转移及预后相关[16]。Mallis等[17]报道了102例喉癌患者MMP2表达情况与其预后的相关性,发现MMP2高表达的喉癌其总生存率及无病生存率均比MMP2低表达组的患者低,因此提出在喉癌患者中,MMP2是预测预后的标志物。
根据吸烟指数分层分析后显示,ERCC5-rs11047768、ERCC1-rs2298881、OGG1-rs3219008及MMP2-rs9928731这4个位点的某个基因型会增加或降低喉癌患病风险,结合P值与OR值综合分析后认为,仅ERCC1的rs2298881片段有较为明显的趋势,可以认为在重度吸烟人群中,该位点GT基因型携带者其罹患喉癌的风险明显增加。我们认为吸烟数量的差异会导致肿瘤标志物及基因位点表型的不同,这一结果与Bodnar等[18]的观点一致。2009年,Bodnar等[18]曾提出吸烟是导致喉癌发生的最主要诱因,认为烟草能够使机体的内源性化学物质改变结构,使其突变并具有致癌性,之后这些物质将浸润细胞导致基因发生变化,变异的基因不断累积将导致癌症发生、肿瘤形成甚至远处转移,他们根据吸烟数量的不同对11例喉癌患者的组织标本进行分析,主要的研究指标是MMP2、PCNA及Ki-67,发现在重度吸烟的喉癌患者标本中,以上基因表达是显著上调的。2010年,Bodnar等[19]的另一项研究根据喉癌患者吸烟数量不同探索基因表达的差异,观察的指标主要有MMP2、TGF-beta1及TGF-betaR1,发现重度吸烟患者的肿瘤基质中,MMP2和TGF-betaR1较吸烟量少组有更高的表达量,因此认为,喉癌患者吸烟数量有差异,肿瘤标志物的表达也会有所不同。目前有多项肿瘤的研究表明,ERCC1与肿瘤遗传易感性相关,如大肠癌、胃癌及肺癌等[20-21]。也有文献报道,ERCC1 rs3212986及rs11615位点可能与胃癌、乳腺癌及肺癌发病密切相关[22-24]。认为ERCC1 rs3212986位点基因多态性与吸烟患者大肠癌的发病风险相关。吸烟可以导致苯并芘化合物蓄积,继而出现DNA损伤,如双链断裂、双链交联或重组等,最终导致癌变[24]。一项关于ERCC1与乳腺癌的研究中纳入了417例乳腺癌患者及417名对照组无癌人群,结果显示,在中国人群中,ERCC1-rs2298881、rs11615的多态性与乳腺癌发生密切相关[25],这与本研究结果一致。2014年,Lu等[26]的一项最新有关喉癌发生、发展分子机制的研究更加强调了喉癌的发生与烟草的强大关联性,他们进行了一项病例对照研究,以确定与喉癌风险NER通路基因常见的8个SNP之间的关联,以及与遗传多态性和环境因素的关系。采用1∶1配对病例对照研究对176例喉癌患者和176名对照人群进行研究,特别强调了此项研究对吸烟史的差异有统计学意义,分层分析显示:ERCC1 rs11615和ERCC5 rs17655的多态性与吸烟之间的相互作用能够促进喉癌的发生、发展,差异有统计学意义,ERCC1 rs1615多态性与饮酒习惯也有显著的相互作用,最后得出ERCC 1rs11615、ERCC 5rs17655基因多态性能够增加喉癌发生的风险,并且给吸烟和饮酒者带来更大的风险。本研究也将ERCC1 rs11615纳入了检测,但并未得到阳性的统计学结果,可能需要进一步扩大样本讨论。
综上,MMP2和MMP3基因在促进喉癌中起重要作用。这些潜在的易感基因在喉癌的早期阶段具有至关重要的作用。此外,ERCC1基因监测在重度吸烟者中很重要,值得进一步探讨,为开展吸烟人群早期喉癌筛查及预防提供客观数据。
[1] 于 华, 辛玉芬, 段晓东, 等. 喉癌的流行病学病因学动态分析[J]. 现代生物医学进展, 2007, 7(3): 393-395.
[2] GLOBOCAN: Estimated cancer incidence, mortality and prevalence worldwide in 2012. http://globocan.iarc.fr/Pages/fact_sheets_population.aspx (Accessed May 05, 2015), 2012.
[3] PANTEL M, GUNTINAS-LncHIUS O. Laryngeal carcinoma:epidemiology, risk factors and survival[J]. HNO, 2012,60(1): 32-40.
[4] DOLL R, HILL A B,GRAY P G, et al. Lung cancer mortality and the length of cigarette ends;an international comparison[J]. Br Med J, 1959, 1(5118): 322-325.
[5] HEMMINKI K, F A, LORENZO B J. Etiologic impact of known cancer susceptibility genes[J]. Mutat Res, 2008,658(1-2): 42-54.
[6] WADE G S, BEVERLY R K, WUERTZ L G O. Tobacco carcinogen mediated up-regulation of AP-1dependent proangiogenic cytokines in head and neck carcinogenesis[J].Mol Carcinogen, 2011, 50(9): 668-679.
[7] PONDER B A. Cancer genetics[J]. Nature, 2001,411(6835): 336-371.
[8] KNUDSON A G. Cancer genetics[J]. Ame J Med Genet,2001, 111(1): 96-102.
[9] PETO J. Cancer epdimeology in the last century and the next decade [J]. Nature, 2001, 411(6835): 390-395.
[10] UNDERWOOD J M, TOWNSEND J S, TAI E, et al. Persistent cigarette smoking and other tobacco use after a tobaccorelated cancer diagnosis[J]. J Cancer Surviv, 2012, 6(3):333-344.
[11] ZHOU Y, YU C, MIAO X, et al. Functional haplotypes in the promoter of matrix metalloproteinase-2 and lung cancer susceptibility[J]. Carcinogenesis, 2005, 26(6): 1117-1121.
[12] SRIVASTAVA P, LONE T A, KAPOOR R, et al. Association of promoter polymorphisms in MMP2 and TIMP2 with prostate cancer susceptibility in North India[J]. Arch Med Res,2012, 43(2): 117-124.
[13] 陈清波, 高雯琪, 邓志芳, 等. 人类MMP3基因5’端转录调控区rs522616单核苷酸多态性与食管鳞癌遗传易感性的关系[J]. 世界华人消杂, 2011, 19(30): 27-33.
[14] ZHANG C, LI C, ZHU M, et al. Meta-analysis of MMP2,MMP3, and MMP9 promoter polymorphisms and head and neck cancer risk[J]. PLoS One, 2013, 8(4): e62023.
[15] LOTFI A, MOHAMMADI G, SANIEE L, et al. Serum level of matrix metalloproteinase-2 and -9 in patients with laryngeal squamous cell carcinoma and clinical significance[J].Asian Pac J Cancer Prev, 2015, 16(15): 6749-6751.
[16] GOU X, CHEN H, JIN F, et al. Expressions of CD147, MMP-2 and MMP-9 in laryngeal carcinoma and its correlation with poor prognosis[J]. Pathol Oncol Res, 2014, 20(2): 475-481.
[17] MALLIS A, TEYMOORTASH A, MASTRONIKOLIS N S, et al. MMP-2 expression in 102 patients with glottic laryngeal cancer[J]. Eur Arch Otorhinolaryngol, 2012, 269(2): 639-642.
[18] BODNAR M, REKWIROWICZ H, BURDUK P, et al. Impact of tobacco smoking on biologic background of laryngeal squamous cell carcinoma[J]. Przegl Lek, 2009, 66(10):598-602.
[19] BODNAR M, BURDUK P, KAZMIERCZAK W, et al.Expression of tumor matrix markers rebuild in laryngeal cancer depends on number of smoked cigarettes[J]. Przegl Lek, 2010, 67(10): 850-854.
[20] YE W, KUMAR R, BACOVA G, et al. The XPD 751Gln allele is associated with an increased risk for esophageal adenocarcinoma: a population-based case-control study in Sweden[J]. Carcinogenesis, 2006, 27(9): 1835-1841.
[21] ZHOU R M, LI Y, WANG N, et al. Correlation of XPC Ala499Val and Lys939Gln polymorphisms to risks of esophageal squamous cell carcinoma and gastric cardiac adenocarcinoma[J]. Ai Zheng, 2006, 25(9): 1113-1119.
[22] QIU L, WANG Z, SHI X, et al. Associations between XPC polymorphisms and risk of cancers: a meta-analysis[J].Eur J Cancer, 2008, 44(15): 2241-2253.
[23] FRANCISCO G, MENEZES P R, ELUF-NETO J, et al. XPC polymorphisms play a role in tissue-specific carcinogenesis:a meta-analysis[J]. Eur J Hum Genet, 2008, 16(6): 724-734.
[24] 候睿智, 赵吉生. ERCC1、XPF基因多态性与大肠癌发病风险及吸烟相关性的临床研究[D]. 吉林: 吉林大学,2015.
[25] PEI X H, YANG Z, LV X Q, et al. Genetic variation in ERCC1 and XPF genes and breast cancer risk[J]. Genet Mol Res,2014, 13(1): 2259-2267.
[26] LU B, LI J, GAO Q, et al. Laryngeal cancer risk and common single nucleotide polymorphisms in nucleotide excision repair pathway genes ERCC1, ERCC2, ERCC3, ERCC4, ERCC5 and XPA[J]. Gene, 2014, 542(1): 64-68.
