γ-聚谷氨酸复合TGase对鸡肉肌原纤维蛋白凝胶特性的影响
2018-02-28白登荣刘根贺雪华尚永彪
白登荣,刘根,贺雪华,尚永彪,2,3*
1(西南大学 食品科学学院,重庆,400715) 2(农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆,400715) 3(重庆市特色食品工程技术研究中心,重庆,400715)
目前常见的肉糜制品种类繁多,但主要是鱼肉糜和猪肉糜,鸡肉糜却很少,这主要是由于鸡肉的一些固有特性使得鸡肉糜的加工较鱼肉糜和猪肉糜复杂[1],严重限制了鸡肉糜制品的产业化发展。在肉类加工过程中,肌肉盐溶性蛋白的凝胶特性很大程度上决定了肉糜类制品的质地、组织状态、外观和出品率等[2],而且受众多因素的影响。为了改善鸡肉糜制品的凝胶特性,目前研究较多的是加入添加剂,如谷氨酰胺转氨酶(Transglutaminase,TGase)、大豆分离蛋白、多糖、多聚磷酸盐等。此外,如漂洗、斩拌、超高压处理及加热方式等凝胶制备工艺的优化也从很大程度上改善了鸡肉糜制品的凝胶特性。
γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)是一种水溶性、可生物降解、无毒性的高分子氨基酸聚合物[3-4],它能够增加肠胃蠕动,促进小肠对矿物质的吸收,且其降解产物谷氨酸单体还可以被人体吸收利用[5-6]。TGase是一种催化酰基转移反应的酶,它能使蛋白质分子间发生交联,改变蛋白质的空间网络结构,从而改善蛋白质的凝胶特性。近年来,在TGase改善肌原纤维蛋白凝胶特性等方面的研究已经相当广泛,但关于γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶特性的影响的研究鲜有报道。本文以冷冻鸡胸肉为原料,研究不同质量分数的γ-PGA和TGase复合后对其肌原纤维蛋白凝胶特性的影响,并分析凝胶特性变化的机理,以帮助解决鸡肉糜凝胶特性差等问题。
1 材料与方法
1.1 材料与试剂
鸡胸肉,购于重庆北碚永辉超市,-18 ℃冷冻储藏备用。使用前取一定量的鸡胸肉解冻后剔除可见脂肪及结缔组织,加入冰水斩拌成肉糜,于4 ℃条件下冷藏。
Na2HPO4、NaH2PO4、牛血清蛋白、CuSO4、尿素、KCl、NaCl、乙二胺四乙酸(EDTA)、β-疏基乙醇、HCl,成都市科龙化工试剂厂;酒石酸钾钠宁波大川精细化工有限公司;SDS、2-硝基苯甲酸(DTNB),BIOSHARP;Tris Sigma-Alorich,以上均为分析纯。TGase(酶比活力为100 U/g),东圣食品科技有限公司;γ-PGA,轩凯生物科技有限公司,以上均为食品级。
1.2 仪器与设备
PHS-4C+酸度计,成都世纪方舟科技有限公司;XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司;Avanti J-30I贝克曼冷冻离心机,美国贝克曼库尔特公司;722-P可见分光光度计,上海现科仪器有限公司;HH-6数显恒温水浴锅,金坛市富华仪器有限公司;RZ-288c搅肉机美的集团;DW-25W518冰箱,青岛海尔电器有限公司;UltraScan PRO测色仪,美国HunterLab公司;CT-3质构仪,美国Brookfield公司;Mini-PROTEAN®电泳槽,美国BIO-RAD公司。
1.3 实验方法
1.3.1 肌原纤维蛋白(myofibrillar protein,MP)的提取
参考XIONG[7]的方法并稍作修改。取一定量的鸡肉糜加入4倍体积0.05 mol/L磷酸盐缓冲溶液(0.1 mol/L NaCl,5 mmol/L EDTA,pH 7.0),10 000 r/min高速匀浆60 s后冷冻离心(4 ℃、5 500 r/min)15 min,弃去上清液,将所得沉淀按上述步骤重复提取2次,然后将所得沉淀与4倍体积0.1 mol/L NaCl (pH 6.25)混合,6 000 r/min高速匀浆30 s,4 ℃、5 500 r/min离心15 min,在将所得沉淀与8倍体积0.1 mol/L NaCl(pH 6.25)混合,过滤、去除结缔组织,4 ℃、5 500 r/min离心15 min后所得沉淀即为肌原纤维蛋白。蛋白质含量的测定采用双缩脲法。
1.3.2 肌原纤维蛋白热诱导凝胶的制备
取一定量的肌原纤维蛋白于4 ℃的磷酸盐缓冲溶液(0.6 mol/L NaCl、0.05 mol/L Na2HPO4、pH 6.5)中,在4 ℃条件下2 800 r/min匀浆24 s使蛋白充分溶解,匀浆过程中尽量避免气泡的产生,使蛋白质溶液质量浓度为40 mg/mL,分别加入不同质量分数的γ-PGA(0、0.03%、0.06%、0.09%、0.12%)和TGase(0、0.1%、0.3%、0.5%、0.7%)混匀,调节pH值为6.5,在4 ℃条件下处理1 h,然后取7 mL样液于10 mL的离心管中,在水浴锅中先40 ℃保温30 min,然后80 ℃保温30 min形成凝胶,快速冷却,然后在4 ℃的条件下放置过夜后进行凝胶相关特性的测定。
1.3.3 凝胶硬度和弹性的测定
制备好的凝胶从4 ℃条件下取出后放于室温下平衡30 min。使用质构仪对其凝胶硬度和弹性进行测定。测定参数设置如下:探头类型:TA5;测前速度:5 mm/s;测中速度:1 mm/s;测后速度:1 mm/s;压缩比:50%;触发点负载:5.0 g;触发类型:Auto;数据攫取速率:200 Hz;停留时间:5 s。
1.3.4 凝胶保水性的测定
参考SALVADOR等[8]的方法对凝胶保水性进行测定。制备好的凝胶从4 ℃条件下取出后放于室温下平衡30 min,放入离心管中称重记为m1;于4 ℃、5 000 r/min条件下离心10 min,除去离心管中的水后称重记为m2,结果取平均值。凝胶保水性计算见公式(1):

(1)
式中:m,离心管的质量,g;m1,离心前离心管和凝胶的质量,g;m2,离心后离心管和凝胶的质量,g。
1.3.5 凝胶白度值的测定
采用UltraScan PRO色差仪进行凝胶白度值分析,测色仪先用白、黑板校正,然后将样品垂直紧扣在镜口,测定并记录L*(亮度)、a*(红度)、b*(黄度),所有样品做3次平行实验,每个样品取3个点进行测定,每个点重复3次,结果取平均值。白度值的计算见公式(2):

(2)
1.3.6 离子键、氢键、疏水相互作用的测定
1.3.7 活性巯基和总巯基的测定
参考ELLMAN[10]的方法并作适当的修改。称取8 g蛋白凝胶化样品溶解于22 mL 20 mmol/L Tris-HCl缓冲液C(pH 7.0,内含10 mmol/L EDTA、0.6 mol/L KCl)中,10 000 r/min均质30 s后10 000 r/min离心10 min。利用双缩脲法测定上清液中蛋白质量浓度并调节至1 mg/mL。取5.5 mL蛋白溶液与0.1 mL DTNB(10 mmol/L)混合,4 ℃条件下放置1 h后在412 nm处测定溶液的吸光度,计算活性疏基含量;取0.5 mL蛋白溶液与5 mL 20 mmol/L Tris-HCl缓冲液D(pH 8.0,内含10 mmol/L EDTA、0.6 mol/L KCl、8 mol/L尿素)混合,再加入0.1 mL DTNB(10 mmol/L),40 ℃条件下保温25 min后在412 nm处测定溶液的吸光度,计算总巯基含量。巯基的摩尔吸光系数为13 600 (L/mol·cm)。
1.3.8 凝胶蛋白溶解度的测定
参考RAWDKUEN等[11]方法。称取1 g蛋白凝胶化样品溶解于20 mL 20 mmol/L Tris-HCl缓冲液(内含1% SDS,8 mmol/L尿素和2% β-疏基乙醇,pH 8.0)中,均质后在100 ℃加热2 min,室温下搅拌4 h,然后10 000 r/min离心30 min。取上清液10 mL,加入2 mL 冷的50%TCA,混合液在4 ℃条件下放置18 h后10 000 r/min离心20 min,取沉淀用10%的TCA冲洗,待沉淀风干后溶于0.5 mmol/L NaOH中。利用双缩脲法测定蛋白质浓度,结果以可溶性蛋白占总蛋白(样品直接溶于0.5 mmol/L NaOH中测得的蛋白含量)含量的百分比表示。
1.3.9 肌原纤维蛋白SDS-PAGE凝胶电泳
参考LAEMMLI[12]的方法进行凝胶电泳的测定。取一定量的肌原纤维蛋白用0.6 mol/L NaCl(pH 6.5)溶液调节蛋白质质量浓度为2 mg/mL,加入不同质量分数的γ-PGA和TGase混匀,调节pH值为6.5,在4 ℃条件下处理1 h后进行电泳样品的制备。分离胶浓度为12%,浓缩胶浓度为5%,电泳开始时先采用恒定电流15 mA,待样品进入分离胶后将电流调节至25 mA。
1.3.10 数据处理
所有试验重复3次,每个处理有3个平行样,结果取平均值。用Excel 2015对数据进行处理,用Origin软件进行绘图,用SPSS Statistics 17.0对数据进行显著性分析(p<0.05)。
2 结果与分析
2.1 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶硬度和弹性的影响
γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶硬度和弹性的影响如图1所示。
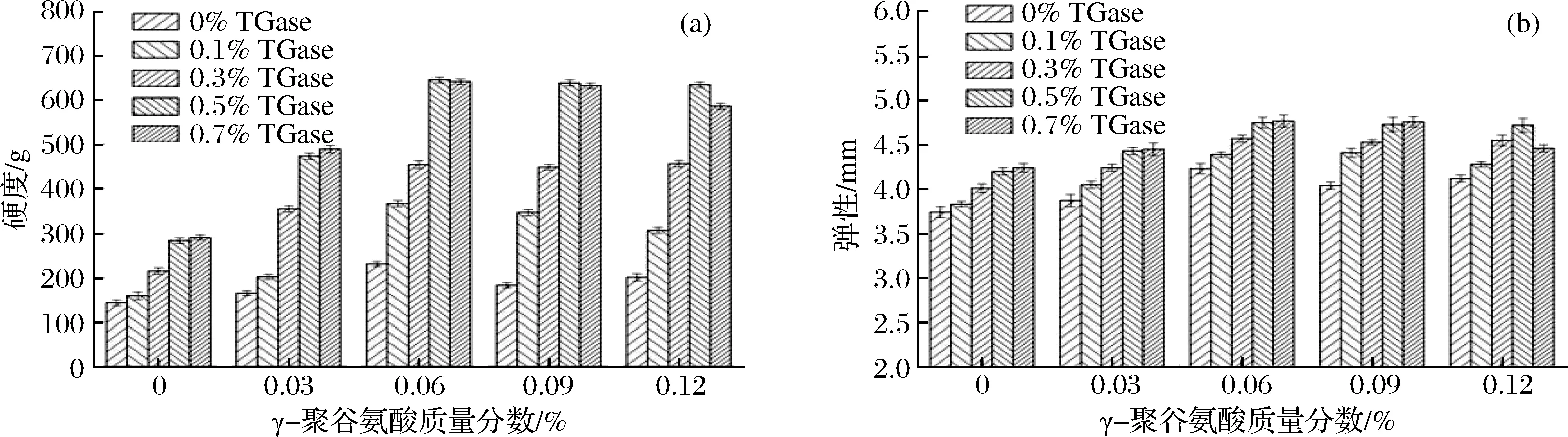
图1 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶硬度(a)和弹性的影响(b)Fig.1 Effect of γ-polyglutamic acid combined with TGase on the hardness and springiness of gelatin from chicken myofibrillar protein
由图1可知,在未添加TGase时,随着γ-PGA质量分数的增大,凝胶硬度和弹性呈先增大后减小的趋势,且在γ-PGA质量分数为0.06%时,凝胶硬度和弹性分别达到最大值,与完全空白组(未添加TGase和γ-PGA)相比分别显著增大(p<0.05)了61.11%、13.10%;添加TGase后,在同一TGase质量分数条件下,随着γ-PGA质量分数的增大,凝胶硬度和弹性先显著增大后变化不明显,但在TGase质量分数为0.7%、γ-PGA质量分数为0.12%时,凝胶硬度和弹性显著减小(p<0.05)。在同一γ-PGA质量分数条件下,随着TGase质量分数的增大,凝胶硬度和弹性先显著增大后变化不明显,但在γ-PGA质量分数为0.12%时,添加0.7%的TGase后反而使凝胶硬度和弹性明显减小(p<0.05)。在TGase质量分数为0.5%、γ-PGA质量分数为0.06%时,凝胶硬度和弹性分别达到最大值,与完全空白组相比分别提高了4.48倍、1.27倍。研究发现,γ-PGA水溶液在加热过程中会产生多肽链的随机断裂[13],一定质量分数的γ-PGA降解后暴露出的Glu残基与蛋白质中的Lys残基之间通过非二硫共价键发生交联[14],使凝胶硬度和弹性随着γ-PGA质量分数的增大而增大,添加一定质量分数的TGase后,在TGase催化作用下,蛋白质之间非二硫共价键的形成增加,γ-PGA-蛋白质和蛋白质-蛋白质之间的交联作用增强,形成的三维网络结构变得更加有序,从而使凝胶硬度和弹性进一步提高,然而当γ-PGA和TGase质量分数过高时,凝胶硬度和弹性增加不明显甚至减小,这可能是由于底物浓度已经饱和,过高质量分数的γ-PGA和TGase使得γ-PGA-蛋白质、蛋白质-蛋白质之间过度交联,造成凝胶网络结构无序化,从而影响凝胶硬度和弹性的提高[15]。将γ-PGA和TGase复合使用后对凝胶硬度和弹性的增强效果明显大于单独使用γ-PGA或TGase对凝胶硬度和弹性的增强效果,这说明γ-PGA和TGase之间可能存在协同作用。
2.2 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶保水性的影响
γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶保水性的影响如图2所示。

图2 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶保水性的影响Fig.2 Effect of γ-polyglutamic acid combined with TGase on water holding capacity of gelatin from chicken myofibrillar protein
由图2可知,在未添加TGase时,随着γ-PGA质量分数的增大,凝胶保水性呈先增大后减小的趋势,且在γ-PGA质量分数为0.06%时,凝胶保水性达到最大值,这可能是由于一定质量分数的γ-PGA使体系中的净电荷增加,静电斥力也随之增加,蛋白质分子间的空隙增大,从而使凝胶保水性提高[16]。此外,由于γ-PGA侧链上大量游离羧基所带负电荷的排斥作用,使γ-PGA分子链的空间伸展很大[17],即使在较低的浓度条件下,仍然能保持良好的吸水保湿性能,这有利于凝胶保水性的进一步提高。添加TGase后,在同一TGase质量分数条件下,凝胶保水性随着γ-PGA质量分数的增大先显著增大后变化不明显,但在TGase质量分数为0.7%、γ-PGA质量分数为0.12%时,凝胶保水性显著减小(p<0.05)。在同一γ-PGA质量分数条件下,随着TGase质量分数的增大,凝胶保水性先显著增大后变化不明显,但在γ-PGA质量分数为0.12%时,添加0.7%的TGase反而使凝胶保水性显著减小(p<0.05)。在TGase质量分数为0.5%、γ-PGA质量分数为0.06%时,凝胶保水性达到最大值,与完全空白组相比提高了10.97%。凝胶保水性的增加主要是可移动水的增加,其增加程度受蛋白质内在结构和外在条件的影响,在凝胶制作过程中添加一定质量分数的TGase可以催化蛋白质分子间形成异型肽键及致密的网络结构,加之受热过程中一定质量分数的γ-PGA降解后与蛋白质之间发生交联使凝胶孔洞更加细小、均匀,网络结构更加紧密,从而使更多的水分包埋或被结合在凝胶结构中[18],然而当γ-PGA和TGase质量分数过高时会造成γ-PGA-蛋白质、蛋白质-蛋白质之间产生过度聚集作用,蛋白质的凝胶网络结构被严重破坏,蛋白质与水分子之间的相互作用减弱,从而对凝胶保水性能产生不利影响[19]。
2.3 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶白度值的影响
γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶白度值的影响如图3所示。
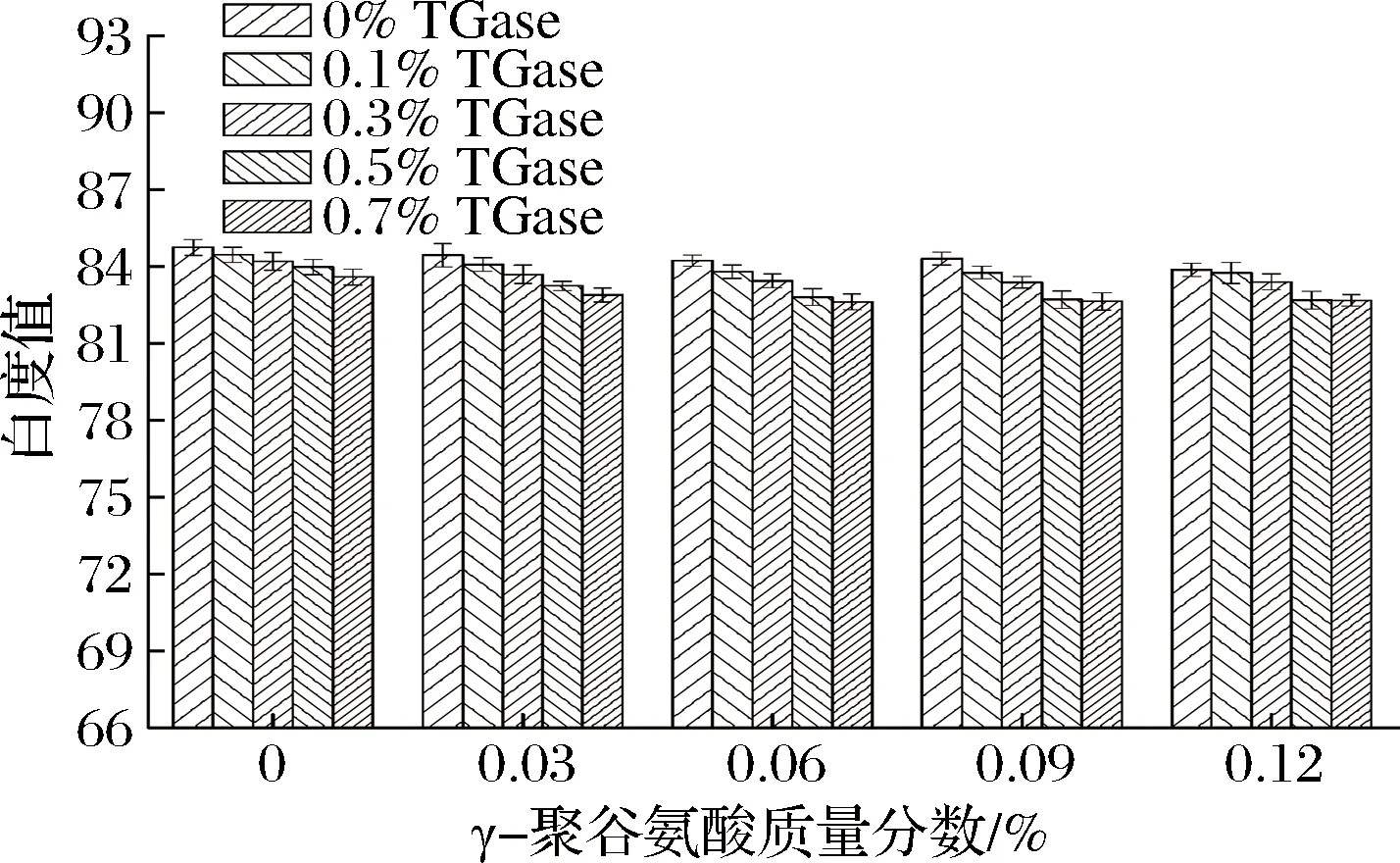
图3 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶白度值的影响Fig.3 Effect of γ-polyglutamic acid combined with TGase on whiteness of gelatin from chicken myofibrillar protein
当TGase质量分数为0~0.1%、γ-PGA质量分数小于0.06%时,在同一TGase质量分数条件下,凝胶白度值随着γ-PGA质量分数的增大变化较小(p>0.05),然而在γ-PGA质量分数大于0.06%时,随着γ-PGA质量分数的增大,凝胶白度值逐渐减小(p<0.05),且在γ-PGA质量分数为0.12%时,凝胶白度值达到最小值,这可能是由于随着γ-PGA质量分数的增大,第二阶段加热过程中Maillard反应的速度加快[20],有色物质的生成导致凝胶白度值降低;当TGase质量分数为0.3%~0.7%时,在同一TGase质量分数条件下,凝胶白度值随着γ-PGA质量分数的增大先明显减小后变化不明显。在同一γ-PGA质量分数条件下,随着TGase质量分数的增大,凝胶白度值先逐渐减小后变化不明显。在TGase质量分数为0.7%、γ-PGA质量分数为0.12%时,凝胶白度值最小,但与完全空白组相比仅降低了2.51%。造成凝胶白度值下降的原因可能是由于添加TGase和γ-PGA后,γ-PGA-蛋白质以及蛋白质分子间发生共价交联,蛋白质的凝胶网络结构变得更加紧密,降低了凝胶L*值,所以蛋白凝胶白度值降低[21],这可能也与TGase本身的黄褐色使凝胶颜色加深有关。此外,凝胶白度值的变化与保水性也有一定的关系[22],一定质量分数的γ-PGA和TGase使凝胶保水性增加,凝胶样品表面的游离水减少,从而降低了与白度值正相关的L*值。
2.4 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶化学作用力的影响
肌肉蛋白质热诱导凝胶形成的过程实际上是肌原纤维蛋白变性聚集的过程,在这个过程中,离子键、疏水相互作用、氢键和二硫键等化学作用力共同作用促使蛋白质的凝胶结构发生变化[23],而凝胶结构的改变最终会对蛋白质的凝胶特性产生重要影响。
2.4.1 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶离子键、氢键和疏水相互作用的影响
γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶离子键、氢键和疏水相互作用的影响如图4所示。

图4 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶离子键(a)、氢键(b)和疏水相互作用(c)的影响Fig.4 Effect of γ-polyglutamic acid combined with TGase on ionic bonds, hydrogen bonds and hydrophobic interactions of gelatin from chicken myofibrillar protein
由图4可知,在未添加TGase时,离子键和氢键随着γ-PGA质量分数的增大呈先增大后减小的趋势,且在γ-PGA质量分数为0.06%时分别达到最大值,疏水相互作用随着γ-PGA质量分数的增大呈先增大后减小的趋势;添加TGase后,在同一TGase质量分数条件下,离子键和氢键随着γ-PGA质量分数的增大逐渐减小,而疏水相互作用随着γ-PGA质量分数的增大先显著增大后变化不明显,这可能是由于γ-PGA侧链上存在的大量活性较高的游离羧基与蛋白质的亲水基团发生竞争,从而使蛋白质分子间的疏水相互作用增强,但在TGase质量分数为0.7%、γ-PGA质量分数为0.12%时,疏水相互作用显著减小(p<0.05)。在同一γ-PGA质量分数条件下,随着TGase质量分数的增大,离子键和氢键逐渐减小,这可能是由于在TGase的催化作用下,蛋白质的空间结构发生变化,活性基团被大量包埋或参与非二硫共价键的形成[24],导致离子键和氢键逐渐减小,而疏水相互作用随着TGase质量分数的增大先显著增大后变化不明显,但在γ-PGA质量分数为0.12%、TGase质量分数为0.7%时疏水相互作用反而明显减小(p<0.05)。TGase能够催化蛋白质中Lys残基的ε-氨基与Glu的γ-酰胺基之间形成ε-(γ-Glu)-Lys共价键,促进蛋白质分子间或分子内发生共价交联[25],随着TGase质量分数的增大,交联作用逐渐增强,更多的亲水基团被包埋在致密的凝胶网络结构中,从而使疏水相互作用逐渐增大,然而当γ-PGA和TGase质量分数过高时,疏水相互作用增加不明显甚至有所减小,这可能是由于底物浓度已经饱和,过高质量分数的γ-PGA和TGase使得γ-PGA-蛋白质、蛋白质-蛋白质之间过度交联,导致凝胶网络结构变得无序,此时疏水相互作用已不能再改善蛋白质的凝胶特性[26]。
FOEGEDING等[27]认为,疏水相互作用在蛋白质凝胶形成过程中起关键作用,适宜的疏水相互作用能减少肉糜体系中的熵值,促进蛋白质之间的聚集和交联,从而促使其形成稳定的凝胶网络结构,但过强的疏水相互作用反而会导致凝胶脱水收缩,使凝胶强度降低,这与本文的研究结论相似。通过与图1比较可知,疏水相互作用是维持蛋白质凝胶三维结构稳定性的主要化学作用力,而离子键和氢键对维持蛋白质凝胶三维结构的稳定贡献不大。
2.4.2 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶活性巯基与总巯基的影响
γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶活性巯基和总巯基的影响如图5所示。
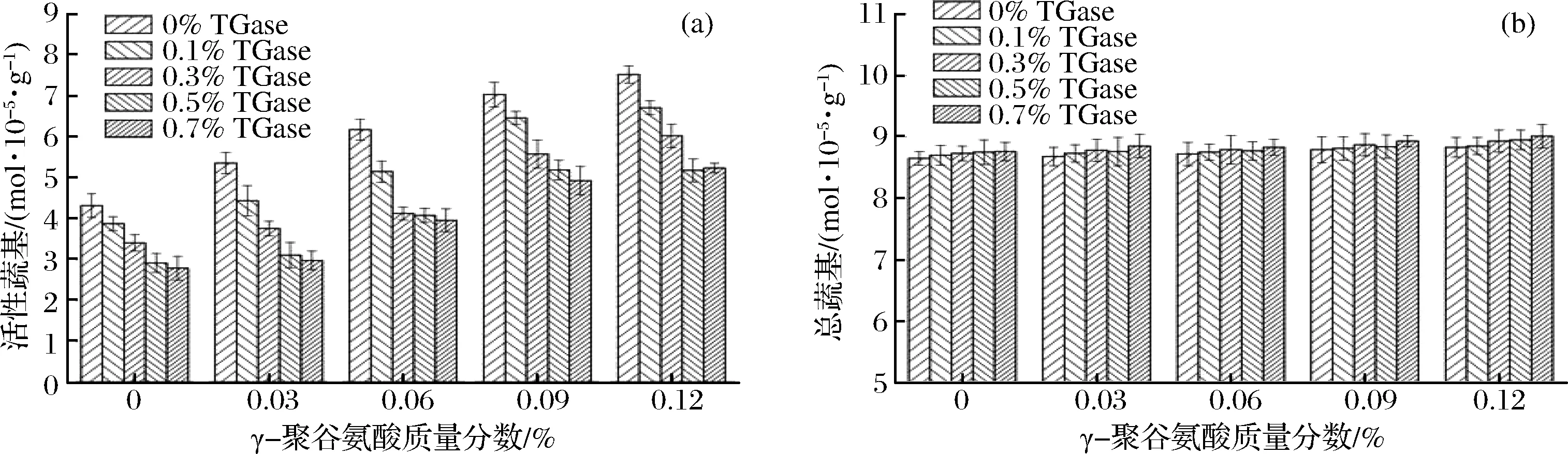
图5 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶活性巯基(a)和总巯基(b)的影响Fig.5 Effect of γ-polyglutamic acid combined with TGase on active sulfhydryl(a) and total sulfhydryl(b) of gelatin from chicken myofibrillar protein
由图5-(a)可知,在同一TGase质量分数条件下,活性巯基含量随着γ-PGA质量分数的增大显著增大(p<0.05),这可能是由于γ-PGA侧链上大量活性较高的游离羧基使包埋在疏水基团内部的巯基暴露出来,在γ-PGA质量分数大于0.06%以后,随着γ-PGA质量分数的增大,活性巯基含量变化不明显(p>0.05)。在同一γ-PGA质量分数条件下,随着TGase质量分数的增大,活性巯基含量先显著减小后变化不明显,特别是TGase质量分数小于0.06%时,活性巯基含量减小的幅度更大,这可能是因为在TGase的催化作用下,γ-PGA-蛋白质、蛋白质-蛋白质之间交联作用加强,在形成更加致密的凝胶三维结构的过程中包埋了较多的活性巯基,从而使活性巯基含量随着TGase质量分数的增大逐渐减小。由图5-(b)可知,γ-PGA复合TGase对蛋白质凝胶总巯基含量的影响较小,这说明γ-PGA和TGase对二硫键的形成影响也较小。有研究表明[28-31],二硫键的形成主要受加热方式和加热程度的影响。
2.4.3 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶溶解度的影响
含有SDS、尿素和β-疏基乙醇的Tris-HCl缓冲溶液可以断裂肌原纤维蛋白凝胶中除ε-(γ-Glu)-Lys以外的其他化学键[32]。因此,蛋白质凝胶中ε-(γ-Glu)-Lys非二硫共价键的多少可以根据其在上述试剂中溶解度的高低来判断。γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶溶解度的影响如图6所示。
由图6可知,在未添加TGase时,凝胶溶解度随着γ-PGA质量分数的增大呈先减小后增大的趋势,且在γ-PGA质量分数为0.06%时,凝胶溶解度较低;添加TGase后,在同一TGase质量分数条件下,随着γ-PGA质量分数的增大,凝胶溶解度呈明显的下降趋势,且在γ-PGA质量分数为0.06%时,凝胶溶解度较低,随着γ-PGA质量分数的进一步增大,凝胶溶解度变化不明显,但在TGase质量分数为0.7%、γ-PGA质量分数为0.12%时,凝胶溶解度有所增大(p<0.05)。

图6 γ-PGA复合TGase对鸡肉肌原纤维蛋白凝胶溶解度的影响Fig.6 Effect of γ-polyglutamic acid combined with TGase on solubility of gelatin from chicken myofibrillar protein
在同一γ-PGA质量分数条件下,随着TGase质量分数的增大,凝胶溶解度先减小后变化不明显,但在γ-PGA质量分数为0.12%时,添加0.7%的TGase后反而使凝胶溶解度明显增大(p<0.05)。在TGase质量分数为0.5%、γ-PGA质量分数为0.06%时,凝胶溶解度较低,说明凝胶中非二硫共价键的形成量较高,这与图1的结果基本一致,说明非二硫共价键也是维持凝胶三维结构稳定性的主要化学作用力。γ-PGA复合TGase对蛋白质凝胶溶解度的影响可能是由于在热诱导凝胶形成的过程中,γ-PGA受热降解暴露出的Glu残基与蛋白质中的Lys残基交联形成ε-(γ-Glu)-Lys非二硫共价键[14],或在TGase的催化作用下,蛋白质分子间或分子内交联形成ε-(γ-Glu)-Lys非二硫共价键[33],当γ-PGA质量分数和TGase质量分数在一定范围内增大时,形成的ε-(γ-Glu)-Lys非二硫共价键也就越多,蛋白质的凝胶特性也就越好,然而当γ-PGA和TGase质量分数较高时,非二硫共价键增加趋势变缓甚至有所减小,从而影响蛋白质凝胶特性的进一步提高。因此,γ-PGA和TGase只有在配比合理的情况下才能最大程度的发挥协同作用,从而极大的改善蛋白质的凝胶特性。
2.5 γ-PGA复合TGase对鸡肉肌原纤维蛋白SDS-PAGE凝胶电泳图谱的影响
γ-PGA复合TGase对鸡肉肌原纤维蛋白SDS-PAGE凝胶电泳图谱的影响如图7所示。

M-标准蛋白;C-未添加γ-PGA也未添加TGase的蛋白样品;MHC-肌球蛋白重链;Actin-肌动蛋白图7 γ-PGA复合TGase对鸡肉肌原纤维蛋白SDS-PAGE凝胶电泳图谱的影响Fig.7 Effect of γ-polyglutamic acid combined with TGase on the SDS-PAGE pattern of chicken myofibrillar protein
从图7-(a)中可以看出,与末添加γ-PGA的蛋白样品相比,加入γ-PGA后的蛋白样品其肌球蛋白重链(MHC)条带和肌动蛋白(Actin)条带都明显减弱。随着γ-PGA质量分数的增大,MHC条带和Actin条带都逐渐减弱,这可能是由于在蛋白质中少量的TGase的催化作用下,γ-PGA降解后产生的Glu残基与蛋白质中的Lys残基发生交联反应、形成大分子物质,然而当γ-PGA质量分数进一步增大时,此时底物浓度已经饱和,MHC条带和Actin条带并未随着γ-PGA质量分数的进一步增大而继续减弱。在含有γ-PGA的蛋白样品中加入0.5%的TGase后,如图7-(b)所示,随着γ-PGA质量分数的增大,MHC条带和Actin条带都逐渐减弱,且在γ-PGA质量分数增大至0.06%后MHC条带和Actin条带变化都不明显,这与图1的结果一致。从图7-(c)中可以看出,MHC条带随着TGase质量分数的增大逐渐减弱,这是由于TGase催化MHC之间通过ε-(γ-Glu)-Lys共价键发生交联并形成了大分子物质[34],但当TGase质量分数进一步增大时,MHC条带并未发生明显变化,在整个过程中Actin条带也未发生明显变化,说明Actin没有参与TGase催化的交联作用。在含有TGase的蛋白样品中加入0.06%的γ-PGA后,如图7-(d)所示,与未添加γ-PGA也未添加TGase的蛋白样品相比,MHC条带和Actin条带都明显减弱。随着TGase质量分数的增大,MHC条带逐渐减弱,而Actin条带并未发生明显变化。从图7-(b)和图7-(d)中可以看出,将γ-PGA和TGase复合使用后MHC条带的减弱程度明显大于单独使用γ-PGA或TGase对MHC条带的减弱程度,这说明γ-PGA和TGase复合使用时能够最大限度地增强蛋白质的交联程度,进而改善蛋白质的凝胶特性。此外,从图7-(a)、图7-(b)、图7-(d)中可以看出,在凝胶顶部存在着一些颜色很深的条带,这可能是由于γ-PGA的分子量很高,其在高温条件下降解后产生了一些分子质量超过200 kDa的高分子物质[35],这些物质在进行凝胶电泳时无法进入到浓缩胶和分离胶中,从而聚积在凝胶顶部。
3 结论
γ-PGA和TGase之间存在协同作用,将γ-PGA和TGase复合使用后对鸡肉肌原纤维蛋白凝胶特性的改善效果明显优于单独使用γ-PGA或TGase对凝胶特性的改善效果,且在TGase质量分数为0.5%、γ-PGA质量分数为0.06%时,凝胶硬度、弹性和保水性都达到最大值;在TGase质量分数为0.7%、γ-PGA质量分数为0.12%时凝胶白度值最小。化学作用力分析表明,经γ-PGA和TGase处理后,疏水相互作用和非二硫共价键是构成凝胶三维结构的主要作用力,离子键、氢键和二硫键是次要作用力,二硫键主要形成于加热过程中。SDS-PAGE凝胶电泳图谱结果表明,TGase能够催化γ-PGA-蛋白质和蛋白质-蛋白质之间通过ε-(γ-Glu)-Lys共价键发生交联反应并形成大分子物质,使肌原纤维蛋白凝胶三维网络结构变得更加致密。
[1] 陈建良,芮汉明,变性淀粉在高静压下对鸡肉糜品质及其微观结构的影响[J]. 食品与发酵工业, 2009, 35(10): 152-157.
[2] 倪学文, 严文莉, 汪芳丽, 等. 魔芋胶对鸡肉和猪肉混合肉糜凝胶特性的影响[J]. 食品工业科技, 2015, 36(8): 305-308.
[3] ISHWAR BAJAJ, REKHA SINGHAL. Poly(glutamic acid)-An emerging biopolymer of commercial interest[J]. Bioresource Technology, 2011, 102(10): 5 551-5 561.
[4] ADETORO OGUNLEYE, ADITYA BHAT, VICTOR U, et al. Poly-γ-glutamic acid: production, properties and applications[J]. Microbiology, 2015, 161: 1-17.
[5] TANIMOTO H, MORI M, MOTOKI M, et al. Natto mucilage containing poly-γ-glutamic acid increases soluble calcium in the rat small intestine[J]. Bioscience Biotechnology and Biochemistry, 2001, 65(3): 516-521.
[6] HO G H, HO T I, HSIEH K H, et al. Gamma-Polyglutamic acid produced byBacillussubtilis(natto): structural characteristics, chemical properties and biological functionalities[J]. Journal of the Chinese Chemical Society, 2006, 53(6): 1 363-1 384.
[7] XIONG Y L. A comparison of the rheological characteristics of different fraction of chicken myofibrillar proteins[J]. Journal of Food Biochemistry, 1993, 16(4): 217-227.
[8] SALVADOR P, TOLDRA M, SAGUER E, et al. Microstructure-function relationships of heat-induced gels of porcine haemoglobin [J]. Food Hydrocolloids, 2009, 23(7):1 654-1 659.
[10] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[11] RAWDKUEN S, BENJAKUL S, VISESSANGUAN W, et al. Chicken plasma protein affects gelation of surimi from bigeye snapper (Priacanthustayenus)[J]. Food Hydrocolloids, 2004, 18(2): 259-270.
[12] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophageT4[J]. Nature, 1970, 227(5 259): 680- 685.
[13] GOTO A, KUNIOKA M. Biosynthesis and hydrolysis of poly(glutamic acid) fromBacillussubtilisIFO3335[J]. Biosci Biotechnol Biochem, 1992, 56(7): 1 031-1 035.
[14] SEO J H, KIM C S, LEE S P. Physicochemical properties of poly-γ-glutamic acid produced by a novelBacillussubtilisHA isolated from Cheonggukjang[J]. Preventive Nutrition and Food Science, 2008, 13(4): 354-361.
[15] TSAI G, LIN S, JIANG S T. Trangsglutaminase from streptoverticillium ladakanum and application to minced fish product[J]. Journal of food science, 1996, 61(6): 1 234-1 238.
[16] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation[J]. Meat Science, 2005, 70(2): 293-299.
[17] 王静心, 李政, 张健飞, 等. γ-聚谷氨酸水凝胶研究与应用进展[J]. 微生物学通报, 2014, 41(8): 1 649-1 654.
[18] SOOTTAWAT B, WONNOP V, SUTTIRAK P. Suwari gel properties as affected by transglutaminase activator and inhibitors[J]. Food Chemistry, 2004, 85(1): 91-99.
[19] MARTELO-VIDAL M J, FERNNDEZ-NO I C, GUERRA-RODRGUEZ E, et al. Obtaining reduced-salt restructured white tuna (Thunnusalalunga) mediated by microbial transglutaminase[J]. LWT-Food Science and Technology, 2016, 65: 341-348.
[20] TARR H L A. Ribose and the Maillard reaction in fish muscle[J]. Nature, 1953, 4 347(171): 344-345.
[21] URESTI R M, RAMIREZ J A, LOPEZ-ARIAS N, et al. Negative effect of combining microbial transglutaminase with low methoxyl pectins on the mechanical properties and colour attributes of fish gels[J]. Food Chemistry, 2003, 80(4): 551-556.
[22] YANG H, PARK J W. Effects of starch properties and thermal-processing conditions on surimi-starch gels[J]. LWT-Food Science and Technology, 1998, 31(4): 344-353.
[23] VISSCHERS R W, DE JONGH H H J. Disulphide bond formation in food protein aggregation and gelation[J]. Biotechnology Advances, 2005, 23(1): 75-80.
[24] LIU H, GAO L, REN Y, et al. Chemical interactions and protein conformation changes during silver carp (Hypophthalmichthysmolitrix) surimi gel formation[J]. International Journal of Food Properties, 2014, 17(8): 1 702-1 713.
[25] DONDERO M, FIGUEROA V, MORALES X, et al. Transglutaminase effects on gelation capacity of thermally induced beef protein gels[J]. Food Chemistry, 2006, 99(3): 546-554.
[26] TAKEDA H, SEKI N. Enzyme-catalyzed cross-linking and degradation of myosin heavy chain in walleye pollack surimi paste during setting[J]. Fisheries Science, 1996, 62(3): 462-467.
[27] FOEGEDING E A, LANIER T C, HULTIN H O. Characteristics of edible muscle tissues[J]. Food Chemistry, 1996, 3(15): 879-942.
[28] HOSSAIN M I, ITOH Y, MORIOKA K, et al. Contribution of the polymerization of protein by disulfide bonding to increased gel strength of walleye pollack surimi gel with preheating time[J]. Fisheries Science, 2001, 67(4): 710-717.
[29] KO W C, YU C C, HSU K C. Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J]. LWT-Food Science and Technology, 2007, 40(8): 1 316-1 320.
[30] SANO T, OHNO T, OTSUKA-FUCHINO H, et al. Carp natural actomyosin: thermal denaturation mechanism[J]. Journal of Food Science, 1994, 59(5): 1 002-1 008.
[31] JIANG S T, Lan C C, TSAO C Y U. New approach to improve the quality of minced fish products from freeze-thawed cod and mackerel[J]. Journal of Food Science, 1986, 51(2): 310-312.
[32] BENJAKUL S, VISESSANGUAN W, SRIVILAI C. Porcine plasma proteins as gel enhancer in bigeye snapper (Priacanthustayenus) surimi[J]. Journal of Food Biochemistry, 2001, 25(4): 285-305.
[33] KIMURA I M, SUGIMOTO M, TOYODA K, et al. A study on the cross-links reaction of myosin in kamaboko ‘suwari’gels[J]. Nippon Suisan Gakkaishi, 1991, 57: 1 386-1 389.
[34] JIANG S T, HSIEH J F, HO M L, et al. Microbial transglutaminase affects gel properties of golden threadfin- bream and pollack surimi[J]. Journal of Food Science, 2000, 65(4): 694-699.
[35] KUNIOKA M AND CHOI H. Hydrolytic degradation and mechanical properties of hydrogels prepared from microbial poly (amino acid) s[J]. Polymer Degradation and Stability, 1998, 59(1):33-37.
