发菜中GDP-甘露糖4,6-脱水酶基因的克隆及原核表达
2018-02-28蔡国强陈雪峰范华刘欢赵圆圆
蔡国强,陈雪峰,范华,刘欢,赵圆圆
( 陕西科技大学 食品与生物工程学院,陕西 西安,710021)
发菜(Nostocflagelliforme),学名发状念珠藻,是一种经济价值极高的光能自养型陆生蓝细菌。在我国,野生发菜主要分布在干旱、半干旱的荒漠及半荒漠地带[1]。发菜胞外多糖是发菜生长过程中分泌在细胞外的活性多糖,具有抗氧化、抗病毒、抗肿瘤、提高免疫力等生物活性,可以保护细胞,抵抗外界恶劣环境,赋予了发菜较高的食用和药用价值[2-4]。然而,发菜因为生长缓慢和过度采掘致使野生发菜资源濒临毁灭。如何通过人工培养的方式提高发菜及其胞外多糖的产量成为亟待解决的问题。王贵春等发现,在0.3 mol/L盐浓度下,发菜胞外多糖产量较正常培养条件下提高了50.3%[5]。赵秀霞等对0 mol/L和0.3 mol/L盐浓度下的发菜细胞进行转录组测序,得到13 170条差异表达基因,其中3 115条上调表达基因,10 055条下调,差异表达基因的GO功能聚类和Pathway代谢通路分析表明,涉及到光合作用、糖酵解/糖合成、Na+/K+运输、能量代谢、核糖体代谢、次级代谢产物生物合成等众多通路的基因都出现一定程度的差异表达[6]。GDP-甘露糖4,6-脱水酶是GDP-L-岩藻糖合成途径中的关键酶,可以催化GDP-D-甘露糖形成GDP-4-酮基-6-脱氧-D-甘露糖,进而在GDP-酮-6-脱氧甘露糖3,5-表异构酶的催化作用下,转化成GDP-L-岩藻糖[7]。在从头合成途径中,GDP-甘露糖4,6-脱水酶参与合成活性核糖,为前体糖核苷酸的形成提供原料,从而参与多糖重复单元的合成组装[8]。前期转录组测序结果发现发菜GDP-甘露糖4,6-脱水酶基因在0.3 mol/L盐浓度下转录水平较0 mol/L提高了2.18倍。
本研究对发菜中的GDP-甘露糖4,6-脱水酶基因进行克隆及生物信息学分析,并构建其重组表达质粒在大肠杆菌中成功高效表达。为发菜多糖合成调控机理的研究奠定一定的理论基础,为GDP-甘露糖4,6-脱水酶基因工程菌株的构建提供理论依据。
1 材料和方法
1.1 材料与试剂
本实验所用发菜、质粒pET-28a由陕西科技大学微生物制造研究室保藏;大肠杆菌BL21、DH5α感受态细胞以及各种试剂盒,天根生化科技(北京)有限公司;pMD19T载体和各种限制性内切酶,TaKaRa宝生物工程有限公司;溴酚蓝,沈阳试三生化科技开发有限公司;考马斯亮蓝,SDS和甘氨酸,美国Sigma公司;巯基乙醇,国药集团化学试剂有限公司;30% 丙烯酰胺和TEMED,碧云天生物技术公司。
1.2 仪器与设备
DYCZ-24EN蛋白电泳仪,江苏兴化市分析仪器厂;LDZX-30KBS高压蒸汽灭菌锅,上海申安医疗器械厂;MGC-400HP光照培养箱,上海善志仪器有限公司;2H-4水浴锅,金坛宏华仪器厂;Mastercycler nexusPCR仪,德国Eppendorf公司;DYY-2C琼脂糖凝胶电泳仪,北京市六一仪器厂;FR-980A生物电泳图像分析系统,上海复日科技有限公司。
1.3 方法
1.3.1 目的片段TA克隆
按照天根生化科技(北京)有限公司的植物基因组提取试剂盒方法提取发菜基因组DNA,根据转录组测序结果及NCBI相似基因序列同源比对分析后进行引物设计,上游引物的序列为G1:5′-ATGACGCAACAGAAGCGAGC-3′,下游引物的序列为G2:5′-TCAGAAGTGCAAAGCGCC-3′,由上海捷瑞生物工程有限公司合成。PCR反应体系为:发菜基因组DNA 2 μL,上下游引物各1 μL,2×TaqPCR MasterMix 10 μL,ddH2O 6 μL。扩增条件:95 ℃ 5 min,95 ℃ 30 s,46 ℃ 30 s,72 ℃ 1 min,30个循环,72 ℃ 5 min。1%琼脂糖电泳检测并回收产物,与 pMD19-T载体连接,转化DH5α感受态,筛选阳性克隆进行菌液PCR检测后送至北京奥科鼎盛生物科技公司测序。
1.3.2 序列分析
测序结果在NCBI进行确认,通过DNAMAN推译得到氨基酸序列,再使用DNAstar进行分析。利用ProtScale分析目的蛋白的亲水性和疏水性。利用 DNAMAN和SOPMA对GDP-甘露糖4,6-脱水酶的二级结构进行预测分析。利用TMHMM对目的蛋白进行跨膜区分析。利用NetPhos3.1 Server对目的蛋白进行磷酸化位点分析。
1.3.3 GDP-甘露糖4,6-脱水酶基因原核表达
根据测序结果,设计GDP-甘露糖4,6-脱水酶基因的扩增引物,并在上下游的5′端添加BamHI和XhoI的酶切位点以及相应的保护碱基(A1:5′-CGCGGATCCATGACGCAACAGAAGCGAGC-3′;A2:5′-CCGCTCGAGGAAGTGCAAAGCGCC-3′)。扩增条件:95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,30个循环,72 ℃ 5 min。1%琼脂糖电泳检测。
以GDP-甘露糖4,6-脱水酶基因与 pMD19-T连接而成的重组质粒为模板进行PCR扩增。将纯化后的PCR产物和pET28a质粒用BamHI和XhoI分别进行双酶切后相连,得到蛋白基因表达载体。将重组质粒转化到DH5α培养,筛选阳性克隆进行菌液PCR和双酶切验证。转化感受态BL21,诱导表达后通过SDS-PAGE进行电泳检测。
2 结果与分析
2.1 发菜GDP-甘露糖4,6-脱水酶基因TA克隆
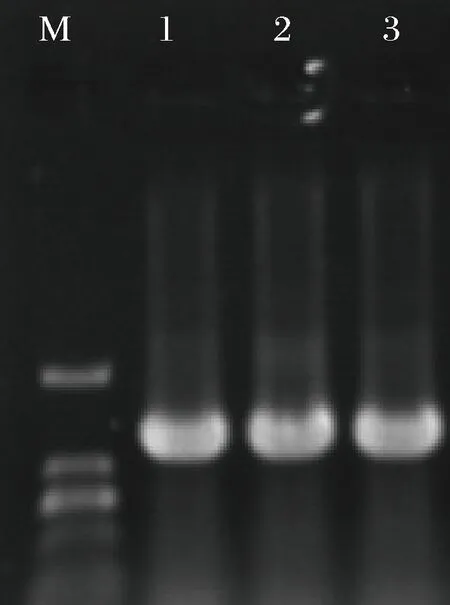
提取发菜DNA进行琼脂糖凝胶电泳,结果符合预期大小(图1)。PCR扩增后,在1 100 bp位置出现条带,符合预期(图2)。将纯化回收后的发菜GDP-甘露糖4,6-脱水酶基因与pMD19-T相连,转化感受态DH5α,筛选阳性克隆进行菌液PCR鉴定,结果显示,成功筛得含有大小为1 200 bp(含克隆位点140 bp左右)的重组克隆载体的阳性菌株(图3),表明发菜GDP-甘露糖 4,6-脱水酶基因成功克隆至pMD19-T 载体上。

M-λDNA HindIII;1~2-发菜DNA图1 发菜基因组DNA抽提电泳图Fig.1 Electrophorogram of genome DNA from N.flagelliforme
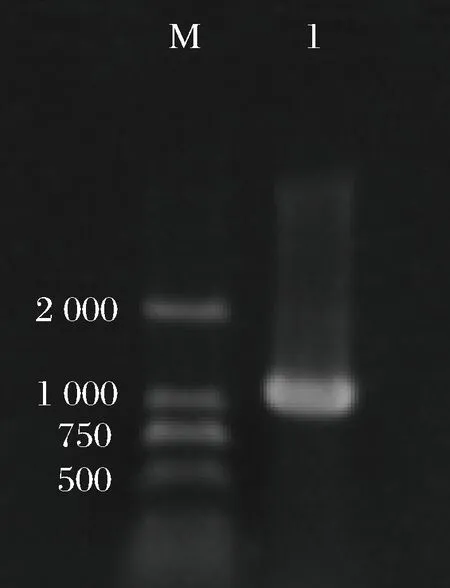
M-DL2000;1-GDP-甘露糖 4,6-脱水酶基因图2 GDP-甘露糖 4,6-脱水酶基因的PCR扩增Fig.2 GDP-mannose 4,6-dehydratase PCR amplification
2.2 发菜GDP-甘露糖 4,6-脱水酶基因序列分析
通过pMD19-T通用引物对重组片段测序发现:发菜GDP-甘露糖4,6-脱水酶基因大小为1 080 bp。使用DNAstar对其氨基酸序列表明:GDP-甘露糖4,6-脱水酶包含的氨基酸残基数为359。 GDP-甘露糖4,6-脱水酶的带电荷总氨基酸为84个,占总氨基酸残基23.39% ,其中带正电荷38个,带负电分析荷46个。极性氨基酸共有100个,占27. 86% ,疏水氨基酸有119个,占33. 15% ,酸性氨基酸和碱性氨基酸分别占12.53%和10.58%。在GDP-甘露糖4,6-脱水酶中包含较多的氨基酸为Leu(9.19%)、Gly(7.52%)、Thr(6.96%)、Arg(6.69%)、Glu(6.41%)、Ala(6.41%)、Asp(6.13%)、Gln(5.85%)、Tyr(5.85%)(图4)。
M-DL2000;1~3-GDP-甘露糖 4,6-脱水酶基因阳性转子图3 阳性转化子(DH5α)的PCR验证Fig.3 PCR identification of positive transformant (DH5α)

图4 GDP-甘露糖4,6-脱水酶的核苷酸及氨基酸序列 Fig.4 Nucleotide sequence and amino acid sequence of GDP-mannose 4,6-dehydratase
通过DNAMAN软件将发菜中GDP-甘露糖4,6-脱水酶的核苷酸序列及氨基酸序列与GenBank的同源物种序列进行BLAST比对,发现GDP-甘露糖4,6-脱水酶基因具有较高的保守性,与点状念珠藻(NostocpunctiformePCC 73102)的基因同源性达93.1%,氨基酸同源性达97.3%。与丝状蓝藻(Calothrixsp. PCC 7507)的基因同源性达83.3%,氨基酸同源性达92.4%。与筒孢藻(CylindrospermumstagnalePCC 7417)的基因同源性为83.1%,氨基酸同源性达91.2%。与念珠藻(Nostocsp. PCC 7107)的基因同源性为82.64%,氨基酸同源性达93.13%。与NostocpiscimakeCENA21的基因同源性为81.43%,氨基酸同源性达91.12%。与鱼腥藻(AnabaenacylindricaPCC 7122)的基因同源性为80.87%,氨基酸同源性达90.58%。与侧生藻(Fischerellasp. NIES 3754)的基因同源性为79.39%,氨基酸同源性达88.72%。与多变鱼腥藻(AnabaenavariabilisATCC 29413)的基因同源性为78.0%,氨基酸同源性达89.0%(图5)。
2.3 GDP-甘露糖4,6-脱水酶基因的疏水性、跨膜区、磷酸化位点分析及二级结构预测
利用ExPASy软件对发菜GDP-甘露糖4,6-脱水酶的氨基酸序列进行疏水性分析,结果显示第194位的脯氨酸(Pro)亲水性最强,第185位的天冬酰胺(Asnr)疏水性最强。整体来看,亲水性区间分布更广,相对于疏水性区间较多,因此确定GDP-甘露糖4,6-脱水酶是亲水性蛋白。
利用TMHMM程序对GDP-甘露糖4,6-脱水酶进行跨膜区分析,结果表明,GDP-甘露糖4,6-脱水酶不含跨膜区。
利用NetPhos对GDP-甘露糖4,6-脱水酶的磷酸化位点进行预测,结果表明,GDP-甘露糖4,6-脱水酶的Ser、Thr和Tyr磷酸化位点个数分别为:17、15和13个。运用DNAMAN软件和SOPMA软件对GDP-甘露糖4,6-脱水酶二级结构进行预测分析,虽然不同软件的算法存在差异,但经综合分析认为,发菜GDP-甘露糖4,6-脱水酶的二级结构主要构成方式为α螺旋和随机卷曲(表1)。

图5 GDP-甘露糖 4,6-脱水酶DNA 的核苷酸序列(左)及推导的氨基酸序列(右) 同源树Fig.5 Homology tree of nucleotide sequence (left) and its deduced amino acid sequence (right) of GDP-mannose 4,6-dehydratase
表1 发菜GDP-甘露糖4,6-脱水酶二级结构预测结果
Table 1 The secondary structure prediction of GDP-mannose 4,6-dehydratase from N. fiagelliforme
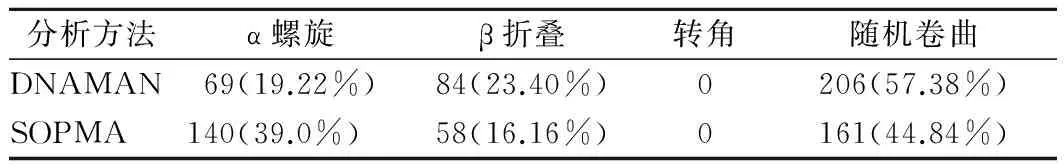
分析方法α螺旋β折叠转角随机卷曲DNAMAN69(19.22%)84(23.40%)0206(57.38%)SOPMA140(39.0%)58(16.16%)0161(44.84%)
2.4 GDP-甘露糖4,6-脱水酶在大肠杆菌中的表达
构建GDP-甘露糖4,6-脱水酶的表达载体pET28a-GDP-mannose 4,6-dehydratase,转化DH5α挑选阳性克隆进行菌液PCR验证,得到1 300 bp大小的特异性条带(加上克隆位点300 bp左右),符合预期大小(图5)。抽取质粒进行双酶切验证,结果在1 080 bp处出现1条特异条带,与预期片段大小一致(图6)。测序结果表明插入的片段就是GDP-甘露糖4,6-脱水酶基因。

M-DL2000;1~3-GDP-甘露糖4,6-脱水酶基因重组质粒阳性转化子图5 阳性转化子(DH5α/pET28a-GDP-mannose 4,6-dehydratase)的PCR验证Fig.5 PCR identification of positive transformant(DH5α/pET28a-GDP-mannose 4,6-dehydratase)
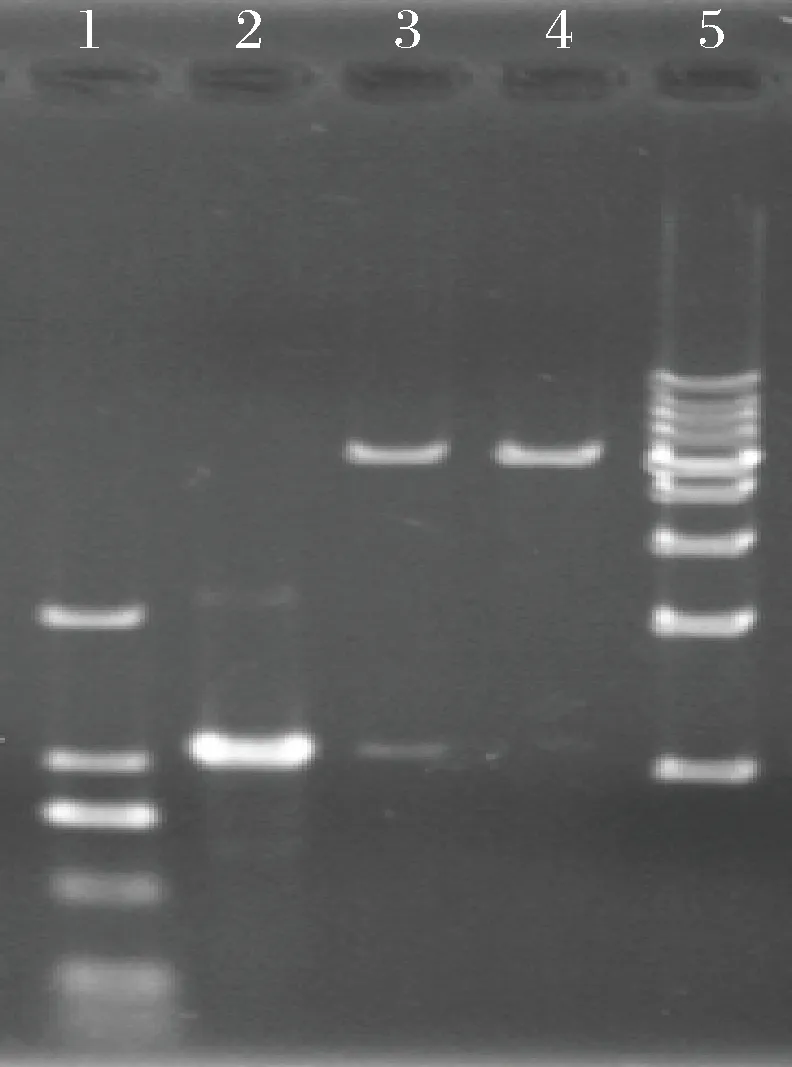
1-DL2000;2-双酶切后GDP-甘露糖4,6-脱水酶基因;3-重组质粒双酶切;4-双酶切后pET28a;5-10 kb DNA ladder图6 阳性转化子(DH5α/pET28a-GDP-mannose 4,6-dehydratase)的酶切验证Fig.6 Dual restriction enzyme digestion identification of positive transformant (DH5α/pET28a-GDP-mannose 4,6-dehydratase)
将表达载体转化BL21,筛选阳性菌接种到含有卡那霉素的LB培养基,37 ℃,200 r/min培养至OD值为0.8时,加入IPTG使其浓度为1 mmol/L,16 ℃,120 r/min培养20 h后取样进行电泳。SDS-PAGE电泳检测结果表明有外源蛋白表达(图7),参照蛋白分子量标准,外源蛋白分子质量约为41.08 ku,与预测的GDP-甘露糖4,6-脱水酶分子质量相同。

M-蛋白分子量标准;1-IPTG诱导的空质粒转化子; 2-未诱导的阳性质粒转化子;3-IPTG诱导10 h的阳性质粒转化子;4-IPTG诱导15 h的阳性质粒转化子;5-IPTG诱导 20 h的阳性质粒转化子图7 GDP-甘露糖 4,6-脱水酶基因在大肠杆菌BL21中的表达Fig.7 GDP-mannose 4,6-dehydratase expressed in E.coli BL21
3 讨论
由于发菜全基因组尚未公布,因此通过BLAST比对高同源性的基因序列设计特异性引物进行克隆成为研究发菜基因的主要手段[9-10]。所以根据转录组测序结果及同源比对分析设计引物进行GDP-甘露糖4,6-脱水酶基因的克隆,成功得到大小为1 080 bp的目的序列。经同源性比较发现发菜GDP-甘露糖4,6-脱水酶基因具有较高保守性,与点状念珠藻(NostocpunctiformePCC 73 102)的核苷酸序列相似度达93.1%,氨基酸序列相似度达97.3%。生物信息学分析表明GDP-甘露糖4,6-脱水酶是亲水性膜外蛋白,酪氨酸有13个磷酸化位点,苏氨酸有15个磷酸化位点,丝氨酸有17个磷酸化位点,二级结构主要构成方式为随机卷曲和α螺旋,等电点为5.73,正负电荷氨基酸残基数分别为38和46。这为进一步研究GDP-甘露糖4,6-脱水酶基因在发菜多糖代谢中的分子调控机制奠定基础。此外,本实验构建了GDP-甘露糖4,6-脱水酶基因的高效表达载体,这为今后GDP-甘露糖4,6-脱水酶基因工程菌株的构建提供理论依据。
盐胁迫下发菜多糖产量提高,GDP-甘露糖4,6-脱水酶基因转录水平上调。这暗示基因可能是盐胁迫下发菜胞外多糖代谢的关键调控因子,它们在发菜响应盐胁迫过程中发挥了重要的调节作用。GDP-甘露糖4,6-脱水酶可以催化GDP-D-甘露糖形成GDP-4-酮基-6-脱氧-D-甘露糖,进而形成GDP-L-岩藻糖,参与多糖合成。说明发菜可能通过相关基因调控多糖合成途径以响应盐胁迫,这也从分子层面为“盐胁迫下发菜多糖产量明显提高”这一结论提供依据。然而,多糖代谢调控是一个复杂的生物调控过程,参与基因众多,它们如何在转录水平调控多糖代谢以响应盐胁迫还需要进一步研究。
[1] YUE S J, JIA SR, YAO J, et al.Nutritional analysis of the wild and liquid suspension culturedNostocflagelliformeand antitumor effects of the extracellular polysaccharides[J].Advanced Materials Research,2012, 1465(345):177-182.
[2] 陈雪峰,李一当.发菜多糖清除自由基活性的研究[J].安徽农业科学,2008,36(8):3 088-3 089.
[3] 陈雪峰,王贵春,刘宁,等.盐胁迫发菜胞外多糖的抗氧化活性[J].陕西科技大学学报(自然科学版),2015,33(01):122-125,135.
[4] KANEKIYO K,HAYASHI K,TAKENAKA H,et al.Anti-herpes simplex virus target of an acidic polysaccharide,nostoflan,from the edible blue-green algaNostocflagelliforme[J].Biological & Pharmaceutical Bulletin,2007,30(8):1 573-1 575.
[5] 王贵春.盐胁迫对发菜胞外多糖化学结构及抗氧化活性的影响[D].西安:陕西科技大学,2015.
[6] 赵秀霞.发菜盐胁迫转录组分析及胞外多糖合成基因的克隆与表达[D].西安:陕西科技大学,2016.
[7] 王鸿超,张陈,周昕,等.高山被孢霉GDP-L-岩藻糖合成途径中GDP-甘露糖 4,6-脱水酶的克隆、表达和功能鉴定[J].食品与发酵工业,2016,42(11):14-19.
[8] STURLA L,BISSO A,ZANARDI D,et al.Expression,purification and characterization of GDP-mannose 4,6 dehydratase fromEscherichiacoli[J].Febs Lett,1997,412(1):126-130.
[9] 章秀.发菜海藻糖合成酶及水解酶基因的克隆及在大肠杆菌中的表达[D].上海:上海师范大学,2008.
[10] 汪滢,陈李萍,陈晓,等.发菜中超氧化物歧化酶基因的克隆及在大肠杆菌中的表达[J].植物研究,2007,27(3):289-292.
