“肽植”固体饮料的体外活性和对斑马鱼肝脏保护作用的评价
2018-02-28贾福怀韩晓峰李志军马芙俊文剑苑鹏段盛林
贾福怀,韩晓峰,李志军,马芙俊,文剑,苑鹏,段盛林*
1(宁波御坊堂生物科技有限公司,浙江 宁波,315012) 2(中国食品发酵工业研究院,北京,100015)
随着社会经济的飞速发展,我国居民的生活习惯和饮食结构发生了深刻变化,不合理膳食引发的多种慢性疾病成为威胁人们健康的重大隐患。我国政府业已认识到营养干预对慢性病的预防与治疗有关键作用,并期望通过倡导健康生活方式和指导合理饮食结构,预防慢性疾病的发生。“药食同源”主要是指食物与草药同一来源,药食同源亦食亦药,它不仅可以充饥,还具有营养、保健、防病治病等多种功能[1]。我国具有悠久的“医食同源”传统理念和丰富的药食两用资源。例如枸杞子富含枸杞多糖,甜菜碱和维生素A,性质温和,具有益精明目,滋补肝肾的作用[2];蒲公英则富含多种维生素和矿物质,常用于清热解毒,利尿消炎;甘草的有效成分为甘草甜素、甘草次酸、甘草苷元、甘草多糖,具有补脾益气、润肺止咳、缓急止痛之功效。
近些年,具有生理活性的肽作为介于氨基酸和蛋白质之间的一类化合物,已经成为药理和功能保健食品等研究领域的明星[3]。玉米低聚肽是将玉米蛋白经酶解后,通过小肽分离技术而得到的小分子多肽,具有营养丰富,易于吸收,水溶性和稳定性好,不受肠胃环境影响等优点[4]。玉米低聚肽不但具有降血压、抗疲劳、抗氧化的功能特性,也有研究表明其具有降低甘油三酯和保肝护肝等作用[5]。
斑马鱼(Zebrafish)因其身体两侧的蓝白相间条纹类似斑马而得名,是一种原产于南亚的淡水鱼。由于斑马鱼与人类基因的相似度超过80%[6],同时具有物种稳定,饲养方便,胚胎通透,便于观察等特点,斑马鱼已经成为疾病模型建立、毒理学评价和药物筛选等研究领域中的模式动物新星[7]。对乙酰氨基酚临床上常用于解热镇痛,但对肝脏有严重的损伤副作用[8];以对乙酰氨基酚为底物,以存活率、肝脏面积、肝脏明亮度和卵黄囊吸收延迟面积等为评价指标的斑马鱼肝损伤模型研究业已成熟[9]。
本文考察了一款“肽植”固体饮料的体外抗氧化性和促进甘油三酯(TG)代谢的能力,并选用受精后3 d(3dpf)的野生型AB品系斑马鱼,观察“肽植”固体饮料对对乙酰氨基酚诱发的斑马鱼肝损伤的保护作用。
1 材料与方法
1.1 材料与试剂
“肽植”固体饮料粉末(由小麦低聚肽1.67%、玉米低聚肽12.50%、甘草提取物0.83%、枸杞子提取物2.50%、蒲公英提取物2.50%、小麦胚芽粉16.67%、麦芽糊精17.5%、绿豆粉20.83%、藕粉25.00%等组成),宁波养生之家健康科技有限公司提供;蜂王浆,中国农业科学院蜜蜂所提供;红枣阿胶枸杞粉、捷森蜂蜜脆麦片(德国产)、核桃阿胶粉、普通面粉,均购自超市。阴凉柜避光保存。
福林试剂、磷酸缓冲盐溶液(phosphate buffered saline,PBS)、1,1-二苯基-2-三硝基苯肼(DPPH)、油酸(oleic acid,OA)、棕榈酸(palmitic acid,PA)、二甲基亚砜(dimethyl sulfoxide,DMSO)、胰蛋白酶、油红O染色剂,美国Sigma化学公司;DMEM培养基、噻唑兰(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenylterazolium bromide,MTT)、胰蛋白酶、平衡盐缓冲液(hank’s balanced salt solution,HBSS),太和华美(北京)医药科技股份有限公司;新西兰加强型小牛血清,北京北方同正生物技术发展有限公司;无FFA牛血清蛋白(FFA-free bovine serum albumin,BSA),日本WAKO公司;RIPA细胞裂解液,碧云天生物技术研究所;甘油三脂(triglycerol,TG)试剂盒,南京建成泰浩生物科技有限公司; RU-21(批号25747),Spirit Sciences USA;4%多聚甲醛,鼎国生物;对乙酰氨基酚(acetaminophen)、N-乙酰半胱氨酸(简称NAC)、甲基纤维素,阿拉丁试剂(上海)有限公司;无水乙醇、铁氰化钾、FeCl3、三氯乙酸(分析纯),国药集团化学试剂有限公司;6孔板,Nest Biotech China。
1.2 仪器与设备
微量移液枪,德国Eppendorf 公司;RE-52A 旋转蒸发仪,上海亚荣生化仪器有限公司;倒置生物显微镜,解剖显微镜SZX7(带相机),日本Olympus公司;生物安全柜,中国济南鑫贝西生物技术有限公司;37 ℃ CO2培养箱,日本松下公司;pH计、精密电子天平CP214,瑞士Mettler Toledo 公司;荧光显微镜AZ100,日本尼康公司;759-紫外可见分光光度计,上海菁华科技仪器有限公司;DK-8D三温三控水槽,上海博迅实业有限公司;KQ-250DE数控超声波清洗器,昆山市超声仪器有限公司;SHA-B水浴恒温振荡器,金坛市精达仪器制造厂;全波长酶标仪,美国热电集团;高速冷冻离心机,美国贝克曼公司。
1.3 实验细胞与实验动物
1.3.1 肝癌细胞株(HepG2)
中国食品发酵工业研究院保存。
1.3.2 斑马鱼
野生型AB品系斑马鱼,实验动物使用许可证号:SYXK(浙)2012-0171(AAALAC)。挑选正常雌雄成鱼交配产卵,收集受精卵培养3 d,孵化的幼鱼用于实验。饲养基础用水为28 ℃,每1 L反渗透水中加入200 mg速溶海盐,电导作用为 480~510 μs/cm;pH为 6.9~7.2;硬度为 53.7~71.6 mg/L CaCO3。
1.4 实验供试液的配制
1.4.1 抗氧化实验待测液的配制
精密称取“肽植”固体饮料产品、蜂王浆、脆麦片、普通面粉、红枣阿胶粉、核桃阿胶粉各24g(固体样品经机械粉碎,过60 目筛),分别置于100 mL圆底烧瓶中,加入30 mL乙醇与水混合液(体积比1∶1),常温下超声提取30 min共3次,合并提取液,离心(3 000 r/min,10 min),取上清溶液,定容到100 mL,即得样品溶液,浓度为240 mg/mL。
1.4.2 细胞实验对照组溶液、模型组溶液和样品溶液的配制
称取1.0 mg BSA和100 mL无糖无酚红的DMEM培养基(预热至50 ℃)于蓝盖瓶中混匀,加入450 mg葡萄糖,待葡萄糖溶解后用0.22 μm过滤器过滤2次,得到的即为25G 1% BSA的对照组溶液。
称取2.0 mg BSA和200 mL无糖无酚红的DMEM培养基(预热至50 ℃)于蓝盖瓶中混匀,然后称取40.6 mg的油酸钠、18.6 mg的棕榈酸钠(其摩尔比为2∶1)和500 μL蒸馏水于2 mL离心管中,70 ℃水浴加热,直至其全部溶解且为透明状态,逐滴加到培养基中超声混匀,0.22 μm过滤器过滤,再加入360 mg葡萄糖和540 mg果糖,全溶后用0.22 μm过滤器再过滤1次,得到的即为10G 15F 1 mmol/L FFA的模型组溶液。
将“肽植”固体饮料粉过60目筛,制成浓度为5 mg/mL的母液,过0.22 μm滤膜,备用。
所有细胞实验的受试溶液于-20 ℃保存备用,使用前孵育至37 ℃。
1.4.3 斑马鱼实验用溶液的配制
肽植固体饮料粉过60目筛,用纯水配制成50 mg/mL母液,用养鱼用水按需稀释。
1.5 实验方法
1.5.1 总还原力的测定
通过预试验的筛选[10],分别加入pH 6.6 的PBS 缓冲液1.0 mL、1%铁氰化钾溶液1.0 mL、不同质量浓度待测液1.0 mL于试管中,摇匀后置于50 ℃水浴锅中加热20 min,待冷却后再加入1%三氯乙酸2.5 mL并摇匀,离心(3 000 r/min,10 min),吸取2.0 mL于另一只试管中,并加入蒸馏水5.0 mL 和0.1%三氯化铁1.0 mL,混匀后静置10 min,于700 nm 处测定反应体系的OD 值,每组实验重复3次,绘制总还原能力变化曲线[11]。
1.5.2 DPPH自由基的清除能力的测定
通过预试验的筛选[12],分别取5个不同浓度梯度的各个样品溶液1.0 mL,DPPH自由基溶液1.0 mL,作为A1组,吸光度值为A1;分别取待测液1.0 mL,50%乙醇1.0 mL,作为A2组,吸光度值为A2;DPPH自由基溶液1.0mL,50%乙醇1.0 mL,为A0参比值。测定各个浓度梯度和对比、参比样品在517 nm波长处的吸光度,每组实验重复3次。在线性范围内计算半数有效浓度IC50值(数值越小DPPH自由基的清除能力越强)。
(1)
1.5.3 细胞内TG含量的测定
采用游离脂肪酸(FFA)(油酸与棕榈酸的混合物,V(油酸)∶V(棕榈酸)=2∶1)诱导HepG2细胞建立脂肪变性细胞模型[13]。以此模型为研究对象,给予含不同浓度的“肽植”固体饮料的培养基培养24 h,通过MTT法测定细胞活性,筛选受试物的最佳作用浓度。实验随机分为模型组(FFA)、正常组(对照,非诱导的正常HepG2细胞)以及不同浓度的药物组。将孔板内待测细胞用PBS润洗2次后,加入RIPA裂解液。充分裂解后,用TG试剂盒测定TG含量。结果以对模型组的百分比表示(%)。
1.5.4 对乙酰氨基酚诱发肝损伤保护作用的斑马鱼实验
根据肝损伤保护最大耐受浓度(MTC)摸索实验,确定“肽植”固体饮料对肝损伤保护模型斑马鱼的MTC为50 μg/mL,因此实验浓度设置为:5.6 μg/mL(1/9 MTC)、16.7 μg/mL(1/3 MTC)和50 μg/mL(MTC)。
随机选取180尾斑马鱼于六孔板中,每孔(实验组)均处理30尾斑马鱼,用对乙酰氨基酚诱发斑马鱼肝损伤。分别给予“肽植”固体饮料浓度5.6、16.7和50 μg/mL,阳性对照药N-乙酰半胱氨酸(以下简称NAC)浓度1.6 μg/mL,同时设置正常对照组(养鱼用水处理斑马鱼)和模型对照组,每孔(实验组)容量为3 mL。“肽植”固体饮料与对乙酰氨基酚共同处理48 h后,每个实验组随机选取10尾斑马鱼在荧光显微镜下拍照并采集数据,用NIS-Elements D 3.10 高级图像处理软件进行图像分析,计算斑马鱼肝脏面积(A)、肝脏明亮度平均值(S)和卵黄囊吸收延迟面积(A),进行定量分析,并统计,统计学处理结果用mean±SE表示。“肽植”固体饮料肝损伤保护作用计算公式如下:
(2)
(3)
(4)
式中:A1~A3、S1~S3、A4~A6分别为正常对照组、模型对照组和实验组(NAC+“肽植”固体饮料)的肝脏面积、肝脏明亮度和卵黄囊吸收延迟面积。
1.6 数据分析方法
实验数据采用Origin 8.1 软件进行单因素方差(One-Way ANOVA)分析,来判断显著性差异,p<0.05代表有显著性差异,p<0.01,p<0.001代表有极其显著性差异。
2 结果与分析
2.1 抗氧化实验——总还原力
所有样品随浓度的增大,其总还原力均呈现增长的趋势;在各个样品终点浓度相同的情况下(24 mg/mL),对照样品中只有红枣阿胶粉的总还原力较高(OD=0.20),与“肽植”固体饮料的总还原力比较接近(OD=0.25),其中吸光度OD值越大,总还原力越强,见图1。所有受试样品中,“肽植”固体饮料的总还原力最强。

图1 各样品总还原力对比Fig.1 Comparison on Fe3+ reducing power of different samples
2.2 抗氧化实验——DPPH自由基清除能力
除蜂王浆和普通面粉以外,受试样品随浓度的增大,其DPPH自由基清除率都能达到或接近100%,且在较低浓度范围内呈现出很好的线性关系。如图2所示,在线性范围内计算半数有效率IC50值(IC50数值越小DPPH自由基的清除能力越强),IC50(“肽植”固体饮料)=2.0 mg/mL, IC50(脆麦片)=6.5 mg/mL,IC50(普通面粉)=69.1 mg/mL,IC50(蜂王浆)=36.6 mg/mL,IC50(红枣阿胶粉) = 4.8 mg/mL,IC50(核桃阿胶粉)=4.5 mg/mL。所有受试样品中,“肽植”固体饮料的DPPH自由基清除能力最强。
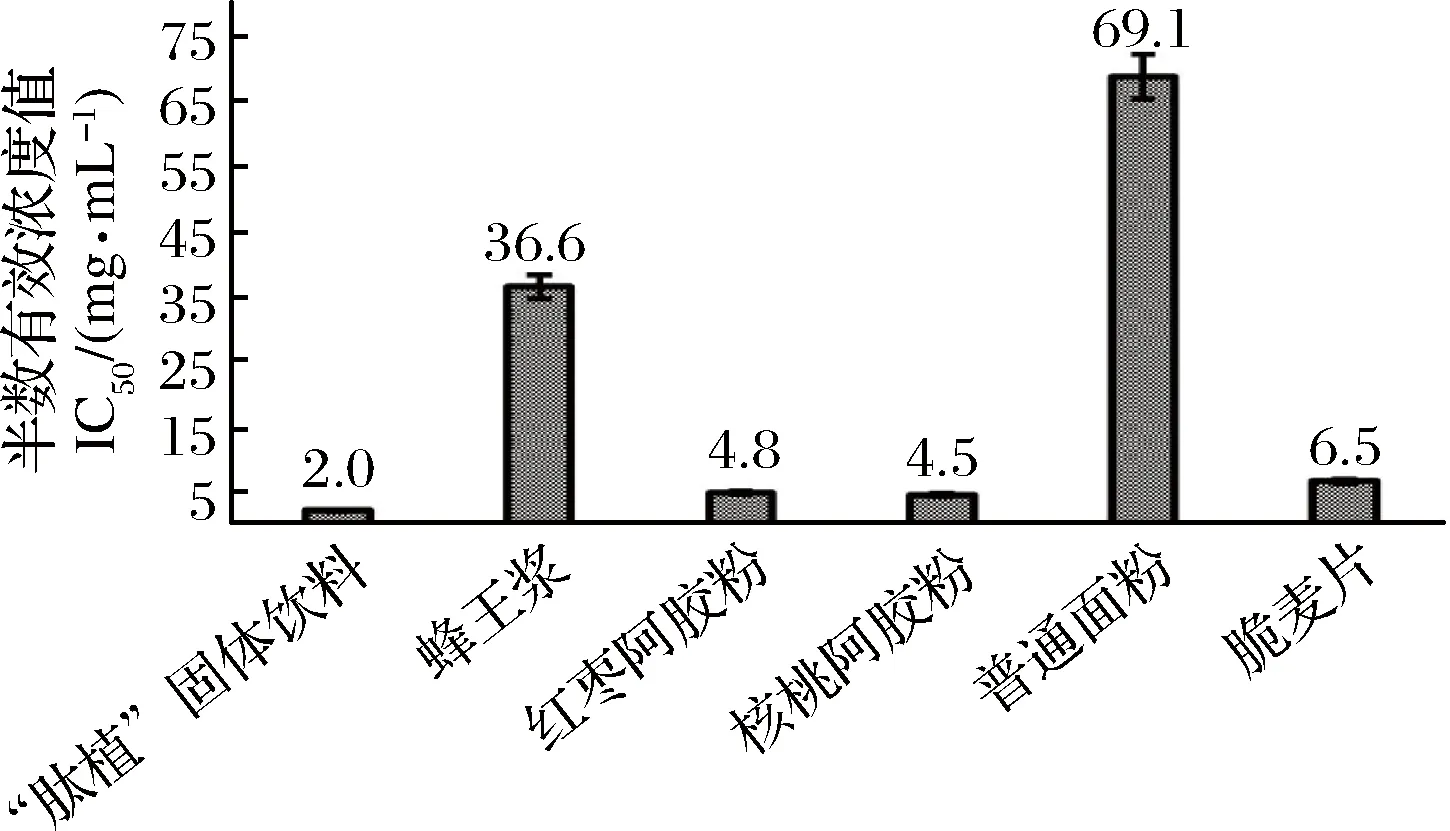
图2 DPPH自由基清除能力IC50值Fig.2 Comparison on DPPH free radical scavenging ability of different samples
2.3 细胞内TG含量测定
如图3所示,采用游离脂肪酸(FFA)诱导HepG2细胞吞噬大量脂肪酸,使得细胞TG分泌提高、胞内TG显著累积,此模型可以很好地模拟人体肝脏脂质代谢紊乱的状态。模型组(OA)细胞内TG含量明显高于正常组(对照),可以表明HepG2细胞脂肪变性模型造模成功(p<0.001);同时,各个剂量组细胞内TG含量明显比模型组低40%~50%(与模型组比较,各浓度组显著性差异p<0.001),尽管没有体现出明显的剂量依赖,但是仍表明“肽植”固体饮料可以很好地促进细胞内的TG含量达到或接近正常值。
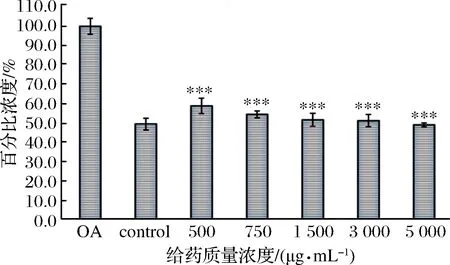
图3 不同质量浓度“肽植”固体饮料对细胞内TG含量的影响Fig.3 Intracellular TG content in each groups
2.4 “肽植”固体饮料对对乙酰氨基酚诱发的斑马鱼肝损伤的保护作用
由表1、图3和图4可知,模型对照组与正常对照组比较,斑马鱼肝脏面积、肝脏明亮度平均值和卵黄囊吸收延迟面积的显著性差异均为p<0.001,表明模型建立成功;阳性对照药NAC 1.6 μg/mL质量浓度组对斑马鱼肝变性有改善作用(改善作用64%,p<0.001),但是对斑马鱼肝脏萎缩和卵黄囊吸收延迟的改善作用不明显;“肽植”固体饮料5.6、16.7和50 μg/mL质量浓度组对斑马鱼肝脏变性均有改善作用(低剂量和中剂量组改善作用分别为65%、49%,p<0.001,高剂量组46%,p<0.01)。
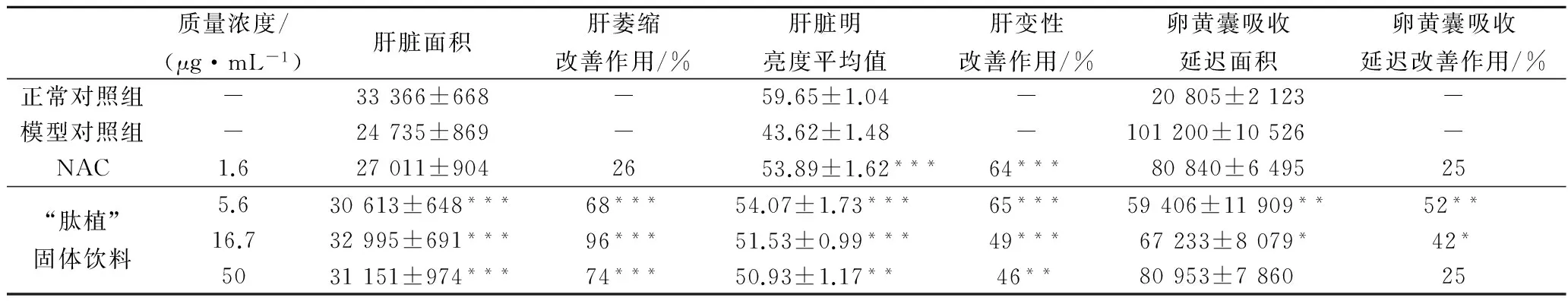
表1 “肽植”固体饮料处理后斑马鱼肝脏保护作用(n=10)
注:与模型对照组比较,*p<0.05,**p<0.01,***p<0.001。

L-肝脏;Y-卵黄囊图4 各实验组斑马鱼典型图Fig.4 Typical picture of zebrafish of the experiment groups

图5 “肽植”固体饮料处理后斑马鱼肝损伤改善作用对比图;与模型对照组比较Fig.5 The protective effect on liver of zebrafish treated by “Taizhi” solid drink注:*p<0.05;**p<0.01;***p<0.001 vs control group
3 结论
活性氧能够引起细胞的抗氧化系统失控,造成氧化胁迫和氧化损伤,而枸杞子中含有的枸杞多糖[14]、类黄酮和枸杞色素[15]等成分已经被证明具有明显的抗氧化能力;蒲公英和甘草的黄酮类物质也具有较强的清除活性氧的作用[16-17];另外,玉米低聚肽的体外抗氧化作用同样得到研究者的证实[18]。“肽植”固体饮料的主要是由枸杞子、蒲公英、甘草和玉米低聚肽等成分研制而成,本文通过抗氧化实验研究发现,此款固体饮料具有很好的抗氧化能力,能够清除人体体内的自由基,起到抗老化和保护器官的作用。GOMEZ-LECHON采用混合脂肪酸V(油酸)∶V(棕榈酸)=2∶1诱导HepG2细胞内脂肪变性的方法[19],是一种比较经典的评价脂质代谢作用的模型,本实验通过对此种评价模型实验结果的分析,可以表明“肽植”固体饮料具有很好的调控脂质代谢作用,有益于高血脂人群对甘油三酯的调节。除此之外,本文利用新型模式生物斑马鱼,通过对野生型AB品系斑马鱼肝脏形态变化和卵黄囊吸收情况的观察,可以发现 “肽植”固体饮料对对乙酰氨基酚诱发的斑马鱼肝损伤有保护作用,表现为肝脏变性程度、肝萎缩和卵黄囊吸收延迟均有明显改善。综上所述,此款“肽植”固体饮料不仅具有很好的抗氧化作用,而且能够调控脂质代谢,有利于慢性炎症类疾病(如糖尿病和心脑血管疾病)的预防和控制;同时,具有保护肝脏的作用,适合非酒精性脂肪肝和慢性肝病人群的辅助调理。
[1] 卢保健. 浅谈“药食同源”中药食品和保健品的发展[J].中外健康文摘, 2013(50): 13-14.
[2] 谭兴贵. 中医药膳学[M].北京:中国中医药出版社, 2003: 166-191.
[3] FROTECHEL M A. Bioactive peptides in digestathat regulate gastrointestinal function and intake [J]. J Anim Sci, 1996, 74(10): 2 500-2 508.
[4] 陈亮,林峰,金振涛.玉米低聚肽稳定性的研究[J].食品与发酵工业,2009,35(12): 61-65.
[5] 魏颖, 鲁军, 刘艳, 等.玉米低聚肽对HepG2细胞脂肪堆积和抗氧化活性的影响[J].食品科技, 2013(10):190-193.
[6] JOYCE P I, FRATTA P, FISHER E M, et al. SOD1 and TDP-43 animal models of amyotrophic lateral sclerosis: recent advances in understanding disease toward the development of clinical treatments [J]. Mamm Genome, 2011, 22(7/8):420-448.
[7] 施展.斑马鱼——一只游入人类新药研发领域的小鱼, [J].世界最新医学信息文摘, 2016, 16(20): 29-30.
[8] ABDELMEGEED M A, JANG S, BANERJEE A, et al. Robust protein nitration contributes to acetaminophen-induced mitochondrial dysfunction and acute liver injury [J]. Free Radic Biol Med, 2013, 60: 211-222.
[9] 张云, 彭维兵, 王希敏,等. 采用斑马鱼模型评价对乙酰氨基酚的肝脏毒性[J].药物评价研究, 2013,36(5):351-354.
[10] 吴琼, 陈丽娜, 代永刚, 等. 松仁红衣中黄酮粗提物体外抗氧化作用的研究[J].食品工业科技, 2011,(12):110-111.
[11] 王蓓蓓, 牛付阁, 段玉峰. 高良姜与大高良姜总黄酮抗氧化活性比较研究[J].食品科学, 2011, 32(7):117-120.
[12] 赵丹丹, 郑鸿雁. 多年生藤本豆与大豆中黄酮类化合物体外抗氧化活性比较研究[J].食品工业科技, 2013, 34(8):154-157.
[13] 殷锦锦, 唐外姣, 曾璐, 等. 护肝清脂片对脂肪变性肝细胞甘油三酯代谢及氧化应激水平的影响[J].时珍国医国药, 2015(3):553-555.
[14] 龚涛, 王晓辉, 赵靓, 等.枸杞多糖抗氧化作用的研究[J].生物技术, 2010,20(1):84-86.
[15] 赵萍, 吴灿军, 赵瑛,等. 枸杞色素总抗氧化能力的研究[J].食品与发酵工业, 2010,36(3):60-64.
[16] 陈景耀, 吴国荣, 王习达,等. 蒲公英黄酮类物质的抗氧化活性[J].南京师大学报自然科学版, 2005, 28(1):84-87.
[17] 吴碧华, 杨得本, 龙存国,等.甘草总黄酮的体外抗氧化作用[J]. 中国临床康复, 2004, 8(36):8 262-8 263.
[18] 刘文颖, 林峰, 金振涛, 等. 玉米低聚肽的体外抗氧化作用[J].食品科学, 2011, 32 (5) :22-26.
[19] GOMEZ-LECHON M J, DONATO M T, MARTINEZ-ROMERO A, et al.A human hepatocellular in vitro model to investigate steatosis [J].Chem Biol Interact, 2007, 165(2):106.
