芽孢皮层裂解酶的提取与SDS-PAGE分析
2018-02-28孙静贺晓光张津瑜杜文斌章中
孙静,贺晓光,张津瑜,杜文斌,章中
(宁夏大学农学院,宁夏银川750021)
芽孢的杀灭是食品杀菌的关键任务。芽孢是细菌营养体在缺乏营养的环境条件下形成的休眠态,可以休眠几万年以上而复活,对各种杀菌处理(如辐照、超高压、热、超声波、微波、化学物质等)有极强的抗性[1]。然而,当萌发条件适宜时,芽孢便迅速萌发、出芽生长,一旦其恢复到营养细胞状态便丧失了对外界胁迫的抵抗力[2-3]。许多因素能诱导芽孢萌发,如营养素、超高压、阳离子表面活性剂、机械擦伤、外源DPA、外源裂解酶、细胞壁碎片等等[4-5]。自然界中芽孢的萌发多是由一些营养类的萌发剂触发,包括氨基酸、糖类和嘌呤核苷类等,也可以由多种营养萌发剂联合触发[6]。
在芽孢萌发而转变成营养体的过程中,皮层裂解酶会将芽孢皮层肽聚糖水解,这是芽孢萌发过程中的一个重要步骤[7]。皮层裂解酶是芽孢所特有的酶,专一地水解芽孢皮层肽聚糖,在休眠的芽孢中,皮层裂解酶不表现出活性,当芽孢萌发时,皮层裂解酶会通过某种机制被激活并将皮层肽聚糖水解[8]。高压热杀菌技术(High-pressure thermal sterilization,HPTS)将压力和温度结合起来杀菌,对细菌芽孢有良好的杀灭作用[9]。有研究推测,HPTS很可能会影响皮层裂解酶的活性,在某些压力和温度条件下,皮层裂解酶可能会被激活,导致芽孢皮层水解,进而使得芽孢结构被破坏[10]。然而,要验证高压热处理是否能激活芽孢皮层裂解酶,首先要提取皮层裂解酶,测定分子量,为皮层裂解酶的分离及纯化打下基础,进而对皮层裂解酶进行HPTS处理,从而揭示HPTS杀灭芽孢的机理,阐明HPTS对皮层裂解酶结构和活性的影响。
本试验使用DPA、L-丙氨酸、肌苷等来诱导芽孢萌发,芽孢萌发后皮层裂解酶会释放到萌发液中,经透析处理,从萌发液中提取芽孢皮层裂解酶粗酶液,再进行SDS-PAGE电泳分析其分子量并测定其活性。本文对皮层裂解酶的最佳提取方法及电泳条件进行优化,建立适宜于枯草芽孢杆菌芽孢皮层裂解酶的提取条件和SDS-PAGE电泳技术,确定皮层裂解酶粗酶液中各蛋白分子量,为皮层裂解酶的进一步分离纯化提供材料和依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
枯草芽孢杆菌(Bacillus subtilis):中国普通微生物菌种保藏管理中心(CGMCC),编号As 1.433。
1.1.2 主要试剂
2,6-吡啶二羧酸(DPA):分析纯,美国 Sigma公司;L-丙氨酸、肌苷:上海瑞永生物科技有限公司;30%丙烯酰胺溶液:北京雷根生物科技有限公司;4×Tris/SDS分离胶缓冲液(pH8.8)、4×Tris/SDS浓缩胶缓冲液(pH6.8):上海双螺旋生物科技有限公司;过硫酸铵溶液、TEMED、甘氨酸:北京博奥拓达科技有限公司;宽范围预染蛋白质分子量标准:Thermo Scientific;无水乙醇、磷酸氢二钠、磷酸二氢钠:天津市大茂化学试剂厂,均为分析纯。
1.1.3 培养基
促芽孢生长锰盐营养琼脂培养基:向普通营养琼脂培养基中加入MnSO4·H2O(使得培养基中Mn2+的浓度为50 mg/L),调pH值,灭菌,备用。
1.2 仪器与设备
AL204型电子天平、FE28型pH计:梅特勒-托利多仪器(上海)有限公司;DSX-280B型高压灭菌锅:上海申安医疗器械厂;XMTD-6000型电子恒温不锈钢水浴锅:上海宜昌仪器纱筛厂;LRH系列生化培养箱:上海一恒科学仪器有限公司;GL-10C型冷冻离心机:上海安亭科学仪器厂;722型可见分光光度计:上海驰唐电子有限公司;DYCZ-24DN型电泳槽:北京六一生物科技有限公司;DYY-6C型电泳仪电源:北京市六一仪器厂。
1.3 方法
1.3.1 枯草芽孢杆菌芽孢的培养及菌悬液制备
芽孢的制备方法来自文献[11]。菌种用营养琼脂培养基活化3代以上后,接入试管斜面促芽孢生长培养基上划线培养。在37℃培养7 d后,用接种环和无菌去离子水将试管斜面上的芽孢洗涤收集到离心管里。然后用冷的无菌去离子水离心洗涤芽孢3次。离心条件为7 000 r/min、4℃、15 min。离心后将上清液和沉淀的上部一起倒掉。纯化后的芽孢重悬在无菌去离子水中,浓度约为1.5×109CFU/mL,放在4℃下保存,一个月内使用。试验前将枯草芽孢杆菌芽孢调整到1.5×108CFU/mL左右。
1.3.2 皮层裂解酶的提取[12-15]
1.3.2.1 DPA诱导芽孢萌发提取皮层裂解酶
将芽孢浓度稀释至1.5×108CFU/mL左右,将DPA浓度设定为10、15、20 mmol/L。将芽孢置于6倍体积的不同浓度萌发液中,放置于32℃的水浴锅中处理,每10 min测定一次OD600值。处理50 min后再经离心(8 000 r/min、10 min、4℃),将上清液在4℃透析处理24 h,对照液为2 L、75 mmol/L、pH值为7.0的磷酸钠缓冲液,缓冲液中含有1 mmol/L的EDTA、1 mmol/L的巯基乙酸钠。透析后的酶液进行超滤浓缩。对照组为1 mL芽孢悬浮液加入6 mL无菌水。
1.3.2.2 肌苷诱导芽孢萌发提取皮层裂解酶
将芽孢浓度稀释至1.5×108CFU/mL左右,将肌苷浓度设定为10、30、50 mmol/L。其他操作同1.3.2.1。
1.3.2.3 L-丙氨酸诱导芽孢萌发提取皮层裂解酶
将芽孢浓度稀释至1.5×108CFU/mL左右,将L-丙氨酸浓度设定为10、30、50mmol/L。其他操作同1.3.2.1。
1.3.2.4 L-丙氨酸结合肌苷诱导芽孢萌发提取皮层裂解酶
将芽孢置于6倍体积的、pH=7.0的、30 mmol/L的磷酸钠缓冲液中,缓冲液中含有10 mmol/L的L-丙氨酸和4 mmol/L的肌苷。32℃下培养,每10 min测定一次OD600值。其他操作同1.3.2.1。
1.4 电泳样品的处理
取0.8 mL浓缩后的酶液,加入0.2 mL 5×SDSPAGE蛋白上样缓冲液,混合蛋白样品和蛋白上样缓冲液(5×)。沸水浴加热5 min,以充分变性蛋白。置冰上5 min,使用前10 000 r/min离心1 min。
1.5 聚丙烯酰胺垂直板电泳
1.5.1 染色液、脱色液及电泳液的配制[16-17]
染色液:考马斯亮蓝R-250 1 g,乙醇45%,冰乙酸10%,加水定容至1 000 mL,过滤后使用。
脱色液:冰乙酸10%,乙醇30%。
5×蛋白质电泳缓冲液:Tris 15.1 g,甘氨酸94 g,SDS 5 g,用蒸馏水定容至1 000 mL,使用时用蒸馏水稀释5倍。
1.5.2 分离胶、浓缩胶的配制
按表1、表2比例分别配制10%、12%的分离胶和5%的浓缩胶[18]。

表1 5%分离胶的配制Table 1 The preparation of the 5%separation gel

表2 5%浓缩胶的配制Table 2 The preparation of the 5%spacer gel
1.5.3 电泳
SDS-PAGE参考郭尧君等[18]的方法。采用10%、12%的分离胶及5%的浓缩胶。上样量为5、10、15 μL。电泳时,在浓缩胶中电压控制为80 V,走过浓缩胶后电压调为120 V。凝胶板上的样品溴酚蓝的条带走至距底端1 cm时,停止电泳,取下凝胶,在染色器皿中加入100 mL染色液,加盖,过夜染色。脱色液脱色,每3 h换一次脱色液,脱色至染色的凝胶经脱色后能清晰显示出蛋白条带为止。
1.6 测量蛋白质分子量[19]
用卡尺测量溴酚蓝指示剂和蛋白迁移距离,计算相对迁移率(Rm)=蛋白质迁移距离/溴酚蓝指示剂迁移距离,以Rm为横坐标,标准蛋白质的分子量对数为纵坐标,进行线形回归,再由标准曲线求得目标蛋白的分子量。
1.7 皮层裂解酶活性的测定
1.7.1 脱芽孢衣芽孢的制备
脱芽孢衣芽孢的制备参照Makino[14]的研究,并做相应的修改。将枯草杆菌芽孢用30 mmol/L SDS、0.2 mol/L 2-巯基乙醇、pH=10.0、0.1 mol/L硼酸盐缓冲液在40℃下处理,处理4 h~8 h。再用冷的无菌去离子水离心洗涤5次。离心条件为7 000 r/min、4℃、15 min。洗涤后的脱芽孢衣芽孢重悬在无菌去离子水中,浓度约为 1.5×108CFU/mL。
1.7.2 酶活性的测定
在32℃下,通过测定脱芽孢衣芽孢悬浮液的OD600值的减少量来评价酶的活性[14]。取4 mL透析后的粗酶液,于32℃培育20 min,对照组为4 mL无菌水32℃下培育20 min,再向各组中加入1 mL脱芽孢衣芽孢悬浮液,在32℃下反应80 min,每10 min测一次OD600值。
1.8 数据分析方法
所有试验都重复3次,实验结果均以平均值±标准差表示。用SPSS 20.0软件对实验结果进行统计分析,用Origin 7.0软件进行作图。
2 结果与分析
2.1 不同萌发剂对枯草芽孢杆菌芽孢萌发的影响
2.1.1 DPA对芽孢萌发的影响
芽孢萌发时,其核心部分水化,导致其折光性发生变化,萌发后其OD600值显著下降,并且下降的程度与芽孢萌发率的高低有显著的相关关系,下降的程度越高,芽孢的萌发率就越高,因此芽孢悬浮液OD600值的变化被广泛的用于评价芽孢的萌发程度[20]。
DPA对芽孢萌发的影响见图1。

图1 DPA对芽孢萌发的影响Fig.1 Effect of DPA on germination of spores
从图1可知,与对照相比,加入DPA的样品OD600值均有所下降;在前30 min时,OD600值迅速降低,30 min~40 min时OD600值下降趋势减缓,而40 min~50 min时,OD600值基本不变,说明当加入DPA时,芽孢在30 min内能迅速萌发,30 min~50 min萌发速率逐渐减弱;随着DPA浓度的逐渐增大,OD600值下降程度也逐渐增大,当DPA浓度达到20 mmol/L时,OD600值下降最多,即芽孢萌发程度最大。
2.1.2 L-丙氨酸对芽孢萌发的影响
L-丙氨酸对芽孢萌发的影响见图2。

图2 L-丙氨酸对芽孢萌发的影响Fig.2 Effect of L-alanine on germination of spores
从图2可以看出,L-丙氨酸浓度为30、50 mmol/L的样品,在前40 min时OD600值迅速降低,40 min~50 min时,OD600值下降趋势减慢;而L-丙氨酸浓度为10 mmol/L的样品,OD600值在前10 min内迅速降低,10 min~50 min OD600值下降趋势逐渐减缓;说明当加入L-丙氨酸时,芽孢能在较短时间内萌发,随着时间的延长,萌发速率逐渐减弱;随着L-丙氨酸浓度的不断增大,OD600值下降趋势逐渐最大,说明芽孢的萌发程度随着L-丙氨酸浓度增大而逐渐增大。
2.1.3 肌苷对芽孢萌发的影响
肌苷对芽孢萌发的影响见图3。
由图3可以看出,在前30 min时,OD600值迅速降低,30 min~50 min时,肌苷浓度为10、30 mmol/L的样品OD600值下降趋势减缓,而肌苷浓度为50 mmol/L的样品,30 min~50 min时,OD600值仍有明显的下降趋势,但较前30 min下降趋势有所减小,说明当加入肌苷时,芽孢在30 min内能迅速萌发;随着肌苷浓度的逐渐增大,OD600值下降程度也逐渐增大,当肌苷浓度达到50 mmol/L时,OD600值下降最多,即芽孢萌发程度最大。

图3 肌苷对芽孢萌发的影响Fig.3 Effects of inosine on germination of spores
2.1.4 L-丙氨酸结合肌苷对芽孢萌发的影响
L-丙氨酸结合肌苷对芽孢萌发的影响见图4。

图4 L-丙氨酸结合肌苷对芽孢萌发的影响Fig.4 Effect of L-alanine combined with inosine on germination of spores
从图4可知,加入L-丙氨酸结合肌苷(缓冲液中含有10 mmol/L的L-丙氨酸和4 mmol/L的肌苷)的样品与对照组相比,OD600值有极显著的降低(P<0.01);随着培育时间的延长,OD600值逐渐降低,前40 min OD600值下降趋势明显,40 min~50 min时,下降趋势减弱。
对各因素诱导芽孢萌发的效果进行了差异显著性分析,DPA诱导芽孢萌发的效果显著高于其他3种芽孢萌发诱导剂(P<0.05)。因此本试验选用DPA诱导芽孢萌发来提取皮层裂解酶。
2.2 枯草芽孢杆菌芽孢皮层裂解酶粗酶SDS-PAGE电泳结果
对皮层裂解酶粗酶进行SDS-PAGE电泳分析,由于酶的浓度较低,在凝胶板上并未看到蛋白条带,将酶液进行超滤浓缩后再次进行SDS-PAGE电泳分析,结果如图5。

图5 分离胶浓度为12%的SDS-PAGE电泳图Fig.5 SDS-PAGE electrophoresis of the separation gel concentration of 12%
由图5可以看出,进样量为5 μL时,只能看到蛋白跑过的印迹,无明显可见条带,进样量为10 μL时,能大致看到蛋白条带,但条带仍不清晰,随着进样量的逐渐增大,蛋白条带逐渐清晰,增大进样量至15 μL,能看到清晰的蛋白条带;但各条带之间的距离很小,整体分离效果并不良好。
调节分离胶浓度为10%,结果如图6。

图6 分离胶浓度为10%的SDS-PAGE电泳图Fig.6 SDS-PAGE electrophoresis of the separation gel concentration of 10%
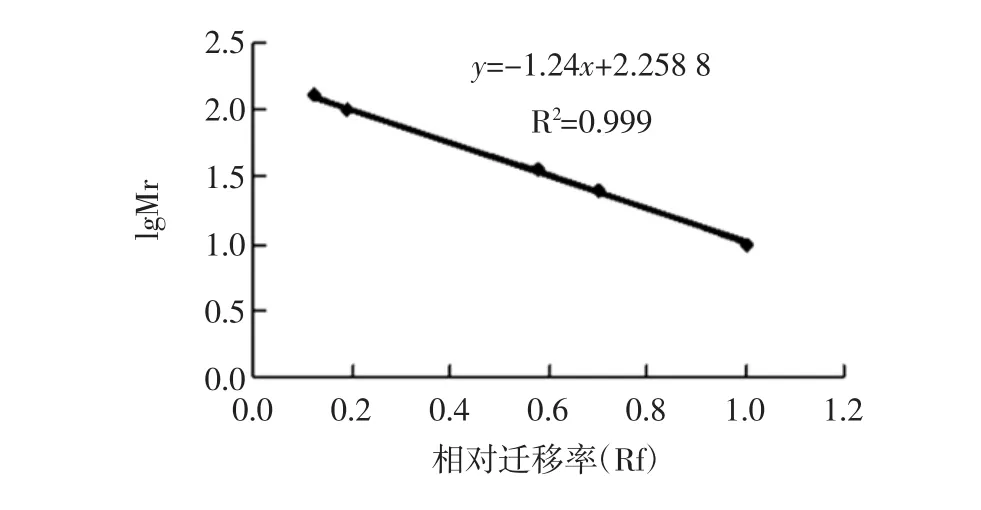
图7 蛋白质分子量标准曲线Fig.7 Standard curve of molecular weight of protein
可以看出,各蛋白条带间距明显拉开,分离效果较好。电泳时,在相对较高浓度分离胶系统中,由于凝胶孔径相对较小,样品分子的移动速度因受阻较大而减缓,迁移率就相对较低,对于较大分子量的蛋白而言,所受阻力较大,分离效果较差;在相对较低浓度分离胶系统中,由于凝胶孔径相对较大,样品分子的移动只是稍受阻碍,对于较大分子量的蛋白而言,迁移速度较快,迁移率较高,分离效果较好。从图5-c和6-c可以看出,10%与12%的凝胶系统相比,分子量为48.64 kDa和43.25 kDa的两种蛋白,在10%的凝胶系统中分离效果更好。所得的PAGE图像中有多条蛋白条带,但条带的强弱有所不同,有4条蛋白条带较为清晰,通过蛋白质分子量标准曲线(见图7)可得出,皮层裂解酶粗酶液中蛋白分子量大约分别为:61.10、48.64、43.25、31.28 kDa。Makino[14]分离纯化蜡样芽孢杆菌芽孢萌发时放出的一种皮层裂解酶,经SDS-PAGE电泳法测得皮层裂解酶分子量大约为24 kDa;Miyata[13]纯化梭状芽孢杆菌S40芽孢皮层裂解酶得到的皮层裂解酶分子量为31.0 kDa;Simon[21]在研究一种萌发专一性的巨大芽孢杆菌皮层裂解酶的纯化和性质时,纯化出的皮层裂解酶分子量为29 kDa。本试验所提取的皮层裂解酶粗酶液中,尚不能确定哪一种蛋白质为皮层裂解酶,后期将根据图6c中分离出来的4种蛋白质的分子量,选择合适的分离纯化手段,将皮层裂解酶进一步分离纯化出来。
2.3 酶活性的测定
为确定所提取到的粗酶液中确实含有皮层裂解酶,检测了粗酶液的皮层裂解活性,结果如图8所示。
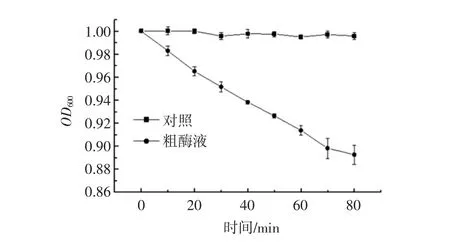
图8 酶活性的测定Fig.8 Determination of enzyme activity
与对照相比,加入粗酶液的脱芽孢衣芽孢悬浮液的OD600值有极显著下降(P<0.01),说明粗酶液中含有皮层裂解酶,但具体哪种分子量的蛋白质为皮层裂解酶还需进一步的分离纯化和鉴定。本文的试验结果可为进一步分离纯化皮层裂解酶提供基础。
3 结论
通过研究发现:DPA、L-丙氨酸、肌苷及L-丙氨酸结合肌苷对枯草芽孢杆菌芽孢均有诱导萌发的作用。DPA诱导枯草芽孢杆菌芽孢萌发效果最好,很低浓度的DPA就能迅速诱导芽孢萌发。提取出的皮层裂解酶粗酶液经透析、超滤浓缩后进行SDS电泳,进样量从5 μL 逐渐增大到 15 μL,当进样量增大至 15 μL 时,在凝胶板上能看到清晰的蛋白条带;10%的凝胶系统上的条带较12%的相比,各条带间距更大,整体分离效果更好,因此选择10%的分离胶浓度更为合适。通过蛋白质分子量标准曲线可得出,皮层裂解酶粗酶液中蛋白分子量大约分别为:61.10、48.64、43.25、31.28 kDa,可根据以上试验结果选择进一步分离纯化皮层裂解酶的手段和条件。
[1] 章中,杨宏伟,胡济美,等.化学物质辅助超高压处理对枯草杆菌芽孢的作用[J].中国食品学报,2015,15(5):47-53
[2]YASUDA Y,TOCHIKUBO K.Spore Germination and Outgrowth[J].Journal of Antibacterial&Antifungal Agents Japan,1997,25:333-348
[3] 程琴,黄庶识,陈丽梅.芽孢杆菌孢子萌发机理的研究进展[J].生命科学,2010(9):878-885
[4]SHAH I M,LAABERKI M H,POPHAM D L,et al.A eukaryoticlike Ser/Thr kinase signals bacteria to exit dormancy in response to peptidoglycan fragments[J].Cell,2008,135:486-496
[5]章中.热和化学因素辅助超高压对枯草杆菌芽孢的灭活研究[D].北京:中国农业大学,2013
[6] 高志奇,刘先凯,王恒樑.炭疽芽孢杆菌芽孢萌发研究进展[J].军事医学科学院院刊,2014(10):833-836
[7] MAKINO S,MORIYAMA R.Hydrolysis of cortex peptidoglycan during bacterial spore germination.[J].Medical Science Monitor International Medical Journal of Experimental&Clinical Research,2002,8(8):RA119-127
[8]BLACK E P,SETLOW P,HOCKING A D,et al.Response of spores to high-pressure processing[J].Comprehensive Reviews in Food Science and Food Safety,2007,6(4):103-119
[9] ZHANG Z,JIANG B,LIAO X,et al.Inactivation of Bacillus subtilis spores by combining high-pressure thermal sterilization and ethanol[J].International Journal of Food Microbiology,2012,160(2):99-104
[10]REINEKE K,MATHYS A,HEINZ V,et al.Mechanisms of endospore inactivation under high pressure[J].Trends in Microbiology,2013,21(6):296-304
[11]GAO Y L,JU X R,JIANG H H.Studies on inactivation of Bacillus subtilis spores by high hydrostatic pressure and heat using design of experiments[J].Journal of Food Engineering,2006,77(3):672-679
[12]GOMBAS D E,LABBE R G.Extraction of spore-lytic enzyme from Clostridium perfringens spores[J].Journal of General Microbiology,1981,126(1):37-44
[13]MIYATA S,MORIYAMA R,SUGIMOTO K,et al.Purification and partial characterization of a spore cortex-lytic enzyme of Clostridium perfringens S40 spores[J].Bioscience Biotechnology&Biochemistry,1995,59(59):514-515
[14]MAKINO S,ITO N,INOUE T,et al.A spore-lytic enzyme released from Bacillus cereus spores during germination[J].Microbiology,1994,140(2):1403-1410
[15]王一晓.热和化学物质最佳诱导枯草杆菌芽孢萌发条件的研究[D].银川:宁夏大学,2016
[16]黄体冉,张国庆,王文平,等.SDS-聚丙烯酰氨凝胶电泳法测定蛋白质相对分子质量的改良和优化[J].高校实验室工作研究,2016(3):63-66
[17]谢喜珍,林娟,谢勇,等.海洋来源琼胶酶的分离纯化及酶学性质研究[J].中国生物工程杂志,2017,37(1):46-52
[18]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,2005:186-189
[19]伊金玲.产甲壳素酶菌株HD002的筛选鉴定、发酵条件优化、酶的分离纯化及酶学性质研究[D].青岛:中国海洋大学,2010
[20]MINH H N T,DANTIGNY P,PERRIER-CORNET J M,et al.Germination and inactivation of Bacillus subtilis,spores induced by moderate hydrostatic pressure[J].Biotechnology&Bioengineering,2010,107(5):876-83
[21]FOSTER S J,JOHNSTONE K.Purification and properties of a germination-specific cortex-lytic enzyme from spores of Bacillus megaterium KM.[J].The Biochemical Journal,1987,242(2):573-579
