多酚黄酮物质对晚期糖基化终产物的抑制研究
2018-02-28周凯文陈晓默刘慧琳王静
周凯文,陈晓默,刘慧琳,王静
(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京100048)
晚期糖基化终产物(Advanced glycation end products,AGEs)是食品加工和贮藏过程中美拉德反应产生的一类不可逆产物。大量的临床和动物实验表明,AGEs在人体内的积累与糖尿病及其并发症的产生有着密切的联系[1-2]。因此,近年来,关于AGEs的抑制研究成为医学研究的热点,相关研究证明了抑制剂如氨基胍在体内可显著减少蛋白的糖基化,在很大程度上能够减缓糖尿病及其并发症的发生[3],但Ⅲ期临床试验中发现氨基胍会导致机体的不良反应而使其无法应用于临床实践。因此天然产物对AGEs的抑制作用逐渐受到科研工作者的关注,且不断有新的研究证明,一些天然产物提取物对AGEs有较好的抑制效果,例如,肉桂树皮中的活性组分儿茶素、表儿茶素和原花青素B2对AGEs有较高的抑制活性[4],黄芪中分离出的黄芪皂苷和三萜系化合物同样能够抑制羧甲基赖氨酸(Nε-carboxymethyllysine,CML)的形成[5]。
甲基乙二醛(methylglyoxal,MGO)是美拉德反应的一个重要中间产物。在生理条件下,MGO能够不可逆地修饰蛋白质生成AGEs,从而使蛋白质的结构发生变化导致蛋白质的功能紊乱[6]。因此可以通过捕获MGO来抑制AGEs的产生。而Yoon等学者也证明了鱼腥草中的多酚类物质可以通过捕获MGO来抑制AGEs[7]。Lo C Y等发现绿茶中的黄烷酮类化合物在模拟体系中可以有效清除MGO从而能够有效的抑制AGEs[8]。
本文研究了来自不同食品原材料或者食源性药材中的多酚黄酮类化合物对模拟体系中AGEs的抑制效果,通过对AGEs的荧光产物和非荧光产物CML的抑制效果进行评价,探究这些物质与MGO的加和反应以及可能生成的加和产物,为天然性药物的开发与使用奠定理论基础。
1 材料与方法
1.1 材料与试剂
氨基胍:北京半夏生物科技有限公司;茶多酚、儿茶素、大豆异黄酮、染料木素、大豆黄素、原花青素、木犀草素、没食子酸、白藜芦:上海源叶生物科技有限公司;福林酚试剂、甲醇、β-巯基乙醇、浓硫酸、苯酚、盐酸、氨水:北京化工厂;牛血清白蛋白、葡萄糖、碳酸钠、丙酮、氢氧化钠、四硼酸钠、Nα-乙酰基-L-赖氨酸、硼酸钠、硼酸、硼氢化钠、三氯乙酸:国药集团化学试剂有限公司;以上试剂均为分析纯;甲醇、乙腈、乙酸、三氟乙酸(色谱纯):北京百灵威科技有限公司。
1.2 仪器和设备
3K15高速冷冻离心机:德国Sigma Laborzentrifugen GmbH;BioTek Synergy H1MDG多功能酶标仪:美国 BioTek Instruments,Inc.;UGC-24M 氮吹仪:北京优晟联合科技有限公司;UN30Plus精密强制对流干燥箱:中豪莱伯科技有限公司;HH-2恒温水浴锅:金坛市杰瑞尔电器有限公司;酒精喷灯:济南鲁盈化工有限公司;KQ-700GVDV多用途恒温超声清洗仪:昆山市超声波清洗器;AL203电子分析天平:瑞士METTLER TOLEDO;SHB-Ⅲ循环水式多用真空泵:郑州长城科工贸有限公司;Starter2000pH计:美国奥豪斯(上海)有限公司;G9821A紫外-可见分光光度计、Agilent LC-MS:美国安捷伦公司;岛津液相LC-20(紫外检测器):日本岛津公司。
1.3 方法
1.3.1 牛血清白蛋白-葡萄糖模拟体系的制备
分为空白组、氨基胍阳性对照组,茶多酚、儿茶素、大豆异黄酮、染料木素、大豆黄素、原花青素、木犀草素、没食子酸和白藜芦醇试验组。磷酸盐缓冲液(phosphate buffer,PB)(0.1 mol/L,pH12)溶解牛血清白蛋白(Bovine serum albumin,BSA)和葡萄糖(Glucose,Glu)[9],并定容至100 mL,使BSA和Glu浓度分别为10 mg/mL和500 mmol/L,分装于5 mL密封耐高压高温玻璃管中,5 mL/管,其中氨基胍、儿茶素、染料木素、大豆黄素、原花青素、木犀草素、没食子酸和白藜芦醇1 mmol/L,茶多酚、大豆异黄酮2.5 mg/mL的量将抑制剂加入到玻璃管中,拧紧管盖,100℃水浴加热40 min,反应结束后立即取出置于冰水浴冷却待测,4℃下保存待测。
1.3.2 模拟体系中AGEs的测定
1.3.2.1 模拟体系中荧光产物的测定
将空白组反应混合物在荧光激发波长为380 nm,发射波长为450 nm进行荧光光谱检测,记录模拟体系反应混合物的荧光强度,所有检测均做3次平行。其中荧光产物抑制率的计算公式为:

式中:A1为空白组的荧光强度;A2为加入抑制剂后的荧光强度。
1.3.2.2 模拟体系中非荧光产物CML的测定
参考Assar等[10]的方法并做适当的修改,取一定量的1.3.1中反应后的样品,加入硼酸钠缓冲溶液(0.5 mol/L,pH9.2)混合至最后的缓冲液浓度为0.2 mol/L,然后加入硼氢化钠溶液(1 mol/L,0.1 mol/L NaOH配制)至最后硼氢化钠溶液的浓度为0.1 mol/L,样品在4℃下还原10 h;还原反应结束后,向样品中加入60%的三氯乙酸使样品中的最终浓度为20%,10 000 r/min 4℃下离心分离10 min以沉淀蛋白质,获得的蛋白质用丙酮洗涤2次,将蛋白中剩余的丙酮吹干;向沉淀的蛋白加入1 mL6 mol/L的盐酸110℃下水解24 h,然后用氮气吹干。将干燥的蛋白质水解物重新溶入2 mL水中,用固相萃取柱除杂[具体操作:PCX固相萃取柱预活化(依次通过3 mL甲醇和3 mL水)[11],取复溶的样品溶液通过预活化了的PCX固相萃取柱,然后分别用3 mL水和3 mL甲醇冲洗,最后目标化合物通过5 mL的甲醇(5%的氨水)洗脱],最后洗脱液用氮气吹干,吹干后的样品重新溶于2 mL水中,然后通过0.45 μm滤膜过滤后用高效液相色谱质谱联用仪(High performance liquid chromatography tandem mass spectrometry,HPLC-MS/MS)测定反应体系中CML的含量,所有样品均做3次平行试验。
1.3.2.3 HPLC-MS/MS检测CML的条件
高效液相色谱条件:色谱柱:Inertsil ODS-SP(4.6 mm×150 mm,5 μm);流动相 A:0.1%三氟乙酸水溶液[12],B:乙腈(Acetonitrile,ACN);流速 0.2 mL/min;进样量 10 μL。梯度洗脱条件为:0~0.5 min(90%A),0.5 min~4.0 min(90%A~60%A)[13];柱温:30 ℃;运行时间:25 min。
质谱条件:ESI离子源;多反应监控模式(Multiple reaction monitoring,MRM);离子源温度 300℃;锥孔电压1.03×105Pa;毛细管电压4 kV;MRM模式的设置:m/z205.0→m/z84.0[14]。
1.3.3 模拟体系中反应前后可用赖氨酸的测定
苯二醛试剂(现配现用)[9,15]:将 0.1 mol/L 的硼酸缓冲液(pH9.5,50 mL),β-巯基乙醇(0.2 mL)和邻苯二甲醛(o-phthalaldehyde,OPA)(80 mg溶于2 mL甲醇)混合,去离子水定容至100 mL。将1mL样品溶液和3 mL OPA试剂混合,立即放置于暗处室温静置5 min,然后检测荧光强度(以OPA作为空白溶液)。标准曲线通过不同浓度(10 μmol/L~1 000 μmol/L)的 Nα-乙酰基-L-赖氨酸测得。结果用可用赖氨酸的剩余量来表示(未经加热处理的对照组的可用赖氨酸的量为起始量)。
1.3.4 模拟体系中反应前后还原糖的测定
将100 μL稀释样品置于玻璃瓶中,加入300 μL浓硫酸和60 μL5%苯酚,90℃保温5 min,迅速冷却到室温静置5 min。取200 μL反应液加入到96孔板中在490 nm下检测吸光度。标准曲线通过不同浓度葡萄糖(5 μg/孔~40 μg/孔)的检测制得[16]。
1.3.5 多酚黄酮类物质对MGO捕获研究
1.3.5.1 MGO反应模型的制备
取不同的多酚和黄酮类化合物(1 mmol/L)与甲基乙二醛(methylglyoxal,MGO)(3 mmol/L)在磷酸缓冲液中混合,100℃下加热40 min,然后取200 μL反应液加入1 μL的醋酸溶液以终止反应,每个样品中加入200 μL邻苯二胺(100 mmol/L)用于对剩余MGO的衍生化,氨基胍作为阳性对照[17]。反应结束后使用固相萃取(Solid phase extraction,SPE)技术进行除杂,取预活化(3 mL甲醇和3 mL超纯水)过的C18固相萃取柱上样,然后用3 mL水冲洗,而后用2 mL甲醇洗脱收集,过0.45 μm膜后待测。
1.3.5.2 HPLC-MS/MS检测MGO的条件
色谱条件为色谱柱:InertsilODS-4(4.6mm×150mm,5 μm);流动相 A:0.2%乙酸,90%水,10%甲醇,流动相B:0.2%乙酸和100%甲醇;梯度洗脱顺序:0~1.5 min,0%~20%B;1.5min~2.5 min,20%~35%B;2.5 min~4.5 min,35%~100%B;4.5 min~5.5 min,100%B;5.5 min~5.6 min,100%~0%B,5.6 min~7.0 min,0%B,进样量 5 μL,流速 0.5 mL/min[18]。
质谱条件:ESI离子源;多反应监控模式(MRM);离子源温度300℃;锥孔电压1.03×105Pa;毛细管电压4 kV;Scan模式扫谱和单离子模式捕获(Single ion monitoring,SIM)。
1.4 数据处理
采用spss20软件处理数据,以Excel2007软件绘图。显著性分析P<0.01表示差异极显著,P<0.05表示差异显著,每组数据均进行3次平行试验取平均值。
2 结果与讨论
2.1 多酚和黄酮类化合物对模拟体系中AGEs荧光产物的抑制
多酚和黄酮类化合物对模拟体系中AGEs荧光产物的抑制效果见图1。
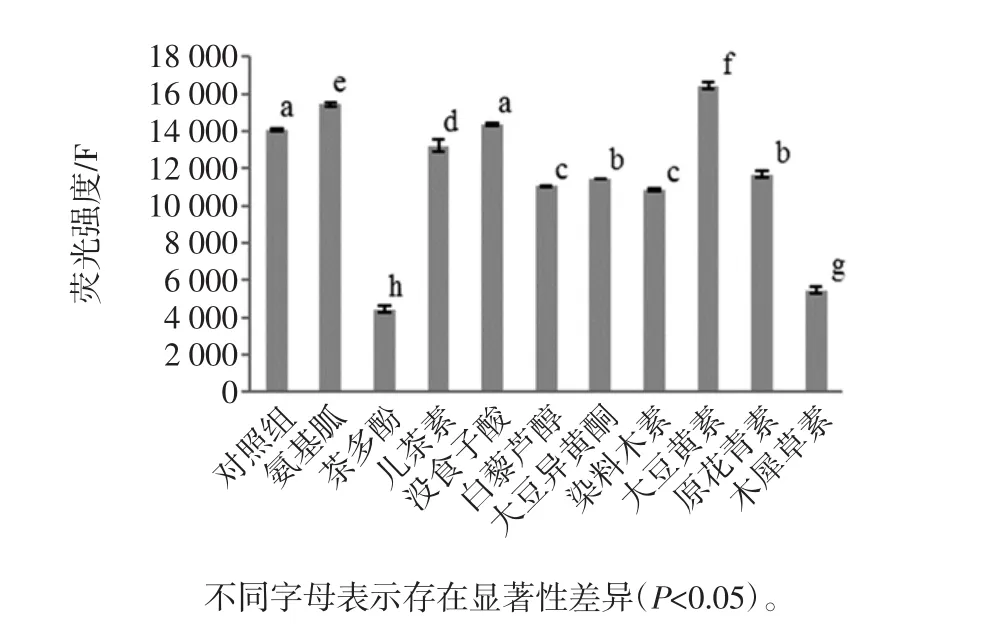
图1 多酚和黄酮类化合物抑制模型组中荧光产物的生成量Fig.1 The fluorescence generation in the inhibition model group of polyphenols and flavonoids
从图1中可以看出,茶多酚和木犀草素对AGEs荧光产物的抑制效果是最明显的,其中对荧光产物的抑制率茶多酚达到了68.52%,木犀草素达到了61.19%。没食子酸和大豆黄素对AGEs荧光产物基本没有抑制效果,白藜芦醇和染料木素对AGEs荧光产物的抑制效果没有显著性差异,抑制率分别为21.54%和23.03%(P<0.05),大豆异黄酮和原青花素组对AGEs荧光产物的抑制效果没有显著性差异,抑制率分别为18.73%和17.17%。而阳性对照组氨基胍在碱性环境中对荧光产物的生成没有抑制效果,氨基胍抑制荧光产物的作用原理是在Amadori重排产物形成葡萄糖-蛋白质衍生的交联产物之前与Amadori重排产物氨基酮竞争性结合成无活性的替代性Amadori产物[19],而在碱性环境下不利于氨基胍和氨基酮的结合,而荧光产物主要是由Amadori重排产物衍生出的交联产物,因此环境中氨基胍对AGEs中荧光产物没有抑制效果。
2.2 多酚和黄酮类化合物对模拟体系中非荧光产物CML的抑制
多酚和黄酮类化合物对模拟体系中非荧光产物CML的抑制效果见图2。
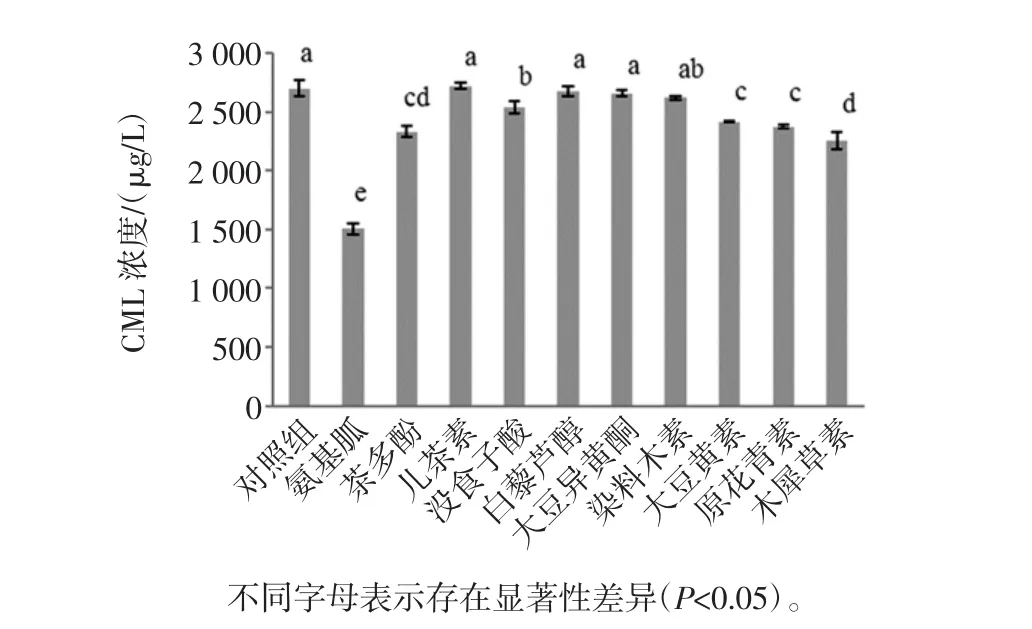
图2 多酚和黄酮类物质抑制模型组中CML的生成量Fig.2 The CML generation in the inhibition model group of polyphenols and flavonoids
从图2中可以看出,儿茶素、白藜芦醇、大豆异黄酮和染料木素组对CML基本没有抑制效果,与对照组相比没有显著性差异(P>0.05),此外没食子酸对CML的抑制效果较差,抑制率仅为6%,其他几组包括阳性对照组氨基胍对CML都有不同程度的抑制效果,其中大豆黄素和原花青素组对CML的抑制效果没有显著性差异,抑制率分别为10.52%、12.08%,茶多酚和木犀草素组对CML的抑制效果较好,抑制率分别为13.67%、16.52%。
比较图1和图2可知,茶多酚和木犀草素对AGEs中荧光产物和对CML的抑制较其他活性物质效果好。而白藜芦醇、染料木素和大豆异黄酮对荧光产物的抑制效果较好,但是对CML基本没有抑制效果,这说明白藜芦醇、染料木素和大豆异黄酮中的活性物质可能参与到了Amadori重排产物衍生成交联荧光产物的过程,而没有参与到席夫碱裂解成活性羰基继而和赖氨酸(Lysine,Lys)生成CML的过程、以及葡萄糖自氧化生成CML的过程。相反的,大豆黄素对CML有显著性抑制效果,但是对荧光产物没有抑制效果,这说明大豆黄素可能不参与Amadori重排产物衍生成荧光交联产物的过程。比较染料木素和大豆异黄酮对AGEs中荧光产物和CML的抑制效果以及大豆黄素对两者的抑制效果可以看出,在大豆异黄酮中对AGEs产生抑制效果的活性物质主要为染料木素而非大豆黄素。比较茶多酚组和儿茶素组对荧光产物和CML的抑制效果可以看出,茶多酚中对AGEs产生抑制效果的活性物质中儿茶素所占比例较小。此外,值得关注的是,葡萄籽提取物原花青素以及存在与许多中药材和许多蔬菜中的木犀草素对AGEs中荧光产物和CML都有较显著的抑制效果,这些从天然食物或者药材中提取的活性物质有很大的潜力用于替代氨基胍等一些存在副作用的药物。
2.3 不同抑制模拟体系中赖氨酸含量的变化
不同抑制模拟体系中赖氨酸含量的变化见图3。

图3 多酚和黄酮类物质抑制模型组中可用赖氨酸残基含量Fig.3 Available lysine residues in the inhibition model group of polyphenols and flavonoids
图3中可以看出,大豆异黄酮组的游离氨基量较大,说明糖基化程度较低,氨基胍、白藜芦醇和染料木素组的糖基化反应程度最高,差异不显著(P>0.05)。从多酚和黄酮类物质抑制模型组中的荧光产物和CML的生成量与反应后可用赖氨酸的剩余量可知,抑制模型组中AGEs荧光产物与CML的生成量和可用赖氨酸的量没有必然的联系,对AGEs有较好抑制效果的茶多酚和木犀草素中赖氨残基的剩余量也较少,有可能是这些活性物质通过与赖氨酸残基发生反应来抑制葡萄糖对蛋白质的糖基化从而达到对AGEs的抑制作用。
2.4 不同抑制模拟体系中还原糖含量的变化
不同抑制模拟体系中还原糖含量的变化见图4。

图4 多酚和黄酮类物质抑制模型组中还原糖剩余含量Fig.4 Reducing sugar content in the inhibition model group of polyphenols and flavonoids
图4中可以看出,参与反应的活性羰基主要来自于原料中的还原糖。还原糖消耗最多的为茶多酚和没食子酸组,而还原糖消耗最少的为大豆异黄酮组,这一点与可用赖氨酸的消耗规律相似,抑制模型组中AGEs荧光产物与CML的生成量和剩余还原糖的量没有必然的联系。
2.5 多酚黄酮类化合物对MGO的捕获
原花青素单体在280 nm的扫描图如图5所示,图6是原花青素和MGO的加和产物的液相谱图和质谱图。

图5 原花青素的液相扫描图Fig.5 Procyanidins liquid chromatogram and mass spectra
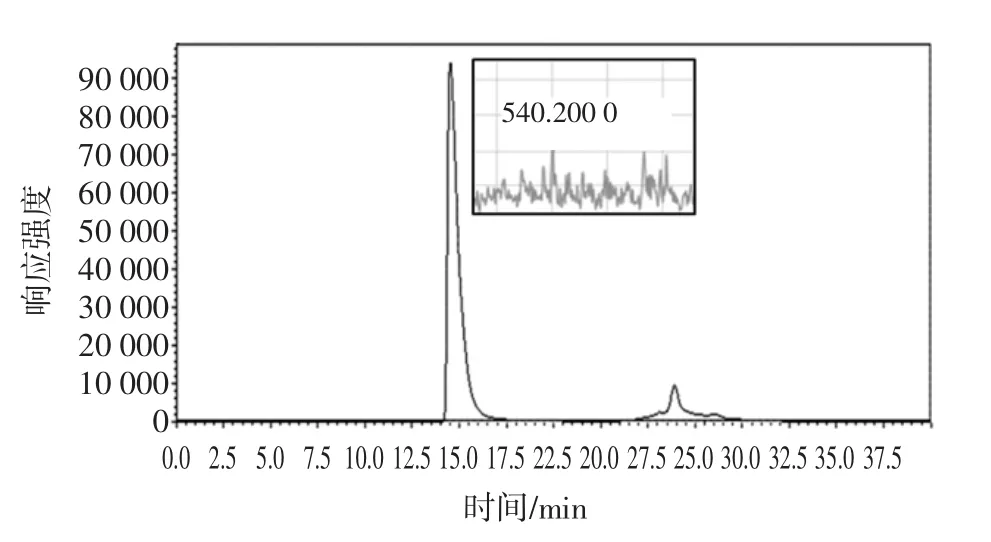
图6 原花青素加合物的液相色谱图和质谱图Fig.6 The liquid chromatogram and mass spectra of procyanidins adducts
已知原花青素的分子量为468.42,而MGO的分子量为72.06,从图中可以看出,540.2为原花青素和MGO的单加合物,而613.1为原花青素和MGO的双加合物,类似的,其他多酚和黄酮类物质通过Scan或SIM模式捕获到了单加合物和双加合物。
多酚和黄酮类物质和MGO可能存在的加和产物的结构图见表1。
通过LC-MS/MS可以检测到不同多酚黄酮类物质和MGO都存在加合产物,有研究表明,抑制剂可以通过捕获MGO来抑制AGEs的含量,并且效果显著[7-8],文中选取的多酚黄酮类物质可以和MGO生成加合产物,但是除了木犀草素和茶多酚以外对AGEs的抑制效果并不是很显著,可能是因为对MGO的清除率不高或者因为高温条件下发生热降解。
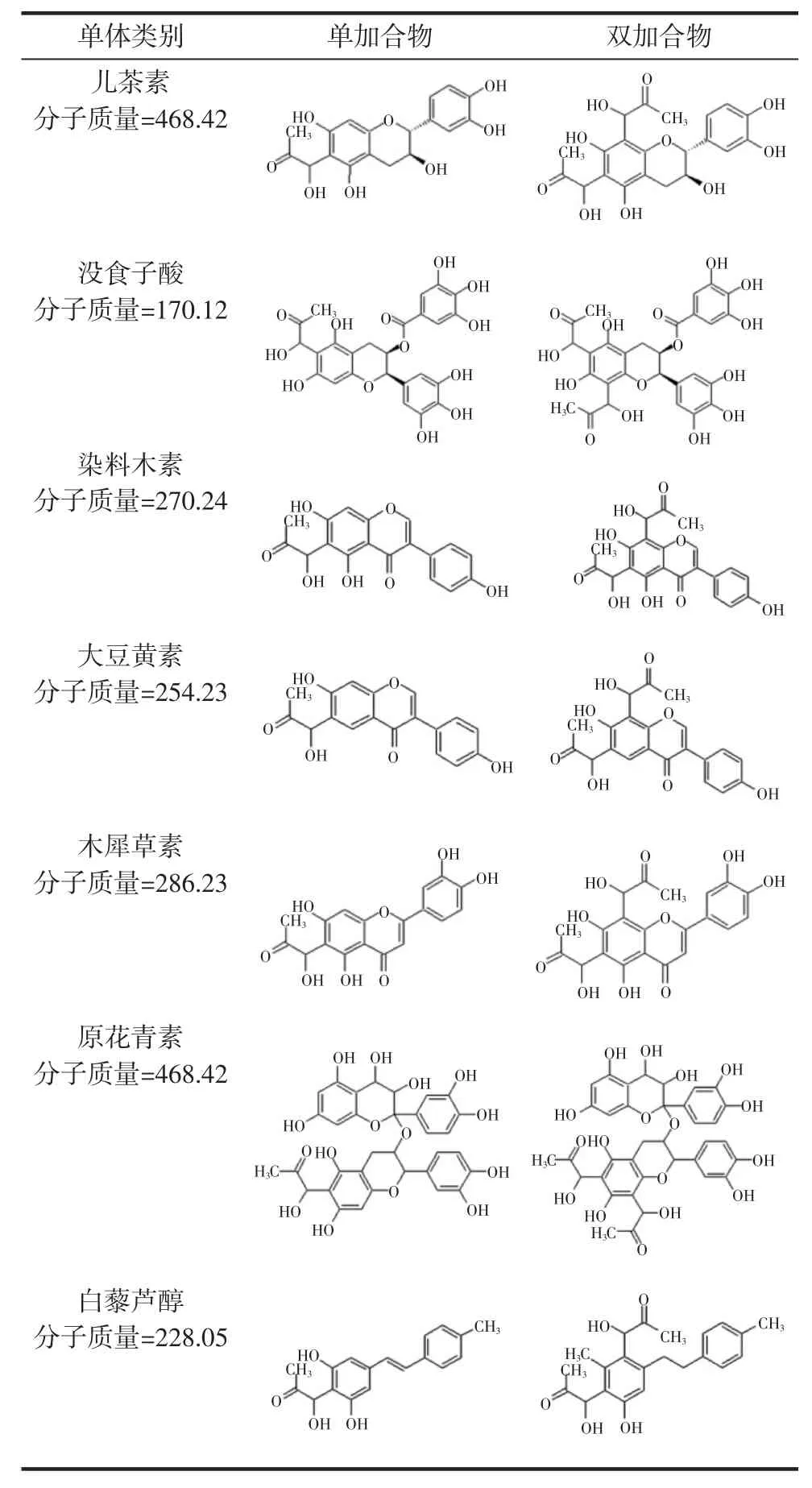
表1 多酚和黄酮类物质和MGO可能存在的单双加合物Table 1 The possible structures of the flavonids and polyphenols adduct
狭义的黄酮结构和广义的黄酮结构见图7。

图7 狭义黄酮(a)和广义黄酮(b)的结构Fig.7 The structure of special flavonoids(a)and general flavonoids(b)
研究表明,黄酮的5号位和7号易受到亲核攻击,有研究人员提出,苯环上有羟基取代时,其临位比间位和对位更易受到亲核攻击[20],因此黄酮类衍生物A环只有7号位或5号位有羟基代基时,最容易发生亲核加成的位置是6号位或者8号位,当7号位和5号位同时有羟基取代时,6号位最先发生加合反应;A环中的活性位置除了6号位其次是8号位。
3 结论
本课题从食物和天然药材提取物中选取了一些有代表性的多酚和黄酮类化合物,将其应用于美拉德反应过程中AGEs的抑制研究。多酚黄酮类化合物对AGEs中荧光产物的抑制实验表明,茶多酚和木犀草素对荧光产物的抑制效果是最明显的,其中茶多酚达到了68.52%,木犀草素达到了61.19%。多酚黄酮类化合物对CML的抑制实验表明儿茶素、白藜芦醇、大豆异黄酮和染料木素组对CML基本没有抑制效果,茶多酚和木犀草素的抑制效果较好,抑制率为13.67%、16.52%。综上,来自于茶叶的提取物茶多酚、同时存在与中草药、花生粕等许多植物中的木犀草素对AGEs有一定的抑制作用,有很大潜力被开发利用来代替氨基胍等有副作用的药物成为AGEs的抑制剂。
[1] Uribarri J,Cai W,Sandu O,et al.Diet-Derived Advanced Glycation End Products Are Major Contributors to the Body's AGE Pool and Induce Inflammation in Healthy Subjects[J].Annals of the New York Academy of Sciences,2005,1043(1):461-466
[2] Vlassara H,Palace M R.Diabetes and advanced glycation endproducts[J].Journal of internal medicine,2002,251(2):87-101
[3] Ulrich P,Cerami A.Protein glycation,diabetes,and aging[J].Recent progress in hormone research,2000,56:1-21
[4] Peng X,Cheng K W,Ma J,et al.Cinnamon bark proanthocyanidins as reactive carbonyl scavengers to prevent the formation of advanced glycation endproducts[J].Journal of agricultural and food chemistry,2008,56(6):1907-1911
[5] Mildner-Szkudlarz S,Siger A,Szwengiel A,et al.Natural compounds from grape by-products enhance nutritive value and reduce formation of CML in model muffins[J].Food Chem,2015,172:78-85
[6] Riley M L,Harding J J.The reaction of methylglyoxal with human and bovine lens proteins[J].Biochimica et Biophysica Acta(BBA)-Molecular Basis of Disease,1995,1270(1):36-43
[7] Yoon S R,Shim S M.Inhibitory effect of polyphenols in Houttuynia cordata on advanced glycation end-products(AGEs)by trapping methylglyoxal[J].LWT-Food Science and Technology,2015,61(1):158-163
[8] Lo C Y,Li S,Tan D,et al.Trapping reactions of reactive carbonyl species with tea polyphenols in simulated physiological conditions[J].Molecular nutrition&food research,2006,50(12):1118-1128
[9] Manuel Silvan J,Srey C,Ames J M,et al.Glycation is regulated by isoflavones[J].Food&Function,2014,5(9):2036-2042
[10]Assar S H,Moloney C,Lima M,et al.Determination of Nε-(carboxymethyl)lysine in food systems by ultra performance liquid chromatography-mass spectrometry[J].Amino acids,2009,36(2):317-326
[11]Sun X,Tang J,Wang J,et al.Formation of advanced glycation endproducts in ground beef under pasteurisation conditions[J].Food Chem,2015,172:802-807
[12]Yoon S-R,Shim S-M.Inhibitory effect of polyphenols in Houttuynia cordata on advanced glycation end-products(AGEs)by trapping methylglyoxal[J].LWT-Food Science and Technology,2015,61(1):158-163
[13]Assar S H,Moloney C,Lima m,et al.Determination of Nepsilon-(carboxymethyl)lysine in food systems by ultra performance liquid chromatography-mass spectrometry[J].Amino acids,2009,36(2):317-326
[14]Zhang G,Huang G,Xiao L,et al.Determination of advanced glycation endproducts by LC-MS/MS in raw and roasted almonds(Prunus dulcis)[J].J Agric Food Chem,2011,59(22):12037-12046
[15]Goodno C C,Swaisgood H E,Catignani G L.A fluorimetric assay for available lysine in proteins[J].Analytical biochemistry,1981,115(1):203-211
[16]Yoon S-R,Shim S-M.Inhibitory effect of polyphenols in Houttuynia cordata on advanced glycation end-products(AGEs)by trapping methylglyoxal[J].LWT-Food Science and Technology,2015,61(1):158-163
[17]Lv L,Shao X,Chen H,et al.Genistein inhibits advanced glycation end product formation by trapping methylglyoxal[J].Chemical research in toxicology,2011,24(4):579-586
[18]Yoon S-R,Shim S-M.Inhibitory effect of polyphenols in Houttuynia cordata on advanced glycation end-products(AGEs)by trapping methylglyoxal[J].LWT-Food Science and Technology,2015,61(1):158-163
[19]Furlani R E,Richardson M A,PODELL B K,et al.Second generation 2-aminoimidazole based advanced glycation end product inhibitors and breakers[J].Bioorganic&Medicinal Chemistry Letters,2015,25(21):4820-4823
[20]Plochmann K,Korte G,Koutsilieri E,et al.Structure-activity relationships of flavonoid-induced cytotoxicity on human leukemia cells[J].Archives of Biochemistry and Biophysics,2007,460(1):1-9
