花生粕酵解物及其美拉德产物的抗氧化性能分析
2018-02-28崔燕玲张慧敏袁杨曾庆祝
崔燕玲,张慧敏,袁杨,曾庆祝
(广州大学化学化工学院,广东广州510006)
花生仁经过压榨提炼油脂后得到的产物叫花生粕,其粗蛋白质含量达48%以上,具有丰富的营养,含有多种氨基酸,尤其是甲硫氨酸和精氨酸的含量相当高,高达14.8%和5.2%[1],具有良好的抗氧化作用[2]。近年来,利用发酵或酶解的方法分解花生粕蛋白制备抗氧化肽的研究成为热点[3-5],然而不同水解方法对花生粕蛋白水解程度不同,不能准确地得到某种抗氧化肽。这类抗氧化肽抗氧化性不稳定,而且储存稳定性差,容易被破坏,难以实现工业化大量生产。因此,利用这类多肽和氨基酸合成具有抗氧化性的物质具有现实意义。
法国化学家L C Maillard在1912年发现甘氨酸和葡萄糖混合加热的时候形成褐色物质,人们将此类反应命名为美拉德反应(Maillard reaction),又称为非酶褐变反应。所谓美拉德反应是广泛存在于食品工业的一种非酶褐变,是羰基化合物和氨基化合物间的反应,经过复杂的历程,最终生成棕色甚至是黑色的大分子物质类黑精或称拟黑素,因此又称羰氨反应[6]。研究发现,在啤酒、咖啡和焙烤食品里发现美拉德反应产物(Maillard reaction products,简称 MRPs)不但影响食品的色泽和风味,还具有较高的抗氧化性能,有关MRPs被用以代替酚类食用抗氧化剂,正逐渐引起人们的关注[7]。目前,MRPs已被看作功能食品的重要成分,具有抗氧化、抗变态、抗菌和抗细胞毒素等功能[8]。有研究表明,目前工业上常用的合成抗氧化剂丁基羟基茴香醚(Butyl hydroxy anisd,BHA)和二丁基羟基甲苯(butylated hydroxytoluene,BHT)等可能具有致癌性,许多国家已经禁止使用,而MRPs是食品加工与保藏过程中自身产生的一类物质,属于天然物,其抗氧化性较强,目前已成为海内外抗氧化剂研究的热点[9]。美拉德反应对食品的营养价值也有重要的影响,既可能由于消耗了食品中的营养成分或降低了食品的可消化性而降低食品的营养价值,也可能在加工过程中生成抗氧化物质而增加其营养价值。本文针对花生粕MRPs的抗氧化活性进行研究,以期为花生粕的高值化开发利用提供参考。
1 材料与方法
1.1 材料与试剂
花生粕:广州市清石海食品有限公司;麸皮:广州市番禺区北亭村农贸市场;木糖:郑州康帆生物科技有限公司;枯草芽孢杆菌:落星生物工作室;米曲霉(沪酿3.042):上海佳民酿造食品有限公司;枯草杆菌蛋白酶(20万 U/g)、纤维素酶(10万 U/g):南宁市庞博生物工程有限公司;α-淀粉酶(2 000 U/g):国药集团化学试剂有限公司;1,1-二苯基-2-三硝基肼(DPPH)、二硫代巴比妥酸(TBA):阿拉丁试剂(上海)有限公司;水杨酸(分析纯):广州化学试剂厂;邻苯三酚、硫酸铁、三氯乙酸(TCA)(均为分析纯):天津市致远化学试剂有限公司。
1.2 仪器与设备
立式压力蒸汽灭菌器LDZX-50KBS:北京白洋医疗器械股份有限公司;恒温震荡培养箱HZQ-X100:上海天呈科技有限公司;高速冷冻离心机GL-2050MS:南京思欧仪器设备有限公司;水浴恒温振荡器THZ-82:金坛市华欧实验仪器厂;数显pH计PHS-25:上海精密科学仪器有限公司;双光束分光光度计UV-2100:北京瑞利分析仪器公司;气相色谱-质谱联用仪7890A-5975C:美国Agilent科技公司。
1.3 花生粕酵解物美拉德反应产物制备工艺
花生粕酵解物及其美拉德反应产物制备流程图见图1。

图1 花生粕酵解物及其美拉德反应产物制备流程图Fig.1 The flow chart of peanut meal hydrolysates and its MRPs
花生粕在25 r/min下进行挤压膨化,烘干粉碎。将其与麸皮、蒸馏水按7∶2∶135(质量比)的比例混合均匀,放入灭菌锅中灭菌,冷却至室温后,先加入5%枯草芽孢杆菌,在30℃恒温摇床中发酵4 h,再加入15%酱油曲精,继续发酵48 h,121℃灭菌20 min,冷却至室温,4 000 r/min离心15 min,得到花生粕发酵液和发酵渣[10]。发酵渣与蒸馏水1∶20(质量比)混合均匀,添加纤维素酶、中性淀粉酶和枯草杆菌蛋白酶(分别按10%、5%、4%的发酵渣重量添加)继续酶解6 h,100℃灭酶10 min,冷却至室温,10 000 r/min离心15 min,得到花生粕发酵渣酶解液[11]。
花生粕发酵液与花生粕发酵渣酶解液1∶1(质量比)混合均匀,得到花生粕酵解物。添加1.0%木糖混合均匀,115℃反应35 min,得到花生粕酵解物美拉德反应产物(简称MRPs)。
1.4 花生粕酵解物及其MRPs抗氧化活性的测定
1.4.1 清除DPPH自由基的能力测定
[12],配制浓度梯度的样品稀释液,取稀释液2 mL,加入0.2 mmol/L DPPH-乙醇溶液2 mL,避光静置20 min,在517 nm下测得Ai。用乙醇代替样品液如上述方法测得AC。用2 mL无水乙醇取代DPPH乙醇溶液,测得Aj,计算清除率和样品IC50值。样品对DPPH自由基的清除率(Clearance rate,简称CR)计算公式如下:
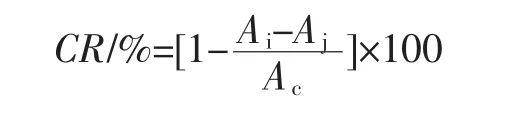
注:IC50是样品的DPPH自由基清除率为50%的样品溶液稀释液浓度。IC50数值小,表明样品对DPPH自由基清除能力越强。下面3种抗氧化能力的IC50意义相同。
1.4.2 清除羟基自由基的能力测定
参考文献[13],配制浓度梯度的样品稀释液,取稀释液2mL,加入2mL9mmol/LFeSO4溶液、2mL9mmol/L水杨酸-乙醇溶液和2 mL 8.8 mL H2O2溶液,37℃水浴30 min,在510 nm下测得A0。用蒸馏水代替样品液如上述方法测得Ai0。用2 mL蒸馏水代替水杨酸-乙醇溶液,在510 nm下测得Ai,计算清除率和样品IC50值。样品对羟基自由基的清除率计算公式如下:

1.4.3 清除超氧化阴离子自由基的能力测定
参考文献[13],邻苯三酚自氧化速率的测定方法:取pH8.2Tris-HCl缓冲液4.5mL,加入去离子水4.2mL,于25℃恒温静置20 min,取出后向混合体系迅速加入0.3 mL已预热至25℃的3 mmol/L邻苯三酚溶液,摇匀,在325 nm波长下每隔30 s测吸光度1次,至4 min时停止,计算线性范围内每分钟吸光度的增加值(A1)。平行3组试验,取其平均值。
加入样品稀释液后邻苯三酚自氧化速率的测定方法:配制系列浓度范围梯度的样品稀释液,取pH 8.2 Tris-HCl缓冲液4.5 mL,加入去离子水3.2 mL以及1.0 mL稀释液,于25℃恒温静置20 min,取出后向混合体系迅速加入0.3 mL已预热至25℃的3 mmol/L邻苯三酚溶液,摇匀,在325 nm波长下每隔30 s测吸光度1次,至4 min时停止,计算线性范围内每分钟吸光度的增加值(A2)。样品对超氧化阴离子自由基的清除率计算公式如下:

1.4.4 抗脂质过氧化的能力测定
参考文献[14],配制系列浓度范围梯度的样品稀释液,取1 g食用花生油,加入200 mg稀释液和5 mL 2.8 g/L的TBA混匀,置于90℃恒温烘箱中反应6 h,取出后加入5 mL100 g/L的TCA、2 mL CHCl3,充分摇匀后静置10 min,取上清液,在532 nm下测吸光度(A)。以蒸馏水代替样品不经烘箱处理后放置,用于分光光度计调零;以蒸馏水代替样品,经过烘箱处理为空白组,吸光度记为A0。抗氧化活性用对油脂过氧化的抑制率(Inhibition ratio,IR)表示,如公式:

1.5 花生粕酵解物MRPs的GC-MS分析
气相色谱-质谱分析条件:石英毛细管柱HP-5MS(30 m×0.25 mm×0.25 μm),载气为氦气,流速为1.3 mL/min,分流比为10∶1,进样温度250℃,进样量5 μL,总运行时间56 min;色谱柱升温条件:初始温度40℃,保持2 min,以5℃/min升温,最高柱温270℃;质谱条件:离子源温度230℃,四级杆温度150℃,质量扫描范围10 U~600 U。
2 结果与分析
2.1 花生粕酵解物及其MRPs的抗氧化活性比较
2.1.1 花生粕酵解物及其MRPs清除DPPH自由基的能力比较
花生粕酵解物及其MRPs清除DPPH自由基能力比较见图2。

图2 花生粕酵解物及其MRPs清除DPPH自由基能力比较Fig.2 Comparison of DPPH scavenging ability of peanut meal hydrolysate MRPs and peanut meal hydrolysates
从图2可看出,花生粕酵解物本身就具有一定的清除DPPH自由基能力,在发酵和酶解的过程中,蛋白质被水解成具有抗氧化能力的多肽和氨基酸,使其清除DPPH自由基的能力得到提升。但是在0.5 mg/mL~3.0 mg/mL质量浓度范围中,MRPs清除DPPH自由基能力明显强于花生粕酵解物。随着MRPs样品质量浓度增大,MRPs对DPPH自由基的清除率逐渐增大,且当其样品质量浓度为3.0 mg/mL时,清除率达到70%,显示出MRPs在给定浓度范围内对DPPH自由基有较强的清除能力,且其清除能力都强于花生粕酵解物。这是由于酵解物在进行美拉德反应时,合成或者分解得到更多的具有抗氧化能力的物质[15],使得其MRPs清除DPPH自由基的能力得到较大的提升。
2.1.2 花生粕酵解物及其MRPs清除羟基自由基的能力比较
花生粕酵解物及其MRPs清除羟基自由基的能力比较见图3。
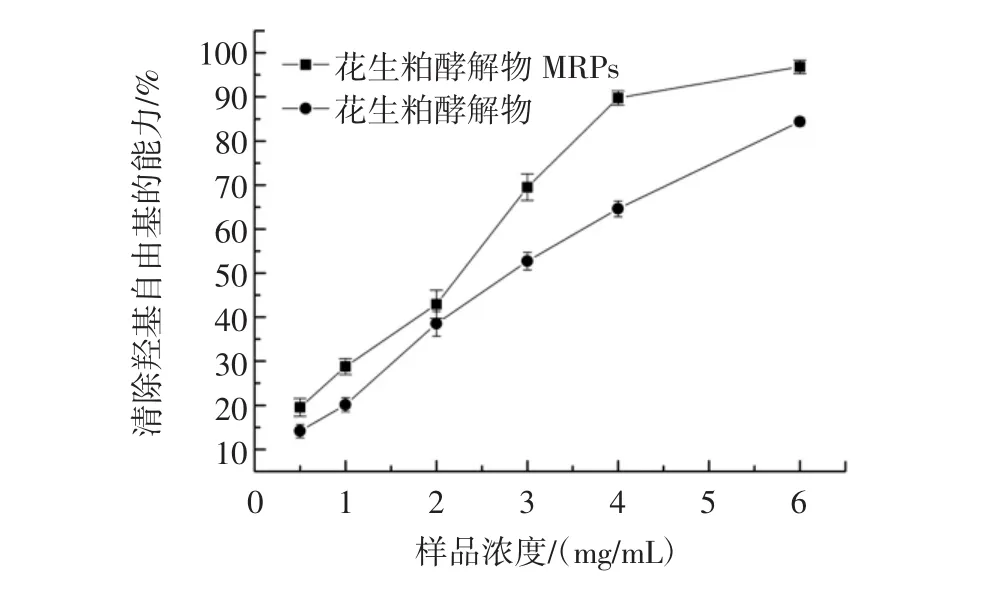
图3 花生粕酵解物及其MRPs清除羟基自由基的能力比较Fig.3 Comparison of scavenging hydroxyl radical capacity of peanut meal hydrolysate MRPs and peanut meal hydrolysates
由图3可知,在0.5 mg/mL~6.0 mg/mL质量浓度范围内,MRPs清除羟基自由基的能力比花生粕酵解物强。随着MRPs样品质量浓度增大,MRPs对羟基自由基的清除率逐渐增大,且当其样品质量浓度大于4.0mg/mL,清除率达到90%并趋于平缓。这说明MRPs在给定浓度范围内对羟基自由基有较强的清除能力。
2.1.3 花生粕酵解物及其MRPs清除超氧化阴离子自由基的能力比
花生粕酵解物及其MRPs清除超氧化阴离子自由基的能力比较见图4。
通过试验得到图4,在30 mg/mL~60 mg/mL质量浓度范围中,MRPs清除超氧化阴离子自由基的能力明显优于花生粕酵解物,随着MRPs样品质量浓度增大,MRPs对超氧化阴离子自由基的的清除率逐渐增大,且当MRPs样品质量浓度大于50 mg/mL,清除率达到75%趋于平缓。这说明高浓度的MRPs对超氧化阴离子自由基有较强的清除能力。
2.1.4 花生粕酵解物及其MRPs抗脂质过氧化的能力比较
花生粕酵解物及其MRPs抗脂质过氧化的能力比较见图5。

图4 花生粕酵解物及其MRPs清除超氧化阴离子自由基的能力比较Fig.4 Comparison of scavenging superoxide anion radical capacity of peanut meal hydrolysate MRPs and peanut meal hydrolysates

图5 花生粕酵解物及其MRPs抗脂质过氧化的能力比较Fig.5 Comparison of resisting lipid peroxidation ability of peanut meal hydrolysate MRPs and peanut meal hydrolysates
通过试验得到图5,在5 mg/mL~30 mg/mL质量浓度范围中,MRPs抗脂质过氧化能力明显优于花生粕酵解物,且MRPs随着样品质量浓度增大,MRPs抗脂质过氧化的能力逐渐增大,且当MRPs样品质量浓度大于30 mg/mL时,清除率达到90%趋于平缓。这说明MRPs抗脂质过氧化的能力较强。
2.1.5 MRPs的抗氧化性能力的IC50值
花生酵解物美拉德反应产物MRPs的抗氧化性能力的回归方程及IC50如表1。

表1 MRPs的抗氧化性能力Table 1 Antioxidant activity of peanut meal hydrolysate MRPs
由表1可得,MRPs对3种自由基均有一定的清除能力,且具有抗脂质过氧化能力。计算4种抗氧化能力IC50值可得,抗氧化能力大小比较如下,清除DPPH自由基能力>清除羟基自由基>抗脂质过氧化>清除超氧化阴离子自由基。由此可得,花生酵解物美拉德反应产物清除DPPH自由基能力最强,IC50值为1.93 mg/mL,其次是清除羟基自由基,IC50值为2.09 mg/mL。
2.2 花生粕酵解物及其MRPs的GC-MS分析
对花生粕酵解物和花生粕酵解物MRPs分别进行GC-MS分析,得到两个样品的总离子图,如图6和图7。

图6 花生粕酵解物的总离子图Fig.6 The total ion chromatography of peanut meal hydrolysates

图7 花生粕酵解物MRPs的总离子图Fig.7 The total ion chromatography of MRPs from peanut meal hydrolysates
经由NIST14.L谱库检索分析鉴定得到各组分及其含量。其中包括氮硫化合物、酸类、烃类及酚类。分析其主要成分相对百分含量,汇总得到表2。
对比表2中各抗氧化性成分可见,在花生粕酵解物中,抗氧化成分:吡咯[1,2-a]吡嗪-1,4-二酮含量为3.15%、油酸为1.99%,但不含氢化肉桂酸和对羟基苯乙醇。在花生粕酵解物美拉德产物中,4种抗氧化成分及其含量为:吡咯[1,2-a]吡嗪-1,4-二酮含量为 5.56%、油酸为2.87%、氢化肉桂酸为2.47%、对羟基苯乙醇为2.40%,这4种抗氧化成分经过美拉德反应后,其含量都增加了,说明美拉德反应可促进抗氧化物质的生成[16-19]。2,6-二叔丁基对甲酚是工业中经常使用的抗氧化剂BHT,具有良好的抗氧化能力[20],花生粕酵解物中含量为26.68%,花生粕酵解物美拉德产物中含量为26.83%,二者含量接近,美拉德反应对该物质含量的影响不大。综上分析可知,美拉德反应通过生成多种具有抗氧化性的物质,可有效增强花生粕酵解物的抗氧化性。
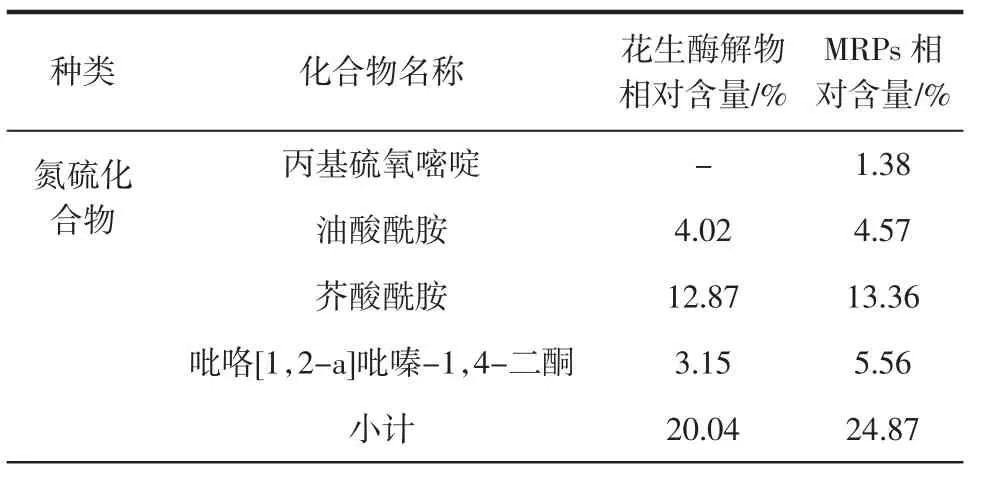
表2 花生粕酵解物及其MRPs成分对比及成分特征Table 2 Comparison of components and components characteristic of peanut meal hydrolysates around the maillard reation

续表2 花生粕酵解物及其MRPs成分对比及成分特征Continue table 2 Comparison of components and components characteristic of peanut meal hydrolysates around the maillard reation
3 结论
本试验选用花生粕为原料,制取花生粕酵解物并在最佳反应工艺参数条件下进行美拉德反应得到MRPs,并就花生粕酵解物及其MRPs的抗氧化活性进行分析比较。具体试验结论如下:
1)花生粕酵解物及其MRPs均具有抗氧化性,花生粕酵解物经过美拉德反应,其产物的抗氧化性更显著,主要体现在对DPPH自由基的清除能力、羟基自由基的清除能力、超氧化阴离子自由基的清除能力及抗脂质过氧化能力。且通过对比MRPs对不同自由基的清除能力,得到清除DPPH自由基能力>清除羟基自由基能力>抗脂质过氧化能力>清除超氧化阴离子自由基能力;
2)通过GC-MS分析发现,花生粕酵解物及其MRPs的抗氧化成分及其含量有较大差异,其中MRPs中具有抗氧化活性的物质含量明显多于花生粕酵解物,说明通过美拉德反应可增强花生粕酵解物的抗氧化活性。
参考文献:
[1] 陈杰,方志伟,徐鹤龙,等.花生粕的主要特征、营养成分及综合开发利用[J].广东农业科学,2008(11):70-71
[2] 霍湘,王安利,杨建梅.含硫氨基酸的抗氧化作用[J].生物学通报,2006,41(4):3-4
[3] 张友维.枯草芽孢杆菌发酵花生粕制备抗氧化肽的研究[D].无锡:江南大学,2012
[4] 刘红梅,师广波,李向东,等.复合酶法水解花生粕制备抗氧化肽的工艺优化[J].食品科学技术学报,2014,32(3):59-64
[5] Zeng H H,Zeng Y M.Study on the Antioxidant Activity of Enzymatic Hydrolysis Bioactive Peptide from Peanut Meal Powder[J].Food Industry,2014(7):57-60
[6] Yoo M A,Kim H W,Kim K H,et al.Antioxidant Effect of Brown Substances Separated from Defatted Roasted Sesame Dregs[J].Food Science&Biotechnology,2004,13(3):274-278
[7] Osada Y,Shibamoto T.Antioxidative activity of volatile extracts from Maillard model systems[J].Food Chemistry,2006,98(3):522-528
[8] 陈方娟.美拉德反应在食品中的应用[D].杭州:浙江工商大学,2010
[9] 陈玉霞,刘建华,林峰,等.DPPH和FRAP法测定41种中草药抗氧化活性[J].实验室研究与探索,2011,30(6):11-14
[10]毛晓宇,林思敏,张春雨,等.花生粕双菌固态发酵的工艺研究[J].食品研究与开发,2015,36(17):91-94
[11]毛晓宇,张春雨,陈晓丹,等.酶解热榨花生粕制备花生多肽的研究[J].现代食品科技,2013(1):150-152
[12]徐怀德,李升升,李钰金.洋葱酒、醋抗氧化能力比较及其香气物质分析[J].中国食品学报,2011,11(5):189-195
[13]杨建刚,陈相艳,王世清,等.洋葱皮中粗多糖的体外抗氧化及抗菌作用效果研究[J].食品工业,2015(5):182-185
[14]张强,周正义,王松华,等.大蒜、生姜、洋葱水提物抗氧化活性的比较[J].食品与发酵工业,2006,32(11):107-110
[15]刘敏,孟艳丽,董士远,等.鲢鱼肽美拉德反应产物超滤组分的抗氧化活性研究[J].现代食品科技,2015(6):219-223
[16]唐余玲,刘会云,孔佳超,等.植物单宁对油酸抗氧化性研究[J].中国皮革,2013(1):23-25
[17]杨阳.肉桂酸和香豆素类衍生物的合成及其抗氧化性能的研究[D].长春:吉林大学,2014
[18]杨大伟.医药中间体对羟基苯乙醇的合成及工艺研究[D].南京:南京林业大学,2007
[19]Ser H L,Palanisamy U D,Yin W F,et al.Presence of antioxidative agent,Pyrrolo[1,2-a]pyrazine-1,4-dione,hexahydro- in newly isolated Streptomyces mangrovisoli sp.nov.[J].Frontiers in Microbiology,2015,6:854
[20]胡云林.润滑油中2,6-二叔丁基对甲酚的抗氧化效果[J].石油炼制与化工,1992(6):71
