胸腺粘液腺癌的临床病理特征分析
2018-02-28程显魁林万润苏贞辉李亚琼吴大号侯东省
程显魁,林万润,苏贞辉,范 慧,李亚琼,吴大号,侯东省
依据2015年新的WHO胸腺肿瘤分类,胸腺腺癌(adenocarcinomas)包含四种类型:乳头状腺癌、具有腺样囊性癌样特征的胸腺腺癌、粘液腺癌、以及腺癌,未分类(NOS)。
相比较上一版的WHO分类,新版明确将胸腺粘液腺癌作为一个新的独立肿瘤类型,体现了此病例随着近年的不断报道,对于它的认识也越来越深刻。胸腺腺癌非常少见,一般的病例报道只有1例或几例,在一篇关于胸腺腺癌综述性报道中,一共报道了26例胸腺腺癌,其中10例为乳头状腺癌,9例为粘液腺癌,2例为乳头状管状腺癌,3例为传统的腺癌,2例为腺癌,未分类[1]。第1例胸腺粘液腺癌由Choi等人于2003年首次报道[2],从2003年至今,也只有15例明确的粘液腺癌见诸文献报道[1-14]。此次我们报道了1例胸腺原发性粘液腺癌,并对2003年以来的关于胸腺粘液腺癌的英文文献报道进行系统复习。
1 资料与方法
1.1 临床资料
患者,男,60岁,查体发现前纵膈占位,于2016年3月14日进入山东大学附属省立医院进行手术治疗。临床病史没有特殊发现,无重大疾病手术史,血清学检查AFP及CEA指标均正常;CT结果显示前纵膈胸腺位置一界限清楚的肿块(图1)。临床查体及影像学检查均未查见其他部位的肿瘤。
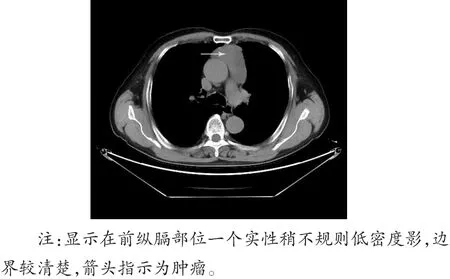
图1 CT扫描结果
1.2 方法
肿瘤组织常规取材并石蜡切片,进行免疫组化染色。抗体为福建迈新公司提供的AAT、CAM5.2、CD117、CDX-2、CEA、CK、MUC2、CK19、CK20、TTF-1、Synaptophysin、ChromograninA;Dako公司提供的Calretinin、CK7、MC、TdT、Vim、P63;中杉金桥公司提供的S-100、CK5/6、CD1a、以及CD5。免疫组化染色于PV-8000染色系统,利用非生物素第二代产品按照一步法增强型辣根酶聚合物染色系统进行,每组均有阳性对照和阴性对照,均重复3次。
1.3 文献复习
收集2003~2017年间所有关于胸腺粘液腺癌的文献,并进行分析统计。
2 结果
2.1 肿瘤组织大体形态
肿瘤大小为7 cm×5.7 cm×5 cm,边界清楚,周围附少许脂肪组织;切面以实性为主,实性区灰黄灰白,质地较硬,富于弹性,部分区域伴有胶冻样及粘液样,局部见大小为2.5 cm的小囊腔(图2),肿瘤周围未查见肺组织。
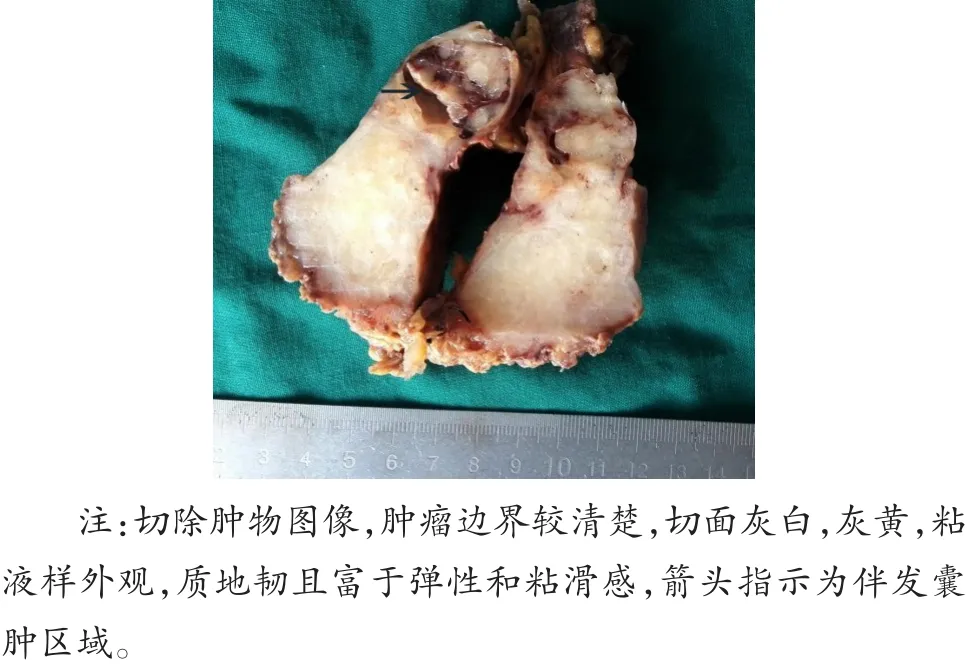
图2 肿瘤大体图像
2.2 组织形态观察
组织形态具有其他部位腺癌诸如胃肠道粘液腺癌的一般共同特点,肿瘤细胞包含了大量的细胞内和细胞外粘液,于大片的粘液背景中,有成岛状和缎带样的异型增生细胞团组成(图3A),肿瘤细胞大部分呈立方状,并形成小管状、巢状、以及筛状结构,部分细胞呈印戒样,细胞核显示了中等到重度的异型性(图3B~C)。肿瘤的周边查见残留的胸腺组织(图3D)。
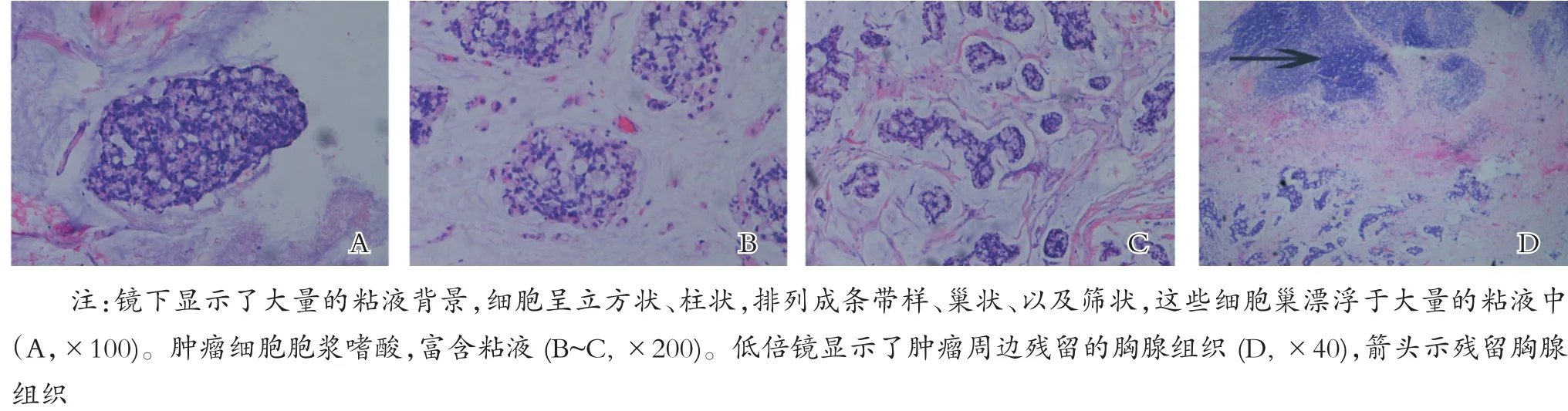
图3 肿瘤组织形态学图片
2.3 免疫组化结果
免疫组织化学结果阳性的指标有:AAT、CAM5.2、CD117、CDX-2、CEA、CK、MUC2、CK19、以及 CK20;阴性指标有:TTF-1、Synaptophysin、Chromogranin A、Calretinin、CK7、MC、TdT、Vim、P63、S-100、CK5/6、CD1a、以及CD5,见图4A~F。
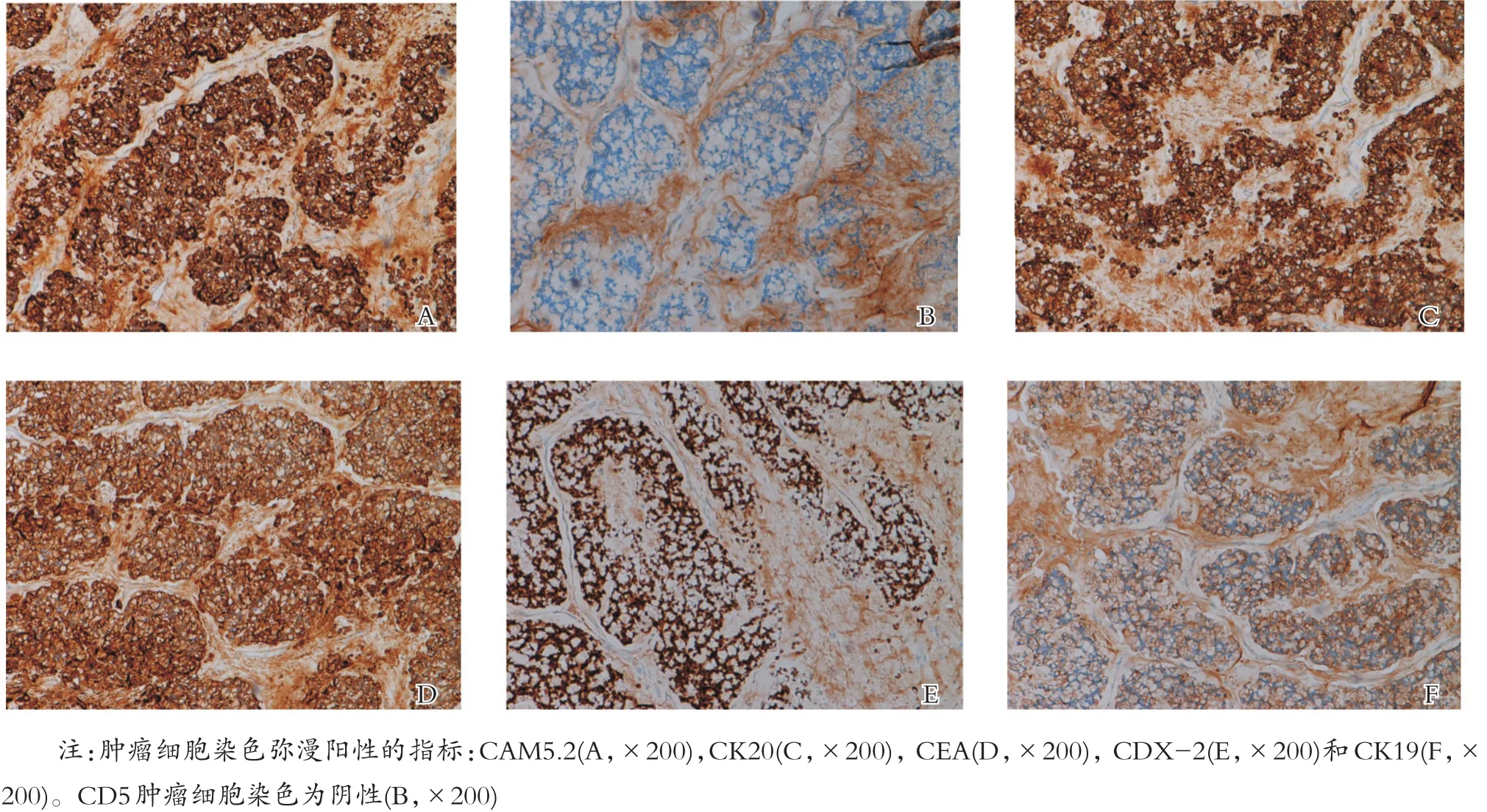
图4 免疫组化染色结果
2.4 文献统计结果
综合收集的文献,发现胸腺粘液发生的年龄范围为15~82岁,男女发病率的比例为1∶1.3,女性患者略多于男性患者,粘液腺癌的大小范围5.2~14.5 cm(表1)。同时对文献中报道的CDS、CK20、CKFCEA等抗体进行了分析统计,结果见表2。

表1 报道的胸腺粘液腺癌临床特征

表2 报道病例免疫组化结果
3 讨论
胸腺腺癌发病率低,粘液腺癌的发病尤其低,并且其组织形态呈现多态性,这导致胸腺粘液腺癌的诊断比较有挑战性。从2003年迄今为止,包括本病例在内,只有16例明确的粘液腺癌被报道[2-3,5-11,15,16]。文献研究表明,胸腺腺癌通常伴囊性变,统计的15例病例中有9例(60%)都与囊腔具有相关性(表1),我们此次报道的病例也存在囊腔。
与其他肿瘤的鉴别诊断:例如胸腺生殖细胞肿瘤、胃肠道粘液腺癌胸腺转移、以及其他源于胸腺的肿瘤。生殖细胞肿瘤是发生在纵膈比较常见的一种肿瘤,特别是恶性畸胎瘤也可以含有粘液腺癌成分,但是畸胎瘤是具有异质性的肿瘤,肿瘤成分多样,粘液成分只是其中的一种,这一点有利于与胸腺粘液腺癌进行鉴别诊断。我们此次报道的肿瘤,全部是由黏液以及漂浮于其上的腺体组成,成分比较单一,并且免疫组化结果表明肿瘤组织不表达HCG、PLAP和AFP。
此次报道的病例表达CK7、CK20、CEA、以及CDX-2,这些抗体主要表达于胃肠道及胰腺的癌中。但是我们通过对之前文献的分析统计,发现CK7、CK20、CDX2和CEA的阳性率分别如下:15例进行了CK7的检测,其中9例病例为CK7阳性(60%),2例为部分阳性(13%);14例进行了CK20检测,其中9例为CK20阳性(64%),1例为部分阳性;12例进行CDX-2检测的病例中有10例为阳性(83%);9例进行CEA检测,其中6例为阳性(67%)(表2)。研究结果表明:CK7、CK20、以及CDX2在这些粘液腺癌病例中均具有较高的阳性率。CK20和CDX-2是肠分化的标记物,有学者认为新的分类里的粘液腺癌和未分类腺癌均具有肠型腺癌分化的特点[15],并且报道了两例胸腺原发腺癌,其中1例为大小6cm的实性肿物,形态学符合粘液腺癌的特征,免疫组化结果示CEA、CK20和CDX2均为阳性,笔者认为这是胸腺肠型腺癌。笔者还对于之前的关于文献报道的43例胸腺腺癌进行综述,发现其中有11例具有所谓的肠型分化特点,CK20和CDX2在这11例病例中均有表达,进而认为胸腺的这种具有肠型分化的腺癌可以被认为是胸腺腺癌的一个新的类型。笔者的这种预测也得到了新版WHO肿瘤分类的认可(2016新版WHO肿瘤分类命名为粘液腺癌,隶属于胸腺腺癌)。这种胸腺腺癌的一个特点是具有粘液样的形态和伴有胸腺囊肿,对于这种具有肠型分化特点的胸腺腺癌的认识,有助于我们对于此肿瘤与胃肠道以及其他部位转移性粘液腺癌进行鉴别诊断。
大部分的胸腺粘液腺癌表达CD5,CD5也一直被认为是支持胸腺起源的一项有力证据,但是,Kapur等认为CD5并不一定只表达于原发性胸腺腺癌中[8,10]。通过之前的研究发现,11例被研究对象中有3例(27%)胸腺粘液腺癌CD5是不表达的,这其中也包括本病例。,CD5阳性的9例病例中,有4例是部分阳性表达(表2)。很显然到目前为止,胸腺粘液腺癌还没有一项免疫组化指标能够特异地显示其胸腺源性。本例研究也不表达TTF-1和Napsin A,这两个抗体是公认的表达于肺腺癌的抗体,之前的关于胸腺粘液腺癌也全部不表达TTF-1(表2),这排除了肺粘液腺癌胸腺转移的可能性。综上所述,病理上的证据以及临床实验室检查都排除了本病例是其他部位粘液腺癌转移的可能性。
在胸腺粘液腺癌基因的研究方面,最近有1例粘液腺癌的报道,肿瘤细胞表现为乳头样的生长方式,肿瘤侵犯了左侧头臂静脉和心包膜,PCR检测发现具有KRAS基因的突变,但未检测到EGFR基因的突变,以及未检测到EML4-ALK融合基因的存在,患者于手术1年后,发现了肺等多器官的转移,继而进行化疗,首次手术后,一共生存了34个月。这是第1例对于胸腺粘液腺癌进行基因检测的报道,提示胸腺粘液腺癌同样存在类似于肺腺癌的基因突变,对于基因的探索有助于对于该疾病的更深一步的认识[14]。
在治疗方面,最近的研究表明,肿瘤的完全性切除是预后良好的一项重要指标[17]。研究者提出,胸腺腺癌可以分为两种组织学类型,即低度恶性和高度恶性。以前的研究发现在16例胸腺粘液腺癌患者中,其中8例(50%)均死于该肿瘤,平均生存时间为27个月,其中5例(31%)为带病生存状态,3例病例(19%)在手术之后无病生存(表1)。虽然我们的病例经过近二年的随访,目前患者尚处于无病生存期,但由于随访时间过短,我们还是宁愿把粘液腺癌归类为高度恶性的腺癌。
4 结论
越来越多的证据表明,粘液腺癌从大体形态以及免疫特性上,都是源发于胸腺的一类具有特定形态的腺癌,这也是新的WHO分类把其归入胸腺腺癌亚型的原因。相信随着认识的深入,以及病例的积累,会对此种疾病有更深一步的认识。
1. Maghbool M,Ramzi M,Nagel I,et al.Primary adenocarcinoma of the thymus:an immunohistochemical and molecular study with review of the literature[J].BMC Clinical Pathology 2013,13(17).
2. Choi WW,Lui YH,Lau WH,et al.Adenocarcinoma of the thymus:report of two cases,including a previously undescribed mucinous subtype[J].The American Journal of Surgical Pathology 2003,27:124-130.
3. Takahashi F,Tsuta K,Matsuno Y,et al.Adenocarcinoma of the thymus:mucinous subtype[J].Human Pathology,2005,36:219-223.
4. Seon HJ,Kim KH,Choi YD,Kim YH,et al.Angina pectoris caused by the extrinsic compression of coronary artery by primary thymic mucinous adenocarcinoma[J].International journal of cardiology,2012,156:13-15.
5. Seki Y,Imaizumi M,Shigemitsu K,et al.Mucinous adenocarcinoma of the anterior mediastinum[J].Kyobu geka The Japanese journal of thoracic surgery,2004,57:413-416.
6. Seki E,Aoyama K,Ueda M,et al.Mucinous adenocarcinoma of the thymus:a case report[J].J Thorac Oncol,2008,3(8):935-937.
7. Maeda D,Ota S,Ikeda S,et al.Mucinous adenocarcinoma of the thymus:a distinct variant of thymic carcinoma[J].Lung cancer(Amsterdam,Netherlands),2009,64:22-27.
8. Ra SH,Fishbein MC,Baruch-Oren T,et al.Mucinous adenocarcinomas of the thymus:report of 2 cases and review of the literature[J].The American journal of surgical pathology,2007,31:1 330-1 336.
9. Akiba J,Harada H,Yokoyama S,et al.Mucinous cystic tumor with CK20 and CDX2 expression of the thymus:is this a benign counterpart of adenocarcinoma of the thymus,enteric type[J].Pathol International,2016,66(1):29-33.
10. Kapur P,Rakheja D,Bastasch M,et al.Primary mucinous adenocarcinoma of the thymus:a case report and review of the literature[J].Archives of pathology&laboratory medicine,2006,130:201-204.
11. Abdul-Ghafar J,Yong SJ,Kwon W,et al.Primary thymic mucinous adenocarcinoma:a case report[J].Korean journal of pathology,2012,46:377-381.
12. Kinoshita F,Shoji F,Takada K,et al.Mucinous adenocarcinoma of the thymus:report of a case[J].Gen Thorac CardiovascSurg,2017,doi:10.1007/s11748-017-0781-1.
13. Yin YG,Lu HZ.Primary mucinous adenocarcinoma of the thymus:a case report and literature review[J].chin Med Sci J,2017,32(3):201-203.
14.Sakanoue I,Hamakawa H,Fujimoto D,et al.KRAS mutation-positive mucinous adenocarcinoma originating in thethymus[J].Journalofthoracicdisease,2017,9:694-697.
15. Moser B,Schiefer AI,Janik S,et al.Adenocarcinoma of the thymus,enteric type:report of 2 cases,and proposal for a novel subtype of thymic carcinoma[J].The American journal of surgical pathology,2015,39:541-548.
16. Gao Z,Kahn L,Bhuiya T.Thymic carcinoid with mucinous stroma:a rare variant of carcinoid with an aggressive clinical course[J].Annals of diagnostic pathology,2006,10:114-116.
17. Suster S,Rosai J.Thymic carcinoma:a clinicopathologic study of 60 cases[J].Cancer,1991,67:1 025-1 032.
