过敏性鼻炎合并哮喘患者血液嗜酸性粒细胞群中 P物质及其受体表达上调
2018-02-27臧艳艳柴文戍王君灵张慧云杨蕊铭何韶衡
臧艳艳,柴文戍,王君灵,张慧云,杨蕊铭,何韶衡
(锦州医科大学附属第一医院:1. 变态反应与临床免疫研究中心;2. 呼吸内科,辽宁锦州 121001)
过敏性哮喘是一种以肺组织细胞浸润(主要为嗜酸粒细胞及T细胞)、黏液过度分泌以及气道高反应性为特征的小气道炎症性疾病。过敏性鼻炎,为上呼吸道过敏性疾病,成人鼻炎更易发展为哮喘[1]。目前的研究认为,嗜酸性粒细胞等炎症细胞浸润是过敏性鼻炎和哮喘共同的病理生理学基础[2]。
P物质(substance P, SP)源于神经组织,是一种神经肽,人体的嗜酸性粒细胞、淋巴细胞和巨噬细胞均可分泌SP[3]。研究发现,过敏性鼻炎患者血浆和哮喘鼠模型肺泡灌洗液的SP浓度均显著升高[4],SP可通过直接活化其受体诱导鼻炎患者鼻黏膜充血、释放组胺,提示SP可能参与过敏性气道疾病。此外,SP可诱导过敏性鼻炎患者的鼻黏膜分泌趋化因子RANTES,促进嗜酸性粒细胞趋化和迁移,诱导和加重过敏性炎症反应[5],进一步提示SP可能通过嗜酸性粒细胞参与过敏性气道疾病。SP主要通过其高亲和力NK1受体(neurokinin 1 receptor, NK1R)在炎症、呼吸和记忆方面发挥重要作用[6]。有报道称哮喘患者气道上皮细胞SP和NK1R均表达增加,NK1R阻断剂可显著改善哮喘鼠的过敏炎症反应[7],提示SP可能通过NK1R参与过敏性气道疾病的发生。
近年来人们对SP和NK1R在神经系统和心血管系统的表达和作用进行了深入研究[8-11],但是SP和NK1R在呼吸疾病尤其是过敏性鼻炎合并哮喘(allergic rhinitis complicated with asthma, AR+AS)患者外周血嗜酸性粒细胞中的表达水平还未见相关报道。因此,本实验应用流式细胞术检测AR+AS患者外周血经不同过敏原刺激后嗜酸性粒细胞群中SP和NK1R的表达变化,探讨其在疾病发生过程中的作用。
1 材料与方法
1.1 实验试剂 BV421耦合的鼠抗人CCR3抗体、Zombie Aqua Fixable Viability kit(死细胞去除染料)、Fc受体(FcR)阻断剂、红细胞裂解液、高尔基受体阻断剂(BFA)购自Biolegend(San Diego, CA, USA);APC耦合的鼠抗人NK1R抗体、APC耦合的鼠IgG3同型抗体购自R&D Systems(Minneapolis, USA);FITC耦合的兔抗人SP抗体购自Lifespan (Rochester, NY, USA);FITC耦合的兔IgG同型抗体购自eBioscienceLos (Angeles, CA, USA);Cytofix/CytopermTM固定/透膜试剂盒购自BD Biosciences Pharmigen(Beldford, MA, USA);皮肤点刺试验过敏原购自ALK-ABELLO(Denmark);蒿草花粉提取液、尘螨提取液和梧桐花粉提取液购自北京新华联协和药业有限责任公司;PBS缓冲液购自Solarbio(Solarbio, USA);其他常用的化学试剂如盐和缓冲液均为分析纯;低温高速离心机(Thermo Scientific, USA),水浴锅(精宏),FACSVerse流式细胞仪(BD Biosciences, USA)。
1.2 方法
1.2.1 研究对象 本研究募集门诊健康人和急性期入院的AR+AS患者进行皮肤点刺试验,选取点刺试验阳性的19例AR+AS患者和点刺试验阴性的14例健康人为研究对象;哮喘的诊断标准符合2016年中华医学会发布的支气管哮喘防治指南[12],鼻炎的诊断标准符合2015年中华医学会发布的变应性鼻炎诊疗指南[13]。实验要求患者停止服用治疗哮喘和鼻炎的药物至少2周,且所有志愿者至少1月内无呼吸道感染症状。本研究获得锦州医科大学附属第一医院伦理委员会的批准,并与每位志愿者签订了知情同意书。
1.2.2 收集血液样本 采集志愿者病史资料(表1),其中健康人和AR+AS患者的年龄和性别构成比均无统计学差异(表2);每位志愿者均采集10 mL外周静脉血于含EDTA抗凝剂的采血管中。
表1 志愿者的一般资料
Tab.1 General information of the volunteers

项目健康人AR+AS尘螨(+)蒿草+梧桐(+)尘螨+蒿草+梧桐(+)AR+AS总计例数1465819年龄(岁)37(24~50)38(34~56)34(20~54)42.5(11~51)38(11~56)性别(女/男)8/63/32/35/310/9病史(年)08(4~16)6(0.2~9)7(3~20)7.5(0.2~20)发病年龄(岁)NA30(22~48)27(11~50)31.5(0~47)30.5(0~50)
注:表中年龄、病史和发病年龄的描述均为中位数(极小值~极大值),NA:不适用。
1.2.3 流式细胞术检测外周血嗜酸性粒细群中SP和NK1R的表达 全血加入BFA与蒿草花粉、尘螨和梧桐花粉过敏原粗提液(每种过敏原粗提液的终质量浓度均为0.1 μg/mL和1.0 μg/mL),37 ℃水浴震荡孵育1 h;1 200 r/min离心后弃去上清,加入死细胞去除染料与FcR阻断剂,避光孵育15 min;加入BV421耦合的鼠抗人CCR3抗体,避光孵育15 min后裂解红细胞,离心后用PBS溶液清洗并用固定液固定细胞;透膜洗液清洗后加入FITC耦合的兔抗人SP和APC耦合的鼠抗人NK1R抗体孵育,再次用透膜洗液清洗后上流式细胞仪检测嗜酸性粒细群中SP和NK1R的表达。
表2 志愿者的年龄和性别构成比
Tab.2 Ratio of volunteers’ age and sex

志愿者资料病例数健康人AR+ASP性别 男134(30.77%)9(69.23%) 女2010(50.00%)10(50.00%)0.310年龄(岁) <38158(53.33%)7(46.67%) ≥38186(33.33%)12(66.67%)0.304
注:病例数n<40,性别及年龄采用Fisher确切概率法得出P值。
1.3 统计学分析 用统计软件SPSS 13.0分析数据,用Mann-WhitneyU分析组间差异。P<0.05为差异有统计学意义。
2 结 果
2.1 AR+AS患者嗜酸性粒细胞群中SP表达水平升高 本实验用流式细胞术检测了不同过敏原刺激下人体外周血嗜酸性粒细胞群(嗜酸性粒细胞富集群的设门方法见图1)SP的表达水平。结果显示,与健康人对照组相比AR+AS患者嗜酸性粒细胞富集群中SP+细胞的比例升高了1.5倍(Z=-2.041,P=0.041)。此外,用质量浓度为0.1 μg/mL蒿草花粉粗提液刺激患者外周血后,SP+细胞的比例上调约68.1%(Z=-2.637,P=0.008,图2、图3)。

图1 嗜酸性粒细胞群的设门方法
Fig.1 Gating strategies of eosinophil-enriched population
A:细胞碎片去除后的细胞群;B:死细胞去除后的细胞群;C:粒细胞群;D:嗜酸性粒细胞群(CCR3+细胞群)。

图2 人体外周血嗜酸性粒细胞群中SP+细胞的百分比
Fig.2 Expression of SP+cell in eosinophil-enriched population from human blood
蒿草:蒿草花粉粗提液(0.1和1.0 μg/mL);尘螨:尘螨粗提液(0.1和1.0 μg/mL);梧桐:梧桐花粉粗提液(0.1和1.0 μg/mL);AR+AS:过敏性鼻炎合并哮喘;与相对应的静息状态健康人对照组比较,**P<0.05;与静息状态的过敏性鼻炎合并哮喘患者组比较,*P<0.05。
2.2 AR+AS患者嗜酸性粒细胞群中NK1R表达升高 流式细胞术检测不同过敏原刺激下人体外周血NK1R+嗜酸性粒细胞的百分比和平均荧光强度。结果显示,与健康人对照组相比,AR+AS患者嗜酸性粒细胞群中NK1R+细胞的比例和平均荧光强度分别上调26.4%(Z=-3.207,P=0.001)和85.9%(Z=-4.774,P<0.001),而加入不同过敏原NK1R+细胞的比例及平均荧光强度均无统计学意义(图4~图7)。

图3 人体外周血嗜酸性粒细胞群中SP表达水平的流式细胞仪代表图
Fig.3 Representative flow cytometric graphs of expression of SP in eosinophil-enriched population from human blood
Isotype:同型对照;AR+AS:过敏性鼻炎合并哮喘;蒿草:蒿草花粉粗提液。

图4 人体外周血嗜酸性粒细胞群中NK1R+细胞的百分比
Fig.4 Expression of NK1R+cells in eosinophil-enriched population from human blood
蒿草:蒿草花粉粗提液(0.1和1.0 μg/mL);尘螨:尘螨粗提液(0.1和1.0 μg/mL);梧桐:梧桐花粉粗提液(0.1和1.0 μg/mL);AR+AS:过敏性鼻炎合并哮喘;与相对应的静息状态健康人对照组比较,**P<0.05。
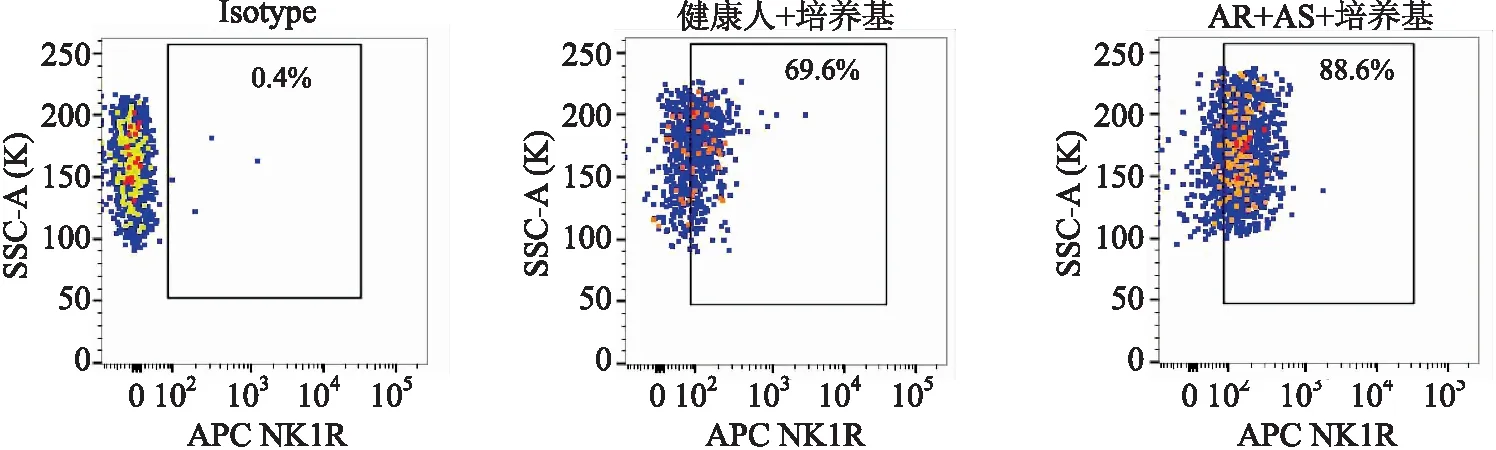
图5 人体外周血嗜酸性粒细胞群中NK1R表达水平的流式细胞仪代表图
Fig.5 Representative flow cytometric graphs of NK1R expression in eosinophil-enriched population from human blood
Isotype:同型对照;AR+AS:过敏性鼻炎合并哮喘。
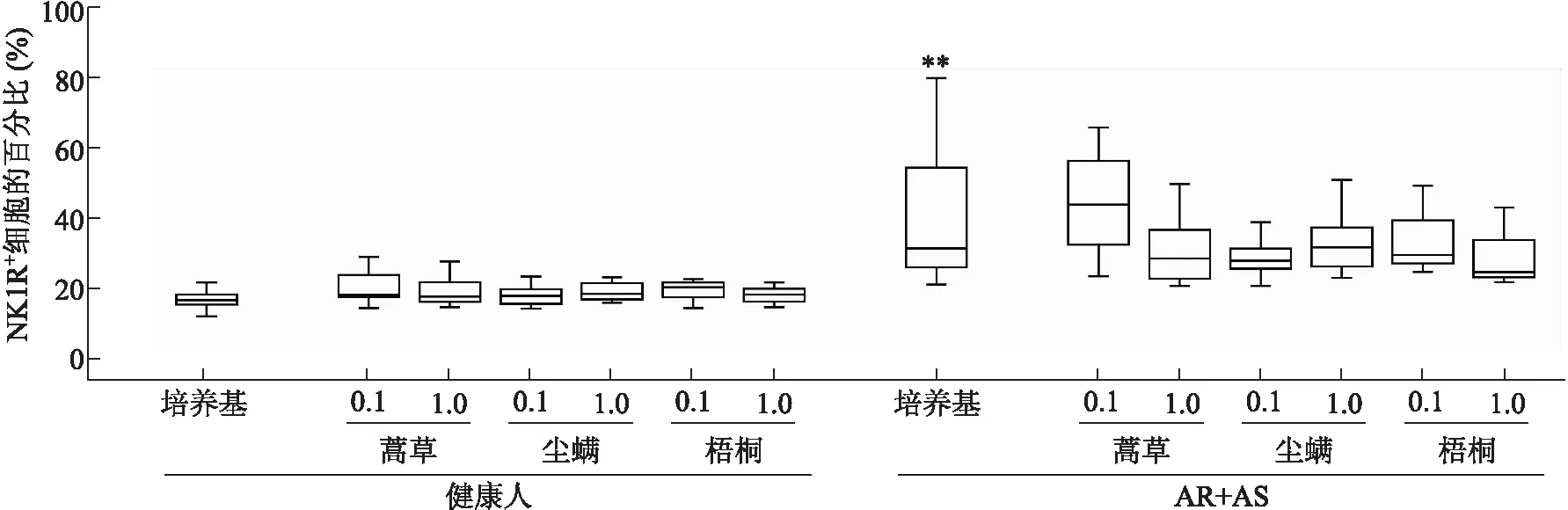
图6 人体外周血嗜酸性粒细胞群中NK1R+细胞的平均荧光强度
Fig.6 Mean fluorescent intensity of NK1R+cells in eosinophil-enriched population from human blood
蒿草:蒿草花粉粗提液(0.1和1.0 μg/mL);尘螨:尘螨粗提液(0.1和1.0 μg/mL);梧桐:梧桐花粉粗提液(0.1和1.0 μg/mL);AR+AS:过敏性鼻炎合并哮喘;与相对应的静息状态健康人对照组比较,**P<0.05。

图7 人体外周血嗜酸性粒细胞群中NK1R+细胞平均荧光强度的流式细胞仪代表图
Fig.7 Representative flow cytometric graphs of mean fluorescent intensity (MFI) of NK1R+cells in eosinophil-enriched population from human blood
Isotype:同型对照;AR+AS:过敏性鼻炎合并哮喘。
3 讨 论
支气管哮喘和过敏性鼻炎均为呼吸道常见的过敏性炎症疾病,二者常常同时存在(AR+AS)并相互影响,严重威胁人类健康,已成为全球性健康问题。SP是一种强效促炎介质,其来源广泛,主要存在于中枢神经系统和外周神经系统,可诱导炎性介质如细胞因子、氧自由基、花生四烯酸衍生物和组胺释放并引起组织损伤,这些炎性介质可诱导白细胞募集并进一步放大炎症反应。研究发现,过敏性鼻炎和哮喘性咳嗽患者血浆SP表达升高[14-15];本研究中AR+AS患者嗜酸性粒细胞富集群中SP+细胞的比例升高,提示升高的血浆SP水平来自嗜酸性粒细胞,嗜酸性粒细胞源SP可能在AR+AS的发生过程起重要作用。
目前,过敏原与SP在AR+AS发病过程中的关系还未见报道。现有研究显示,过敏原鼻激发试验可通过上调肺组织SP的表达从而诱导支气管高反应性[16],且过敏性炎症可促进豚鼠肺神经元中SP的合成[17],提示过敏原可能通过促进SP的表达参与AR+AS的发病。本研究发现,蒿草花粉粗提液可诱导AR+AS患者外周血SP+嗜酸性粒细胞的比例上调约68.1%,提示过敏原可能通过诱导嗜酸性粒细胞释放SP参与AR+AS;然而,由于目前尚缺少过敏原可通过调节嗜酸性粒细胞表达SP参与过敏性疾病的发病的相关研究,其具体机制尚需进一步研究。
NK1R是SP的高亲和力受体,广泛分布在中枢神经系统和外周组织中[18],也表达于气道平滑肌细胞、黏膜下腺细胞和血管内皮细胞[19]。在炎症的局部微环境中,SP/NK1R复合物被视为一个整体来发挥作用,是诸多疾病的分子基础[20];此外,NK1R活化可促进T细胞分泌IFN-γ和IL-17,进一步促进和放大炎症反应[3]。本研究通过流式细胞术发现AR+AS患者外周血嗜酸性粒细胞NK1R表达增强,而SP可通过与高亲和力NK1R和低亲和力NK2R、NK3R结合后刺激多种细胞分泌细胞因子,诱导肥大细胞释放组胺和脱颗粒,并进一步募集淋巴细胞和肥大细胞进而参与过敏性鼻炎发病[21],提示SP可能通过嗜酸性粒细胞表面的NK1R参与AR+AS。有报道称NK1R受体拮抗剂可消除过敏原诱发的支气管高反应性[16],NK1R敲除鼠的鼻黏膜中嗜酸性粒细胞浸润减少,过敏性鼻炎的症状缓解[22]。结合本研究的发现,我们可以推断嗜酸性粒细胞源SP可能通过自分泌途径作用于NK1R诱导炎性介质的释放,进而参与AR+AS发病,但是否能通过阻断NKIR的表达进而治疗AR+AS,还有待进一步研究。
综上所述,嗜酸性粒细胞是AR+AS发病过程中的重要效应细胞,过敏原可能是AR+AS发病的主要诱因,SP和NK1R是AR+AS发病的重要介质。AR+AS患者血液嗜酸性粒细胞SP和NK1R表达增强,且SP极有可能通过嗜酸性粒细胞表面的NK1R参与AR+AS发病,SP和NK1R有望成为治疗AR+AS的新靶点。
[1] SHAABAN R, ZUREIK M, SOUSSAN D, et al. Rhinitis and onset of asthma: A longitudinal population-based study[J]. Lancet, 2008, 372(9643):1049-1057.
[2] KHAN DA. Allergic rhinitis and asthma: Epidemiology and common pathophysiology[J]. Allergy Asthma Proc, 2014, 35(5):357-361.
[3] WEINSTOCK JV. Substance P and the regulation of inflammation in infections and inflammatory bowel disease[J]. Acta Physiol (Oxf), 2015, 213(2):453-461.
[4] LIU H, YANG X, HOU W. Correlation of c-fos protein expression with neuropeptide content in the lung of bronchial asthmatic rat[J]. Int J Clin Exp Pathol, 2014, 7(12):8657-8665.
[5] 章如新,刘国钧,温武,等. P物质在变应性鼻炎中对RANTES mRNA表达的影响及其意义[J]. 临床耳鼻咽喉科杂志, 2006, 20(2):73-77.
[6] LIU XM, SHU SY, ZENG CC, et al. The role of substance P in the marginal division of the neostriatum in learning and memory is mediated through the neurokinin 1 receptor in rats[J]. Neurochem Res, 2011, 36(10):1896-1902.
[7] RAMALHO R, ALMEIDA J, BELTRAO M, et al. Substance P antagonist improves both obesity and asthma in a mouse model[J]. Allergy, 2013, 68(1):48-54.
[8] JOHANSSON P, ALMQVIST EG, WALLIN A, et al. Cerebrospinal fluid substance P concentrations are elevated in patients with Alzheimer’s disease[J]. Neurosci Lett, 2015, 609:58-62.
[9] AKIYAMA T, NGUYEN T, CURTIS E, et al. A central role for spinal dorsal horn neurons that express neurokinin-1 receptors in chronic itch[J]. Pain, 2015, 156(7):1240-1246.
[10] MISTROVA E, KRUZLIAK P, CHOTTOVA DVORAKOVA M. Role of substance P in the cardiovascular system[J]. Neuropeptides, 2016, 58:41-51.
[11] ROBINSON P, TAFFET GE, ENGINEER N, et al. Substance P receptor antagonism: A potential novel treatment option for viral-myocarditis[J]. Biomed Res Int, 2015, 2015:645153.
[12] 中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南[J]. 中华结核和呼吸杂志, 2016, 39(9).
[13] 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组. 中华医学会耳鼻咽喉头颈外科学分会鼻科学组. 变应性鼻炎诊断和治疗指南[J]. 中华耳鼻咽喉头颈外科杂志, 2015, 51(1).
[14] ZHANG RX. Substance P in plasma of patients with allergic rhinitis and its clinical significance[J]. Zhonghua Er Bi Yan Hou Ke Za Zhi, 1993, 28(2):72-73, 123.
[15] OTSUKA K, NIIMI A, MATSUMOTO H, et al. Plasma substance P levels in patients with persistent cough[J]. Respiration, 2011, 82(5):431-438.
[16] HENS G, RAAP U, VANOIRBEEK J, et al. Selective nasal allergen provocation induces substance P-mediated bronchial hyperresponsiveness[J]. Am J Respir Cell Mol Biol, 2011, 44(4):517-523.
[17] CHUAYCHOO B, HUNTER DD, MYERS AC, et al. Allergen-induced substance P synthesis in large-diameter sensory neurons innervating the lungs[J]. J Allergy Clin Immunol, 2005, 116(2):325-331.
[18] GARCIA-RECIO S, GASCON P. Biological and pharmacological aspects of the NK1-receptor [J]. Biomed Res Int, 2015, 2015:495704.
[19] STEINHOFF MS, VON MENTZER B, GEPPETTI P, et al. Tachykinins and their receptors: Contributions to physiological control and the mechanisms of disease[J]. Physiol Rev, 2014, 94(1):265-301.
[20] ROSSO M, MUNOZ M, BERGER M. The role of neurokinin-1 receptor in the microenvironment of inflammation and cancer[J]. Sci World J, 2012, 2012:381434.
[21] PENNEFATHER JN, LECCI A, CANDENAS ML, et al. Tachykinins and tachykinin receptors: A growing family[J]. Life Sci, 2004, 74(12):1445-1463.
[22] WANG H, ZHANG R, WU J, et al. Knockdown of neurokinin-1 receptor expression by small interfering RNA prevents the development of allergic rhinitis in rats[J]. Inflamm Res, 2013, 62(10):903-910.
