特应性皮炎患者嗜酸性粒细胞富集群中P物质 及其受体NK1R的表达变化
2018-02-27杨蕊铭张慧云郑文娇王君灵张泽南何韶衡
杨蕊铭,张慧云,2,郑文娇,王君灵,张泽南,何韶衡
(1. 锦州医科大学附属第一医院变态反应与临床免疫研究中心,辽宁锦州 121001; 2. 苏州市相城人民医院中心实验室,江苏苏州 215100; 3. 淄博矿业集团有限责任公司中心医院检验科,山东淄博 255120)
特应性皮炎(atopic dermatitis, AD)是一种常见的慢性炎症性皮肤疾病,影响10%~20%的人群[1],任何年龄均可发病。嗜酸性粒细胞起源于骨髓CD34+造血祖细胞,与嗜碱性粒细胞和肥大细胞一样,是参与过敏反应的主要效应细胞之一。正常皮肤组织无嗜酸性粒细胞,而AD患者外周血嗜酸性粒细胞增多,皮损处可见嗜酸性粒细胞浸润,且其数量与疾病的严重程度相关。嗜酸性粒细胞在炎性分子和细胞因子的作用下可募集其它炎症细胞进而加重皮肤损伤[2]。上述研究提示,嗜酸性粒细胞与AD的发生、发展有一定的关系。
P物质(substance P, SP)是有特异性的神经活性和促炎活性的神经肽[3]。研究报道,AD鼠模型的皮肤受损部位SP+肥大细胞和神经纤维细胞增多[4];皮内注射SP可诱导或加重正常人和AD患者皮肤的炎症反应,提示SP参与AD发病。NK1R是SP的高亲和力受体,SP可通过激活NK1R增强皮肤的炎症反应[5-6],湿疹患者外周血单核细胞、Th细胞、NKT细胞和嗜碱性粒细胞NK1R表达显著升高[7],AD患者NK1R+单核细胞增多[8],提示SP可能通过NK1R参与AD发病。然而,目前尚无AD患者血液嗜酸性粒细胞SP和NK1R的表达的报道。
螨虫和植物花粉是室内、外过敏原的主要来源,通过与致敏的肥大细胞和嗜碱性粒细胞表面的IgE-FcεRⅠ复合物发生反应可诱导过敏性疾病的发生[9]。有报道称尘螨过敏原可诱导AD的发生。OVA激发鼠支气管后,其肺组织的神经细胞内SP显著增多[10],说明过敏原可诱导SP的表达。但是目前尚无过敏原对AD患者血液嗜酸性粒细胞SP和NK1R表达影响的研究。因此,本研究采用流式细胞仪检测AD患者外周血SP和NK1R在嗜酸性粒细胞富集群中的表达情况,及尘螨、蒿草花粉和梧桐花粉过敏原对SP和NK1R表达的影响,旨在为SP、NK1R与嗜酸性粒细胞的相关研究提供方向。
1 材料与方法
1.1 实验试剂及仪器 蒿草花粉提取液、屋尘螨提取液和梧桐花粉粗提液(北京新华联协和药业限责任公司,中国),BV421耦合的鼠抗人CCR3、Zombie Aqua Fixable Viability kit(死细胞去除染料)、FcR阻断剂、红细胞裂解液、BFA(Biolegend,美国),FITC标记兔抗人SP抗体(LifeSpan,美国),APC标记鼠抗人NK1R抗体(R&D Systems,美国),FITC标记兔IgG同型抗体(eBioscience,美国),APC标记鼠IgG3同型抗体(R&D Systems,美国),Cytofix/CytopermTM固定/透膜试剂盒(BD Biosciences,美国),皮肤点刺试验过敏原试剂(ALK-ABELLO,丹麦),其他常用的化学试剂均为分析级纯度;低温高速离心机(Thermo Scientific,美国),水浴锅(精宏,中国),FACSVerse流式细胞仪(BD Biosciences,美国)。
1.2 方法
1.2.1 研究对象纳入标准 募集锦州医科大学附属第一医院皮肤科就诊的AD患者和门诊健康人为志愿者。对志愿者进行皮肤点刺试验,点刺试验阳性的AD患者和点刺试验阴性的健康人为本研究的研究对象。共纳入10位健康人和15例AD患者,AD诊断符合2016年发布的AD诊断指南[11]。本实验要求所有AD患者至少2周前停止服用抗过敏药物。本研究获得了锦州医科大学附属第一医院伦理委员会的批准,每位志愿者均签订了知情同意书。
1.2.2 收集血液样本 采集研究对象的资料(表1);每位研究对象均采集2 mL外周静脉血于含EDTA抗凝剂的采血管中。
表1 志愿者的一般资料
Tab.1 General information of the volunteers
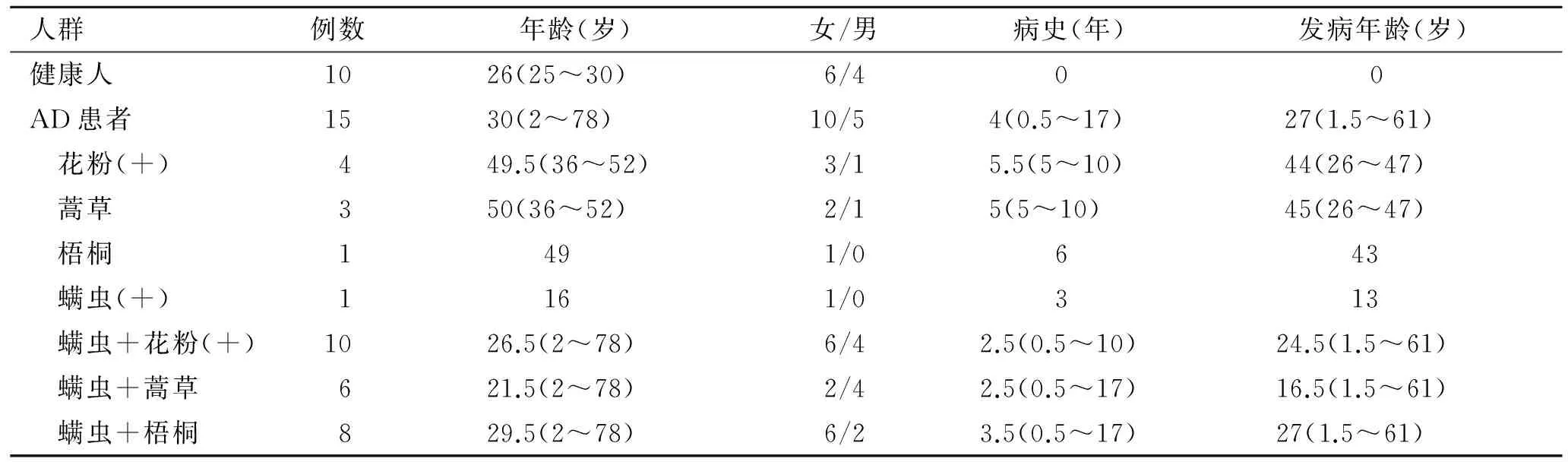
人群例数年龄(岁)女/男病史(年)发病年龄(岁)健康人1026(25~30)6/4 0 0AD患者1530(2~78)10/54(0.5~17)27(1.5~61) 花粉(+)449.5(36~52)3/15.5(5~10)44(26~47) 蒿草350(36~52)2/15(5~10)45(26~47) 梧桐1 491/0 6 43 螨虫(+)1 161/0 3 13 螨虫+花粉(+)1026.5(2~78)6/42.5(0.5~10)24.5(1.5~61) 螨虫+蒿草621.5(2~78)2/42.5(0.5~17)16.5(1.5~61) 螨虫+梧桐829.5(2~78)6/23.5(0.5~17)27(1.5~61)
注:表中年龄、病史和发病年龄的描述均为中位数(极小值~极大值)。
1.2.3 流式细胞术分析血液中嗜酸性粒细胞富集群SP和NK1R的表达 全血加入尘螨、蒿草花粉和梧桐花粉过敏原粗提液(终质量浓度为0.1 μg/mL和1.0 μg/mL),37 ℃水浴震荡孵育1 h;1 200 r/min离心后弃去上清,加入死细胞去除染料与FcR阻断剂,均匀混合后,避光孵育15 min,加入抗CCR3抗体,避光孵育15 min后裂解红细胞,离心后用固定透膜液固定细胞,加入抗SP和抗NK1R抗体孵育,上流式细胞仪检测嗜酸性粒细胞富集群中SP和NK1R的表达。
1.3 统计学分析 应用统计软件SPSS 13.0分析数据。Kruskal-WallisH秩和检验分析组间差异,有统计学意义者,用Mann-WhitneyU进一步两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 AD患者外周血嗜酸性粒细胞富集群中SP表达降低 应用流式细胞术检测AD患者外周血嗜酸性粒细胞富集群(设门方法见图1)中SP的表达。结果显示,AD患者的嗜酸性粒细胞富集群中SP+细胞的比例较健康对照组降低了1.17倍(P<0.001,图2、图3),且AD患者嗜酸性粒细胞富集群中SP+细胞的MFI降低了55%(P<0.001,图4、图5),而过敏原对SP的表达无影响(图3、图5)。

图1 嗜酸性粒细胞富集群的设门方法
Fig.1 Gating strategies of eosinophil-enriched cells
A:细胞碎片去除后的细胞群;B:死细胞去除后的细胞群;C:细胞群;D:嗜酸性粒细胞富集群(CCR3+细胞群)。

图2 AD患者血液嗜酸性粒细胞SP表达变化的流式细胞仪图
Fig.2 Representative flow cytometric graphs of the expression of SP in eosinophils from human peripheral blood
Isotype:同型对照;HC:健康对照组;AD:特应性皮炎。
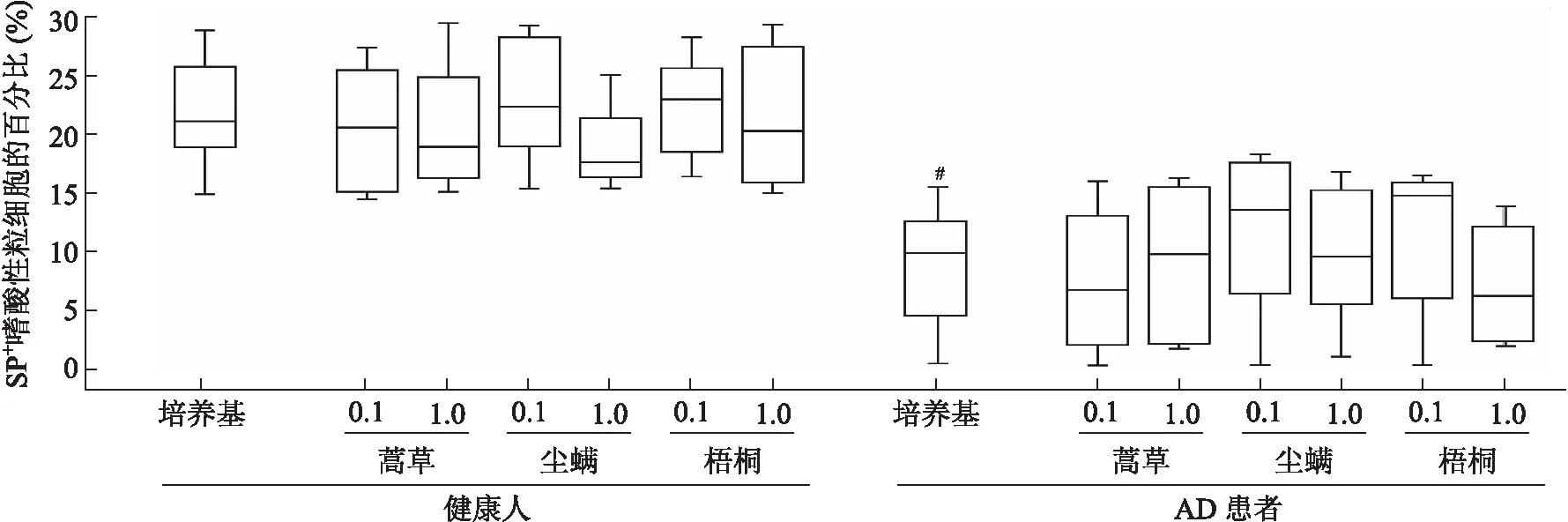
图3 人外周血中嗜酸性粒细胞富集群中SP+细胞的百分比
Fig.3 Percentage of SP+eosinophils in human peripheral blood
蒿草:蒿草花粉粗提液;尘螨:尘螨粗提液;梧桐:梧桐花粉粗提液;与相对应的健康人群比较,#P<0.001。

图4 人外周血嗜酸性粒细胞群中SP+细胞MFI的流式细胞仪图
Fig.4 Representative flow cytometric graphs of MFI of SP+eosinophils in human peripheral blood
Isotype:同型对照;HC:健康对照组;AD:特异性皮炎。
2.2 AD患者外周血嗜酸性粒细胞富集群中NK1R表达升高 应用流式细胞术检测AD患者外周血嗜酸性粒细胞富集群中NK1R的表达情况,结果显示(图6、图7),与健康对照组相比,AD患者嗜酸性粒细胞富集群中NK1R细胞的比例升高了41%(P=0.001),而过敏原对NK1R的表达无影响。
3 讨 论
嗜酸性粒细胞是血液终末分化的粒细胞之一,可通过释放趋化因子,诱导炎症细胞募集而参与包括AD在内的皮肤炎症反应。研究发现AD患者外周血中嗜酸性粒细胞数量增多,并与AD的严重程度相关,提示嗜酸性粒细胞可能参与AD发病或募集皮损部位其他炎症细胞共同参与AD的发病。
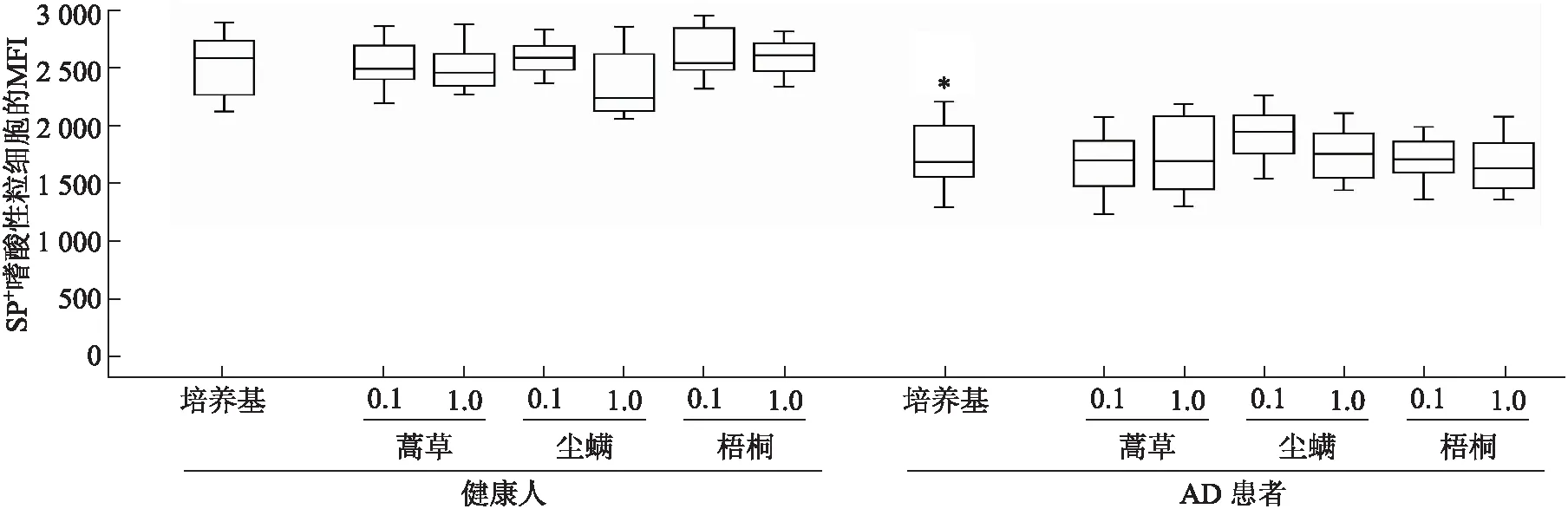
图5 人外周血中嗜酸性粒细胞富集群中SP+细胞MFI的表达
Fig.5 MFI of NK1R+eosinophils in human peripheral blood
蒿草:蒿草花粉粗提液;尘螨:尘螨粗提液;梧桐:梧桐花粉粗提液;与相对应的健康人群比较,*P<0.001。

图6 AD患者血液嗜酸性粒细胞NK1R表达变化的流式细胞仪图
Fig.6 Representative flow cytometric graphs of the expression of NK1R in eosinophils from human blood
Isotype:同型对照;HC:健康对照组;AD:特应性皮炎。
SP具有促炎性质,能够诱导炎症介质如细胞因子和组胺的释放并引起血管扩张,进而诱导过敏反应[12]。SP来源广泛,体内的多种细胞包括神经细胞和炎性细胞如巨噬细胞、嗜酸性粒细胞、淋巴细胞和树突状细胞均可分泌SP。研究发现皮肤病患者如慢性自发性荨麻疹患者[13]、湿疹患者[7]、AD患者的血浆SP水平显著升高[4,8,14],嗜酸性粒细胞可分泌SP。因此,我们推断升高的血浆SP水平可能来源于嗜酸性粒细胞,并进一步探究了AD患者血液嗜酸性粒细胞SP的表达。结果发现,AD患者外周血嗜酸性粒细胞富集群中SP+细胞减少了1.17倍,SP+嗜酸性粒细胞的MFI降低了55%。由于AD患者血液嗜酸性粒细胞数量相对较少,而中性粒细胞、单核细胞和淋巴细胞等均可分泌SP,本研究结果提示可能嗜酸性粒细胞产生的SP不是AD患者血浆SP的主要来源。升高的血浆SP水平可能与AD患者血液CD8+T细胞分泌SP增多有关[8]。

图7 人外周血中嗜酸性粒细胞富集群中NK1R+细胞的百分比
Fig.7 Percentage of NK1R+eosinophils in human peripheral blood
蒿草:蒿草花粉粗提液;尘螨:尘螨粗提液;梧桐:梧桐花粉粗提液;与相对应的健康人群比较,*P<0.001。
NK1R是神经系统和外周组织SP的高亲和力受体[15],研究发现SP/NK1R复合物是炎症微环境重要的组成部分[16],NK1R激动剂在过敏原诱导的AD中起重要作用。NK1R敲除鼠和NK1R拮抗剂可抑制神经-炎症皮肤损伤、NK1R拮抗剂可以缓解慢性瘙痒[17],提示NK1R参与AD的发病。本研究首次用流式细胞仪技术发现AD患者外周血嗜酸性粒细胞富集群中NK1R+细胞的比例升高了41%,提示升高的血浆SP可能通过与嗜酸性粒细胞表面的NK1R结合而发挥其生物学功能,SP/NK1R复合物在AD发病机制中发挥重要作用。嗜酸性粒细胞是过敏反应的主要效应细胞之一[12],AD鼠模型SP+神经纤维附近嗜酸性粒细胞脱颗粒和SP可激活人类嗜酸性粒细胞的报道进一步证实了我们的发现[18-19]。然而,AD患者嗜酸性粒细胞表面NK1R表达升高的机制尚需进一步研究。
此外,我们还发现尘螨、梧桐花粉和蒿草花粉过敏原对AD患者嗜酸性粒细胞SP和NK1R表达的影响无统计学差异,可能提示过敏原不是通过诱导嗜酸性粒细胞分泌SP或表达NK1R参与AD。由于尘螨过敏原、艾蒿花粉过敏原和梧桐花粉过敏原对AD患者外周血非嗜酸性粒细胞SP和NK1R的表达影响不同[8],目前尚无过敏原调节嗜酸性粒细胞表达SP和NK1R的报道,因此过敏原调节SP和NK1R表达的机制尚需进一步研究,更详细的工作可能有助于发现潜在的机制。
总之,AD患者嗜酸性粒细胞NK1R表达增强,提示嗜酸性粒细胞表达的NK1R可能参与AD发病,NK1R的拮抗剂或阻断剂可能是治疗AD的有效制剂。
[1] WOLLINA U. Microbiome in atopic dermatitis[J]. Clin Cosmet Investig Dermatol, 2017, 10:51-56.
[2] NOH JY, SHIN JU, PARK CO, et al. Thymic stromal lymphopoietin regulates eosinophil migration via phosphorylation of l-plastin in atopic dermatitis[J]. Exp Dermatol, 2016, 25(11):880-886.
[3] PAVLOVIC S, LIEZMANN C, BLOIS SM, et al. Substance P is a key mediator of stress-induced protection from allergic sensitization via modified antigen presentation[J]. J Immunol, 2011, 186(2):848-855.
[4] OHMURA T, TSUNENARI I, HAYASHI T, et al. Role of substance P in an NC/Nga mouse model of atopic dermatitis-like disease[J]. Int Arch Allergy Immunol, 2004, 133(4):389-397.
[5] EBNER K, SARTORI SB, SINGEWALD N. Tachykinin receptors as therapeutic targets in stress-related disorders[J]. Curr Pharm Des, 2009, 15(14):1647-1674.
[6] STEINHOFF MS, VON MENTZER B, GEPPETTI P, et al. Tachykinins and their receptors: contributions to physiological control and the mechanisms of disease[J]. Physiol Rev, 2014, 94(1):265-301.
[7] ZHAN M, ZHENG W, JIANG Q, et al. Upregulated expression of substance P (SP) and NK1R in eczema and SP-induced mast cell accumulation[J]. Cell Biol Toxicol, 2017, 33(4):389-405.
[8] ZHANG ZN, ZHENG WJ, XIE H, et al. Up-regulated expression of substance P in CD8+ T cells and NK1R on monocytes of atopic dermatitis[J]. J Transl Med, 2017, 15(1):93.
[9] HE SH, ZHANG HY, ZENG XN, et al. Mast cells and basophils are essential for allergies: mechanisms of allergic inflammation and a proposed procedure for diagnosis[J]. Acta Pharmacol Sin, 2013, 34(10):1270-1283.
[10] HENS G, RAAP U, VANOIRBEEK J, et al. Selective nasal allergen provocation induces substance P-mediated bronchial hyperresponsiveness[J]. Am J Respir Cell Mol Biol, 2011, 44(4):517-523.
[11] LIU P, ZHAO Y, MU ZL, et al. Clinical features of adult/adolescent atopic dermatitis and Chinese criteria for atopic dermatitis[J]. Chin Med J (Engl), 2016, 129(7):757-762.
[12] FRIEDMAN S, LEVI-SCHAFFER F. Substance P and eosinophils: An itchy connection[J]. Exp Dermatol, 2015, 24(12):918-919.
[13] ZHENG W, WANG J, ZHU W, et al. Upregulated expression of substance P in basophils of the patients with chronic spontaneous urticaria: Induction of histamine release and basophil accumulation by substance P[J]. Cell Biol Toxicol, 2016, 32(3):217-228.
[14] TOYODA M, NAKAMURA M, MAKINO T, et al. Nerve growth factor and substance P are useful plasma markers of disease activity in atopic dermatitis[J]. Br J Dermatol, 2002, 147(1):71-79.
[15] GARCIA-RECIO S, GASCON P. Biological and pharmacological aspects of the NK1-receptor[J]. Biomed Res Int, 2015, 2015:495704.
[16] ROSSO M, MUNOZ M, BERGER M. The role of neurokinin-1 receptor in the microenvironment of inflammation and cancer[J]. Scientific World Journal, 2012, 2012:381434.
[17] GRUNDMANN S, STANDER S. Chronic pruritus: Clinics and treatment[J]. Ann Dermatol, 2011, 23(1):1-11.
[18] PAVLOVIC S, DANILTCHENKO M, TOBIN DJ, et al. Further exploring the brain-skin connection: Stress worsens dermatitis via substance P-dependent neurogenic inflammation in mice[J]. J Invest Dermatol, 2008, 128(2):434-446.
[19] RAAP M, RUDRICH U, STANDER S, et al. Substance P activates human eosinophils[J]. Exp Dermatol, 2015, 24(7):557-559.
