LC-MS/MS测定血液、肝组织中的欧夹竹桃苷
2018-02-26翟金晓沈保华
翟金晓,严 慧,沈 敏,沈保华,刘 伟
(1.司法鉴定科学研究院 上海市法医学重点实验室 上海市司法鉴定专业技术服务平台,上海 200063;2.济宁医学院法医学与医学检验学院,山东 济宁 272067)
夹竹桃(Nerium oleander)又名洋夹竹桃或欧洲夹竹桃,是一种夹竹桃科的常绿灌木或小乔木,具有观赏价值。夹竹桃因其毒性而闻名,也是世界上最毒的植物之一[1],人类和家畜因夹竹桃中毒甚至死亡的案(事)件时有报道[2-5]。摄入夹竹桃会产生典型的强心苷中毒临床症状[6-7],主要表现为胃肠道不适、恶心和呕吐,其次为神经系统症状,包括虚弱、精神错乱和心脏症状,通常表现为由于传导问题引起的心动过缓和房室传导阻滞导致纤颤[8]。欧夹竹桃苷是夹竹桃的主要毒性成分,属迟效强心苷类,分布于夹竹桃植物的各个部位,包括茎、叶、嫩芽、花、花蜜、树液、燃烧后的产物等[9]。欧夹竹桃苷的定量检测可以为夹竹桃中毒的判断提供直接证据[10]。
目前对体内欧夹竹桃苷的检测方法主要有薄层色谱法[11]、荧光分光光度法[12]、高效液相色谱法[13]和质谱法[14-15]。液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)结合了液相色谱分离效率高和质谱化合物鉴定功能强的优点,是分析生物样品中复杂和难以挥发的强心苷的理想方法[16]。在法庭毒物学领域,夹竹桃中毒的鉴定涉及生物检材的有效性、检测目标物的稳定性、分析方法的可靠性和灵敏性等问题,不同组织中欧夹竹桃苷的定性定量检测可为上述问题提供重要的指导信息。本研究将建立液液提取-LC-MS/MS技术检测血液、肝组织中欧夹竹桃苷的分析体系,并进行全面的方法学验证,同时将所建立的方法应用于实际夹竹桃中毒死亡案例。
1 材料与方法
1.1 材料
1.1.1 主要仪器
API 4000 Q TRAP四极杆-线性离子阱质谱仪(美国AB公司)配备AcquityTMUltra Performance LC超高效液相色谱仪(美国Waters公司),TDZ4-WS离心机(湖南赛特湘仪离心机仪器有限公司),MiniSpin®离心机(德国Eppendorf公司),DK-S22型电热恒温水浴锅(上海精宏实验设备有限公司),XW-80A涡旋混合器(上海医大仪器有限公司),HR2860搅拌机(荷兰Philips公司),Milli-Q超纯水系统(美国Millipore公司)。
1.1.2 样品与试剂
空白全血(经肝素抗凝)由上海市血液中心提供,空白肝组织为市售新鲜猪肝。
乙腈(HPLC级)、甲醇(HPLC级)和甲酸(优级纯)均购自美国Sigma-Aldrich公司,冰乙酸(分析纯)、乙醚(分析纯)购自国药集团化学试剂有限公司,超纯水由Milli-Q超纯水系统制得。欧夹竹桃苷对照品(纯度≥98%,规格为20mg)购自中国药品生物制品检定所。
1.2 实验方法
1.2.1 溶液配制
称取对照品欧夹竹桃苷10 mg于10 mL容量瓶中,精密称定,加入甲醇溶解,稀释,定容,配制成质量浓度为1mg/mL的欧夹竹桃苷甲醇储备液,置于冰箱中冷冻保存,待用。实验中所用其他浓度的对照品溶液均由上述对照品储备液稀释而得。
1.2.2 样品前处理方法
取血液1mL或肝组织(已研磨成匀浆)1g,用2mL乙醚进行提取,涡旋混合3 min,以离心半径12 cm,2 500 r/min,离心3 min。将上清液转移至另一试管中,水浴60℃下挥干。残留物中加入200 μL甲醇复溶,供LC-MS/MS分析。
1.2.3 仪器条件
色谱条件:色谱柱为Agilent ZORBAX SB-C18柱(150mm×2.1mm,5μm),前接Phenomenex保护柱;以20 mmol/L乙酸铵(含0.1%甲酸)溶液为流动相A,乙腈为流动相B,进行梯度洗脱。梯度洗脱程序见表1。流速:0.2mL/min;柱温:25℃;进样量:10μL。

表1 梯度洗脱程序 (%)
质谱条件:采用电喷雾正离子化(ESI+),多反应监测(multiple reaction monitoring,MRM)模式检测;离子源电压(IS)4500V,气帘气(CUR)25psi,雾化气(GS1) 35 psi,辅助气(GS2) 40 psi,离子源温度(TEM)500℃。
选用欧夹竹桃苷的两对母离子-子离子对进行定性分析,分别为m/z577.4/373.3、m/z577.4/355.3,将离子对m/z577.4/373.3作为定量离子对。
1.3 方法学验证
对本研究建立的LC-MS/MS分析方法进行方法学验证[17],主要包括选择性、线性、检出限(limit of detection,LOD)、定量限(limit of quantification,LOQ)、精密度、准确度、基质效应和提取回收率。
选择性:通过分析10份不同来源的空白血液和空白肝组织样品来评估该方法的选择性,以考察内源性物质对目标物检测的干扰。
线性、LOD、LOQ:采用空白血液和空白肝组织制备加标样品获得校准曲线。添加欧夹竹桃苷适量至空白血液和空白肝组织中,得到5、10、50、100、250、400、500ng/mL及20、50、200、500、1000、1600、2000ng/g的欧夹竹桃苷添加样品。通过最小二乘法拟合得线性方程(y=ax+b,y为目标物峰面积,x为目标物浓度)和相关系数。逐级降低添加样品中欧夹竹桃苷含量进行分析,直至目标物的信噪比(S/N)≥3,从而确定血液和肝组织中的LOD,并将LOQ定义为S/N≥10的目标物浓度。
精密度、准确度:分别取空白血液1 mL、空白肝组织1g各若干份,加入欧夹竹桃苷适量,制得低、中、高三个质量浓度(10、100、400 ng/mL)的血液质量控制样品及低、中、高三个质量分数(50、500、1600ng/g)的肝组织质量控制样品,每一浓度均为6份。以当日校准曲线测得各样品中欧夹竹桃苷的含量,计算各质量控制样品的准确度和日内精密度[以相对标准偏差(relative standard deviation,RSD)表示]。同法连续测定4 d,计算日间精密度。质量控制样品的精密度和准确度要求在±15%以内。
基质效应和提取回收率:分别取空白血液1mL、空白肝组织1 g各若干份,加入欧夹竹桃苷适量,制得低、中、高三个质量浓度(10、100、400 ng/mL)的血液质量控制样品及低、中、高三个质量分数(50、500、1 600 ng/g)的肝组织质量控制样品,每一浓度均为6份。按照1.2.2节方法进行样品前处理后进样分析,所得各样品目标物的峰面积为A;相同的空白基质同法处理后,在吹干的残留物中加入适量欧夹竹桃苷对照品配制成相应质量浓度的溶液,定容,进样分析,所得各样品中的峰面积为B;提取回收率=A/B×100%。另取相应质量浓度的对照品溶液,吹干后用甲醇定容后进样分析,测得目标物的峰面积为C,基质效应=B/C×100%[18]。
2 结果与讨论
2.1 色谱柱的选择
本研究前期考察了几种不同填料的色谱柱对样品进行分析,发现Restek Ultra Aqueous C18色谱柱(50mm×2.1mm,5μm)及其他规格的C18柱对样品的分离效果不理想,峰形有拖尾,而使用Agilent ZORBAX SB-C18色谱柱(150mm×2.1mm,5μm)分析时,欧夹竹桃苷峰形较窄且对称,灵敏度也较高,故本研究选择Agilent ZORBAX SB-C18色谱柱用于生物检材中欧夹竹桃苷的定性定量分析。
2.2 方法验证
选择性实验结果显示,空白样品在目标物出峰时间处无响应,以血液样品为例,空白血液的MRM色谱图见图1。空白血液中加入目标物欧夹竹桃苷(5ng/mL)后按照样品前处理方法操作,进样分析,结果见图2,欧夹竹桃苷的保留时间为4.80min。比较两者的MRM色谱图可得知空白样品中内源性基质对目标物质欧夹竹桃苷无干扰,方法的选择性良好。
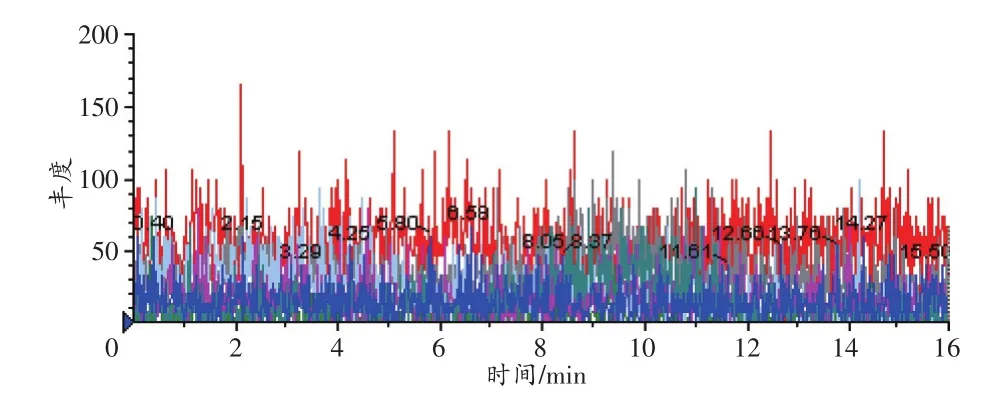
图1 空白血液样品的MRM色谱图
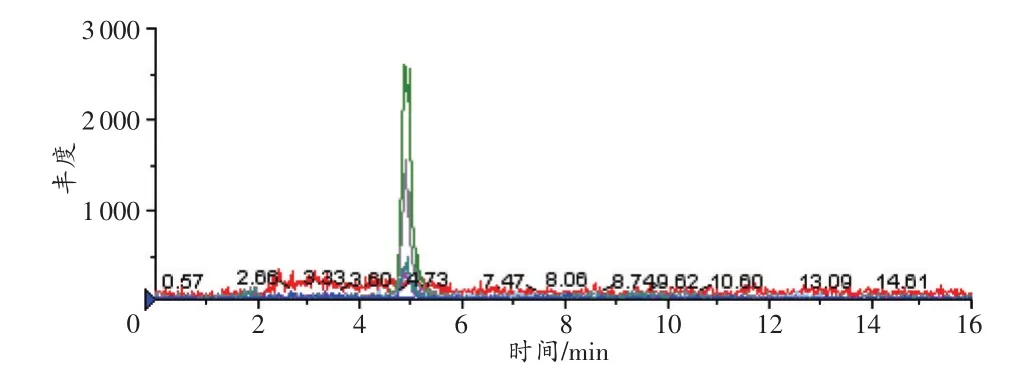
图2 空白血液中添加欧夹竹桃苷的MRM色谱图
线性、LOD、LOQ结果见表2。血液和肝组织中欧夹竹桃苷在各自的线性范围内均呈现出良好的线性。血液或肝组织的LOD低至1ng/mL或2ng/g,可满足司法鉴定实践的要求。
精密度、准确度结果见表3~4。血液及肝组织中欧夹竹桃苷准确度为98.42%~111.63%,日内精密度为2.75%~10.45%,日间精密度为5.99%~10.71%,表明该方法的准确度和精密度均满足要求。
基质效应和提取回收率结果见表3~4。各质量控制样品中的欧夹竹桃苷提取回收率均大于70.50%,表明乙醚液液提取的前处理方法可达到较满意的提取效率。基质效应范围为91.52%~106.39%,无明显基质影响。

表2 血液和肝组织中欧夹竹桃苷的线性范围、回归方程、LOD和LOQ
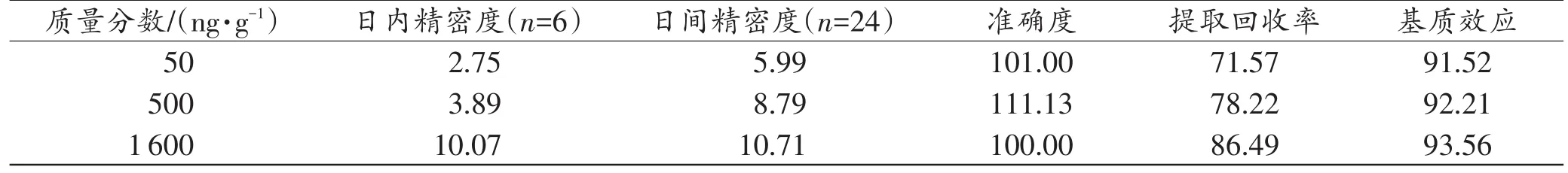
表4 肝组织中欧夹竹桃苷的精密度、准确度、提取回收率和基质效应 (%)
2.3 案例应用
2.3.1 简要案情
某女,25岁,患间歇性精神病多年,一直未得到较好的医治,病情反复发作。其父依照游医的配方将25片新鲜夹竹桃叶(图3)剪碎,用纱布包好后,用木棒捣碎,边捣边加温开水,处理约1 h,最后制得约125mL汤汁给该女服下。约20min后该女即出现恶心、呕吐等症状,并逐渐加重,呕吐不停,于服药后4.5 h死亡,期间未进行任何治疗。当地警方受理此案后,对死者进行了尸体解剖。尸体解剖见心肌点灶状出血,多器官淤血,肝细胞、脑神经元变性。采集该女的心血、尿液、肝组织、胃内容物等检材经常规毒(药)物检验结果均为阴性。

图3 新鲜的夹竹桃叶子
2.3.2 检测结果
将本研究建立的方法应用于本例疑似夹竹桃中毒案件中,对夹竹桃叶、叶渣以及死者体内的欧夹竹桃苷进行检测,各检材中欧夹竹桃苷的含量见表5。
有文献[3]报道,新鲜夹竹桃叶的致死量为20~30片。在本案例中,取夹竹桃叶剪碎、研磨,加水超声10min后按本研究所建立的方法提取进样分析,发现在夹竹桃叶片中欧夹竹桃苷含量非常高,达0.481mg/g,服用少许夹竹桃叶汤汁即可达到中毒剂量,易致死。煮后夹竹桃叶渣为本案例中的体外检材,可看出剩余的药渣中欧夹竹桃苷含量仍很高,达0.047mg/g。
由表5可以看出,在死者胃内容物中欧夹竹桃苷含量最高,为29600.0ng/g,约为夹竹桃叶含有的欧夹竹桃苷浓度的1/16,其次含量较高的生物检材是胃壁组织(13700.0ng/g),约为胃内容物中含量的一半,这可能是因为欧夹竹桃苷在口服摄入后很容易被胃肠道吸收[19]。一般情况下,死亡距摄药约4.5h时,胃内还未排空,这可能是导致胃内容物和胃壁组织含量如此之高的原因。

表5 各检材中欧夹竹桃苷的含量
本例胆汁中欧夹竹桃苷的含量为8010.0ng/mL,肝组织中为1 610.0 ng/g。肝组织是药物的主要清除器官,肝组织清除分为肝代谢和胆汁排泄两种方式。据报道[19],欧夹竹桃苷的主要排泄途径是通过胆汁排泄到粪便,所以胆汁中的欧夹竹桃苷含量高于肝组织中的欧夹竹桃苷含量,这也提示胆汁是中毒死亡案例中确认欧夹竹桃苷的较好检材。一般毒物的排泄途径除了粪便还有尿液,本例尿液中欧夹竹桃苷的质量浓度为254.0ng/mL,高于心血中欧夹竹桃苷的质量浓度(65.5ng/mL)。心血中的欧夹竹桃苷含量比其他生物检材均低,可能是灌胃给药后主要通过胆道迅速排泄[20]所致。
本案例将收集到的多种生物检材首先进行了常规毒(药)物检验,结果均为阴性,随即运用本研究所建立的方法进行夹竹桃中毒检测分析,结果在死者各生物检材中均检出较高含量的欧夹竹桃苷。尸体检验未见致命性机械性损伤和机械性窒息的尸体征象,结合案情,本例死者的死亡原因为夹竹桃中毒。
3 结 论
本研究建立了采用LC-MS/MS检测血液、肝组织中欧夹竹桃苷的分析方法,并进行了全面的方法学验证,且成功应用于实际中毒死亡案例,对多种生物检材进行定量分析。此方法操作简便、稳定性好、准确度高、灵敏度高,能满足司法鉴定对科学证据的要求。该法可应用于司法鉴定实践及临床诊断,为夹竹桃中毒的法医学鉴定提供技术支撑,为该类中毒案例的取材及结果判断提供参考信息。
