无乳链球菌耐药性及分子分型方法的研究进展
2018-02-26蔡建星赵艳坤
蔡建星,赵艳坤,王 帅,陈 贺,孙 涛
(新疆农业科学院农业质量标准与检测技术研究所 农业部农产品质量安全风险评估实验室(乌鲁木齐)新疆农产品质量安全实验室,新疆 乌鲁木齐 830091)
无乳链球菌(Streptococcusagalactiae)是一种革兰阳性细菌,是链球菌属内感染性较强、传播速度较快的病原菌,是引起奶牛乳房炎的主要病原之一[1-3]。奶牛感染S.agalactiae可以引发牛乳腺区域的乳房炎,S.agalactiae属于高度接触传染菌,能够长期降低奶牛泌乳量,还可传染给犊牛。众多S.agalactiae致病性的研究表明,新生儿感染S.agalactiae易患败血症、肺炎和脑膜炎,甚至会危及新生儿时期的生命,而且成年妇女的阴道中S.agalactiae检出情况较高。这个现象是否可以联想为动物与人之间可以互相感染,但为什么会出现感染?通过何种方式感染?带着这个疑问,查阅大量文献发现:近年来,国外西班牙、法国、美国、巴西等国家,国内甘肃、贵州、内蒙古、青海等24个地区在新生儿和病人血液中、羊奶和奶牛乳房炎乳汁中均有检出S.agalactiae,多数地区的检出率呈逐年升高趋势,给临床抗感染治疗带来极大困难[4-22]。不同动物源和人能发现相同型的S.agalactiae,且S.agalactiae耐药率有上升趋势。因此,找到S.agalactiae耐药的种类,合理更换抗菌药物,使得耐药菌株降低;找到合适的S.agalactiae分子分型的研究方法,可为后期研究S.agalactiae提供参考。
1 S.agalactiae生物学特性
S.agalactiae为芽胞杆菌纲(Bacilli)、乳杆菌目(Lactobacillales)、链球菌科(Streptococcaceae)、链球菌属(Streptococcus)的一种兼性厌氧、革兰阳性双球菌,同时也被称为B群链球菌[23-24]。在普通显微镜下,S.agalactiae呈球形或卵圆形,直径为0.5~2.0 mm,呈链状排列,短链者由4~8个细菌组成,长链者由20~30个细菌组成,有荚膜,无芽胞,无鞭毛,无运动性,有菌毛样结构,最适生长温度在37 ℃左右,最适pH约6.5,碱性环境下难以生长[25]。大部分S.agalactiae的培养特性需要较高营养成分,在普通培养基上生长状态不良;在血琼脂平板上呈绿色斑状α溶血、透明环状的β溶血或γ溶血[26-27]。生化代谢反应中产酸不产气,接触酶试验阴性,不发酵乳糖和阿拉伯糖,能发酵蔗糖、葡萄糖、麦芽糖和水杨苷,产生乳酸,6.5% NaCl试验和过氧化氢酶均为阴性,VP试验阳性,CAMP试验阳性,不分解山梨醇和七叶苷,能分解马尿酸钠、海藻糖和精氨酸;而停乳链球菌与S.agalactiae不同之处在于触酶试验和CAMP试验均为阴性,马尿酸钠试验也为阴性[28]。
2 S.agalactiae流行性致病信息
目前己发现S.agalactiae主要的致病因子包括:荚膜多糖(capsular polysaccharide,CPS)、溶血素(hemolysin)、菌毛岛屿(Pilus Island,PI)、透明质酸酶(hyaluronidase,HAase)、磷酸甘油激酶(Surface Immunogenic Protein,Pgk)和CAMP因子6种毒力因子,以及位于S.agalactiae细胞表面的蛋白:αC蛋白(αC protein ACP)、表面免疫相关蛋白(Surface Immunogenic Protein,Sip)、黏附蛋白(S.agalactiaeimmunogenic bacterial adhesion,BiBA)、纤维蛋白原结合蛋白(Fibrinogen binding proteins,Fbs)、层黏连蛋白结合蛋白(laminin-binding protein,Lmb)和纤溶酶受体蛋白(plasmin receptor protein,GapC)。S.agalactiae的毒力因子及毒力因子表达的蛋白与其致病性有着紧密的相关性,但并不是所有类型的S.agalactiae都携带相同的毒力基因。
2.1 S.agalactiae毒力因子
2.1.1 CPS CPS能编码唾液酸多糖,经过唾液酸酸化作用使S.agalactiae逃避免疫系统中巨噬细胞的吞噬,从而阻断宿主补体因子C3的沉淀和激活,延长细菌在血液中的存活时间,增强细菌的致病能力[29]。S.agalactiae存在10种血清型,其中人源、牛源S.agalactiaecpsE基因序列具有高度特异保守性,序列相似度达100%[30]。
2.1.2 溶血素 细胞溶血素是细菌分泌的能够溶解细胞的毒素,让细胞内的成分泄露到细胞外,致使细胞死亡。cylE基因是S.agalactiae溶血素的关键基因,缺失cylE基因的菌株(感染动物模型中),败血症和脑膜炎的发生明显下降[31]。
2.1.3 PI 《SCIENCE》在2005年报道了S.agalactiae具有菌毛样结构后,牛乳腺炎S.agalactiae(Bovine mastitis streptococcus agalactiae,BMSA)的菌毛结构与功能的研究成为全球关注的热点[32]。S.agalacti的菌毛位于S.agalactiae表面,参与S.agalactiae的黏附、侵袭和致病过程。研究发现由BP基因编码的菌毛骨干蛋白BP与辅助蛋白AP-1、AP-2构成完整的细胞器即菌毛。菌毛的骨干结构是BP,AP1分布在细菌表面,AP2位于菌毛顶端[33]。锡林高娃等[34]研究证明了AP1片段表达产物具有抗原反应。
2.1.4 HAase HAase是一种能特异性分解细胞外基质成分的水解酶,也是细菌致病的毒力因子之一,同时在S.agalactiae的致病机制中扮演重要的角色。但是目前对其致病机制鲜有报道。有研究发现该酶是由hylB基因编码的分泌蛋白,属于细胞外的侵袭性酶,主要是通过破坏结缔组织间质中HA,分解结缔组织的蛋白多糖使细菌易在组织中穿过而协助病原菌扩散,从而促进感染的扩散。Yildirim等[35]在猪和马分离的S.agalactiae中发现HAase活性,但在犬和猫分离的S.agalactiae中并未发现HAase。
2.1.5 Pgk Pgk是单体的、高度柔曲性的糖酵解酶的关键酶,序列具有高度保守性。有人通过做Pgk序列进化树并以此判断物种的类别及两种动物亲缘关系的远近。Hughes等[36]国外学者研究发现:Pgk蛋白具有良好的抗原性。国内学者布日额等[37]选用Pgk抗原通过间接ELISA检测牛乳腺炎S.agalactiaepgk亚单位抗原也具有良好的抗原性。
2.1.6 CAMP因子 CAMP现象:S.agalactiae特异性地增加金黄色葡萄球菌对绵羊红细胞溶解能力的现象。有学者研究发现CAMP因子在细胞膜上形成离散跨膜孔产生破坏作用,并能与神经酰胺结合,引起该处细胞膜的成分溶解,与此同时能损坏宿主抗体,削弱宿主免疫功能[38-39]。S.agalactiae的CAMP因子是由cfb基因编码的分泌蛋白(约为25.3 ku)。绝大多数文献统计:人和不同动物源分离的S.agalactiae均显示CAMP活性,但是在牛乳腺中分离的S.agalactiae没有显示CAMP活性。CAMP因子不仅具有共溶血的作用,还能通过低聚体分散在宿主细胞膜上产生作用,但是目前还没有对CAMP基因的致病原因进行研究,致病机理并不清楚。
2.2 细胞表面蛋白
2.2.1 αC蛋白 αC蛋白对介导S.agalactiae入侵宿主上皮细胞起着非常重要的作用,ACP是S.agalactiae的表面蛋白,也是宿主免疫的靶蛋白[40]。ACP通过与机体宿主细胞表面的黏多糖和整联蛋白相互作用来促进S.agalactiae入侵机体细胞。Bolduc等[41]研究发现ACP表达量下降会导致S.agalactiae向人子宫颈上皮细胞的运输减少。ACP的变量表达由bca的上游启动子序列控制,转录调控也会影响ACP的表达[42]。
2.2.2 Sip Sip为位于细菌表面的免疫相关蛋白,在S.agalactiae各种血清型中均可检测到。Brodeur 等[43]在S.agalactiae的致死感染研究中发现给小鼠注射Sip可使小鼠避免S.agalactiae多种血清型的致死;郎景民等[44]通过间接ELISA检测试验发现Sip有良好的抗原性;Shannon等[45]在临床自然感染检测发现,97%初生婴儿血液中含有Sip抗体,且有半年以上的免疫力。以上研究均证明Sip具有良好的抗原性。
2.2.3 BiBA Santi等[46]在S.agalactiae基因组序列中发现了一种新的免疫原性细菌黏附蛋白BiBA,能促进S.agalactiae吸附到机体细胞表面的作用。通过进一步研究发现,BiBA基因缺失株抗吞噬作用和存活率都会下降。Santi等[46]又用重组BiBA免疫小鼠,小鼠对S.agalactiae免疫力明显增强;分离的血清能够诱导中性粒细胞的吞噬作用,由此证明BiBA可作为一种新的S.agalactiae的候选基因。不同血清型的S.agalactiae共编码四种BiBA:包括细胞壁结合蛋白和分泌在外的游离蛋白,对这些蛋白的功能研究不够完善,尤其在乳源性S.agalactiae的表面蛋白研究方面鲜见报道。
2.2.4 FbsS.agalactiaeFbs蛋白包括FbsA和FbsB,Fbs蛋白与细胞的基质纤维蛋白原(Stroma Fibrinogen)结合;两者均是S.agalactiae的表面蛋白和重要的侵袭因子。其中FbsA是S.agalactiae主要的外膜纤维蛋白原结合蛋白,研究发现缺少FbsA的突变株,结合能力会降低,吞噬细胞的敏感性会升高;而FbsB的缺失株结合能力并无明显改变,但入侵的肺上皮细胞的能力会降低。由此说明,FbsA与机体细胞吸附有相关作用,FbsB则与入侵机体细胞有关联[47]。张雪峰[48]通过裂解S.agalactiae菌株获得表面蛋白FbsA,成功合成产物FbsA的重复16肽具有免疫记忆效应。国内学者通过克隆、原核表达方法说明FbsA同样具有较强的免疫原性和保护作用。所以具有潜在免疫原性。
2.2.5 LmbS.agalactiae与宿主细胞的结合主要是黏附因子黏连蛋白结合蛋白(34 ku)存在金属离子的结合位点,并能协调锌离子与3个高度保守的组氨酸结合形成四面体结构;Lmb与金属离子的结合和释放存在独特的结构重排[49]。Lmb基因的缺失导致S.agalactiae黏附入侵细胞的能力显著下降[50]。
2.2.6 GapC GapC是一种细胞表面脱氢酶,具有3-磷酸甘油醛脱氢酶(GAPDH)活性,能与血纤维蛋白溶酶结合,在信号传导和疾病发生的过程中起着关键作用。该蛋白被认为是疫苗制备的良好靶位点。
3 S.agalactiae耐药研究现状
3.1 S.agalactiae国内外流行情况
在国内,邓海平等[4]在甘肃、贵州等地奶牛乳房炎乳样中检出4株S.agalactiae,分离率为2.12%(4/189);杜琳[5]在内蒙古奶牛乳房炎乳样中检出分离得到22株S.agalactiae,分离率为7.38%(22/298);刘琪等[6]在内蒙古奶牛乳房炎乳样中分离了24株链球菌,分离率为7.27%(24/330)。在国外,Garnica等[19]在西班牙羊奶中分离出13株S.agalactiae,分离率为28.89%(13/45);Pimentel等[20]在巴西、印尼、里约热内卢等地癌症病人血液中分离263株S.agalactiae,分离率达72.25%(263/364);Hraoui等[21]在法国新生儿生殖标本、胃液或耳朵标本分离鉴定出226株S.agalactiae;Bergal等[22]在美国人的阴道和血液样本中分离出93株S.agalactiae。
S.agalactiae引起的奶牛乳房炎在丹麦、挪威的发生频率高于其他国家[51-52],而在中国已成为最常见的诊断奶牛亚临床乳腺炎的病原菌[53]。通过国内外S.agalactiae文献分析,在整体水平上S.agalactiae的分离率国外高于国内,且在新生儿以及患病人源检出较高。
3.2 S.agalactiae耐药研究现状
S.agalactiae的生物学特性与链球菌属近似,S.agalactiae和链球菌在近8年(2010年至2017年)的时间对11大类抗菌药物中19种药物耐药性的数据可以分析S.agalactiae耐药的研究现状。从不同地区来看,国内已经对23个地区进行S.agalactiae耐药性检测。其中华北地区对11大类中11种抗菌药物耐药性进行检测,耐药率极低,仅对庆大霉素和四环素耐药,耐药率4.6%和77.3%,其余9种抗菌药物检出率为0;广西地区对11大类中10种抗菌药物耐药性进行检测,耐药率在0%~90%;宁夏、上海和杭州3个地区对8种抗菌药物进行检测,其中宁夏地区8种抗菌药物中有6种抗菌药物的耐药率≥50%,比上海和杭州地区耐药情况严重;在青海、苏州、北京、甘肃、内蒙地区分别对5种、4种、6种、6种和7种抗菌药物进行耐药检测,检测情况相对较低。从多个地区来看,对9地(兰州、北京、呼和浩特、哈尔滨、成都、长沙、济南、广州和贵阳)15种抗菌药物中5种抗菌药物的耐药率≥50%,耐药情况比较严重;对6地(兰州、宁夏、陕西、天津、重庆和青岛)13种抗菌药物中5种抗菌药物的耐药率≥50%,耐药情况也比较严重;对2地(甘肃和贵州)和4地(内蒙古、甘肃、四川和上海)分别对8种抗菌药物进行检测,耐药率相对不高。
从抗菌药物种类来看,2010年至2017年,对β-内酰胺类(青霉素、阿莫西林、头孢赛肟、氨苄青霉素和头孢唑啉)5种抗菌药物的检测相对较多,耐药率最高,2011、2012年两年中4次达到100%;对喹诺酮类(左氧氟沙星、环丙沙星和恩诺沙星)耐药率≤50%;林可胺类(克林霉素)抗菌药物检出较少,耐药率达0~50%;氨基糖苷类抗菌药物(卡那霉素和庆大霉素)的耐药率50%以上居多;酰胺醇类(氟苯尼考和氯霉素),2002年国家已经下令禁止对所有食用动物使用氯霉素,但作为氯霉素的衍生物氟苯尼考,氟苯尼考的耐药率较高为14%~90%;安沙霉素类(复方新诺明)和恶唑烷酮类(利奈唑胺)抗菌药物的检出较少,耐药率非常低;头孢类(头孢拉定)耐药率在55%以下;四环素类(四环素)的耐药率在50%~88.3%居多,耐药情况较为严重;大环内酯类(红霉素)的耐药率在50%以上较高,检出情况比较严重(表1)。

表1 2010年至2017年无乳链球菌对临床常用19种抗菌药物耐药结果(%)Table 1 Streptococcus agalactiaeis resistance to 19 commonly used antibiotics in 2010-2017 year(%)
注:“-”表示无检测值;2地:甘肃和贵州两个地区;4地:内蒙古、甘肃、四川和上海4个地区;9地:兰州、北京、呼和浩特、哈尔滨、成都、长沙、济南、广州和贵阳9个地区;6地:兰州、宁夏、陕西、天津、重庆和青岛6个地区
3.3 无乳链球菌耐药基因和毒力基因研究概况
2010年至2017年,通过大部分文献统计得到无乳链球菌对8类抗菌药物的20个耐药基因,包括:β-内酰胺类耐药基因pbp2b,喹诺酮类耐药基因gyrA、parC,林可胺类耐药基因lunB,氨基糖苷类耐药基因aadE,磺胺类耐药基因sul1、sul2、sul3,四环素类耐药基因mefE、tetM、tetO、tetK、tetL、tetE,大环内酯类耐药基因ermB、ermC、ermTR、erm33、mefA和lsaE,其中四环素和红霉素耐药基因检出较多。苏锦珍等[54]和刘镜光等[55]对深圳市2008年至2015年分离的人源无乳链球菌进行耐药性研究,发现细菌对红霉素、克林霉素的耐药性高,耐药基因检测发现红霉素耐药基因ermA、ermB、ermC、mefA、ermTR等和四环素耐药基因tetM、tetK、tetS、tetT、tetL、tetO,并且耐药基因数量有逐年增加的趋势。
以上耐药基因中不同的耐药基因产生耐药性的原因是不尽相同的,通过不同的耐药原因可分为5种:gyrA、parC、lunB、aadE、ermB、ermC、ermTR、erm33和lsaE主要通过药物靶位改变产生耐药性;mefA、mefE、aadE、tetM、tetO、tetK、tetL、tetE、ermB、ermC、ermTR、erm33和lsaE基因主要通过主动外排泵对抗菌药物产生耐药性;pbp2b基因主要通过改变自身受体产生抗药性;sul1、sul2、sul3、tetM、tetO、tetK、tetL和tetE基因主要是由于形成灭活酶或钝化酶产生耐药性;ermB、ermC、ermTR、erm33、lsaE、aadE、tetM、tetO、tetK、tetL和tetE通过核糖体结合蛋白位点的变化产生抗药性,详见表2。
针对七大类抗菌药物进行检测,并没有对安沙霉素类耐药基因、恶唑烷酮类、酰胺醇类和头孢类四大类抗菌药物进行检测,后期研究可针对此类耐药基因进行深入研究。
大部分研究学者已对无乳链球菌12种毒力基因进行检测,β溶血素cyl,αC蛋白bca,C5a肽酶scpB,层黏连蛋白结合蛋白lmb,谷氨酰胺合成酶glnA,CAMP因子cfb,透明质酸酶hylB,βC蛋白bac,细菌免疫原性黏附素bibA,侵袭相关基因iagA,纤维蛋白结合蛋白BfbsB,β溶血素/溶细胞素clyE。其中9种毒力基因的检出率达50%以上,毒力基因的种类以及检出率相对是比较高的,详见表3。
近些年来,随着研究的不断深入,人们对细菌耐药性和毒力基因之间的关系有了一些新的发现。Padilla等[56]研究表明,敲除acrAB的肺炎克雷伯菌菌株在引起肺炎鼠模型中表现出较野生菌株低的致病力,提示外排泵不仅能够导致细菌耐药性的增加,同时也增强了其致病性。细菌的耐药性和毒力之间存在一定的关系,但有关细菌毒力与耐药之间存在什么样的机制还有待进一步研究。
3.4 无乳链球菌体外诱导耐药的研究进展
体外逐渐增加药物浓度诱导细菌耐药的方法广泛用于实验室细菌耐药性研究。细菌长期存在于含有抗菌药物的环境中,将会获得相应的耐药基因或发生基因突变,从而导致耐药菌的产生。席瑞等[57]采用多步诱导法成功诱导出对利奈唑胺耐药的肠球菌,并得出耐药机制与23S rRNA基因的点突变有关。张涛等[58]采用体外逐步增加药物浓度的方法,推测可能通过诱导耐药,细菌的细胞壁增厚产生耐药性。国内外针对无乳链球菌耐药的传播机制研究罕见报道,丁月霞[59]通过诱导耐药试验获得仅耐红霉素的肺炎链球菌标准菌株ATCC49619-ERY,结合质粒接合试验,生成了四环素耐药的接合子。从基因水平转移方面诠释了细菌耐药性传播机制。

表2 无乳链球菌耐药机制分类Table 2 Drug resistance mechanism classification of Streptococcus agalactiaeis
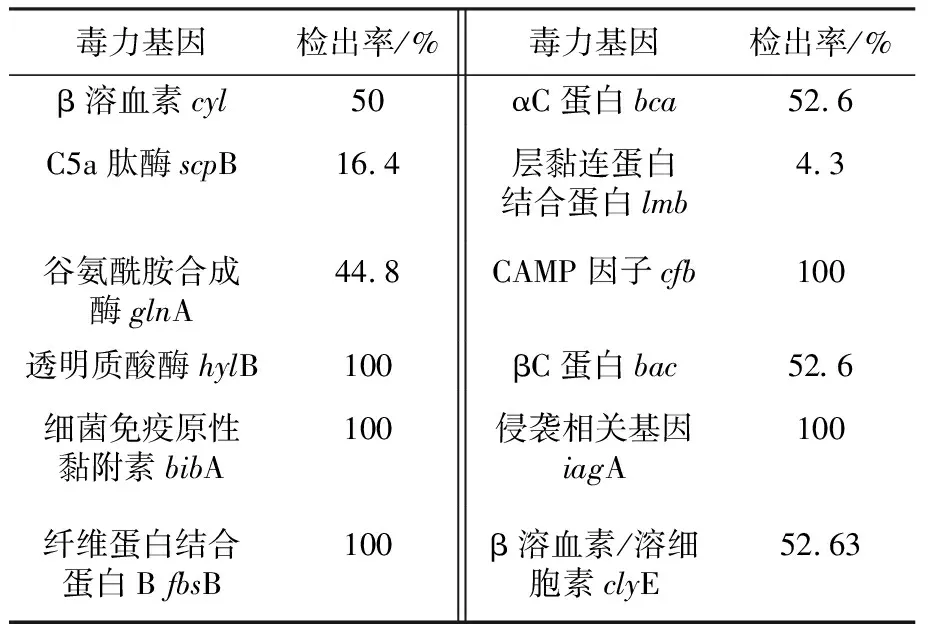
表3 无乳链球菌毒力基因检出情况Table 3 Detection status of Streptococcus agalactiaeis virulence genes
4 S.agalactiae分子分型方法研究进展
通过分子生物学方法调查动物源S.agalactiae的分子流行病学,了解其主要流行的血清型;通过多位点序列(Multilocus Sequence Typing,MLST)分型、脉冲场凝胶电泳(Pulsed-field Gel Electrophoresis,PFGE)分型、前噬菌体分型、菌毛岛屿分型等多种分子分型方法来分析其菌株多样性,探究其流行株的基因型,为S.agalactiae病的科学防控奠定基础。
4.1 血清型分型
传统的S.agalactiae血清型检测是利用细菌荚膜多糖与其特异性抗体发生反应来判别对应的血清型,但是该方法操作复杂,耗时较长,需要对应血清型的血清抗体且成本较高,S.agalactiaeⅨ型血清抗体并没有商品化难以用此方法进行鉴定,而且S.agalactiae荚膜多糖在某些特定的条件下可能不表达,传统方法不能区分S.agalactiae荚膜多糖缺失和荚膜多糖抗原浓度太低而导致的阴性结果[19]。用分子生物学方法鉴定S.agalactiae血清型,能快速准确检测出S.agalactiae的荚膜多糖血清型,弥补了传统血清型检测方法的不足。Kong等[60]利用PCR方法鉴定S.agalactiaecps、alp2、alp3、bac、rib、bca等表面蛋白基因,利用表面蛋白基因结合血清亚型把224株S.agalactiae分成了31个血清型变种,发现不同的血清型菌株和某些表面蛋白基因具有密切联系,为S.agalactiae血清亚型的分析提供了新的研究思路。同时他们对分离的206株S.agalactiae采用PCR方法和传统血清型检测方法进行对比检测,发现PCR方法的分型结果和传统方法的结果完全一致,证明了分子生物学方法可以替代传统血清型检测方法。
根据S.agalactiae荚膜多糖基因簇的差异性,分为10种血清型(Ia、Ib、II-IX型)[61]。S.agalactiae血清型分型,在罗非鱼中的研究较多,人源也有部分研究。大部分研究表明广东、广西、海南、福建和云南等地主要流行的是罗非鱼源Ia血清型;广东、广西和海南等局部地区主要流行的是Ib型S.agalactiae;广西等局部地区流行的是III型S.agalactiae[62-64]。目前,中国、泰国、越南、美国和巴西等国家广泛流行的是罗非鱼源Ia型S.agalactiae[65-67]。同样,在中国、洪都拉斯[68]、厄瓜多尔[69]、比利时[70-71]、巴西[72]、哥伦比亚[73]、哥斯达黎加[70]等国家均有罗非鱼源Ib型S.agalactiae的流行记录。罗非鱼源III型S.agalactiae在泰国、越南也有发现。在泰国,目前已报道的主要流行菌株是Ia型,其次是III型[74-75]。Chen等[76]报道人源Ia、III和V血清型S.agalactiae能够感染罗非鱼,但在不同鱼源S.agalactiae之间是否存在交叉感染情况还有待进一步研究。
4.2 MLST
MLST分型方法最大的优点就是具有全球共享MLST数据库,通过上传MLST实验数据到MLST数据库可以实现分型数据共享,从而进行全球范围内的细菌ST型比对[77]。如今,细菌基因组测序技术已非常成熟,MLST基因序列检测的成本不断降低,加之细菌MLST分型实验操作简便,实验结果分辨率高,已成为各类病原菌大范围长期的分子流行病学研究的首选方法。
MLST通过测序分析细菌多个管家基因的核酸序列,从而对细菌基因组等位基因的多态性进行比较。细菌所有管家基因的等位基因组合起来形成等位基因图谱,将每个等位基因图谱型对应一个相应的序列型(Sequence typing,ST),分析比对细菌ST型,具有相同ST型或者仅有一两个基因座不同的细菌具有密切的相关性[78]。张雨薇等[79]在感染罗非鱼和黄河裸裂尻鱼的S.agalactiae中均分离到ST-891型菌株,是中国罗非鱼源S.agalactiae新发现的ST型菌株。Brochet等[80]收集世界各地75株S.agalactiae(包括妇女、儿童、奶牛、狗、猫和鳟鱼),人源S.agalactiae具有丰富的ST型,其中ST-17型菌株的比例最高,牛源菌株均为ST-8型(3株),狗源S.agalactiae为ST-1型,在巴黎分离到的人源S.agalactiae也主要是ST-1型,分离自猫和兔子的S.agalactiae同属于ST-19型,鳟鱼源S.agalactiae为ST-246型;进一步分析发现,MLST在细菌流行地域分析上具有很大的优势;同时还发现相同的宿主源在同一地区不同流行时间的S.agalactiae也出现了ST型的变迁。
4.3 PFGE
PFGE方法常被认为是细菌分子流行病学研究的“金标准”,主要是对细菌的基因片段分型[81-82]。经过比对发现,PFGE分型具有更高的辨识度,能分辨出的基因差异更大;而MLST分型可操控能力更强,数据的重复性更好,若将两种方法结合使用,能更全面的反应细菌的分子流行特征。
PFGE分型已经普遍用于对罗非鱼源S.agalactiae分子流行病学的分析。广东等地区的主要流行菌株有多个PFGE基因型,方伟等[83]对广东地区罗非鱼源146株S.agalactiae进行PFGE分型,可分成6种遗传簇,不同地区的流行菌株具有相同的PFGE型,具有交叉感染的可能性。李莉萍等[84]对广西地区罗非鱼源无乳菌进行鉴定和脉冲场凝胶电泳聚类分析发现2006年至2011年94.7%的流行菌株为海豚链球菌,2012年以后96.6%的流行菌株为S.agalactiae;海豚链球菌存在4种PFGE带型,带型相似度高;S.agalactiae有5种PFGE带型,相似度为47.4%~100%;各个地区流行菌株的PFGE带型差异明显。广东等地区的主要流行菌株都有多个PFGE基因型,李莉萍等[85]对2009年至2011年67株罗非鱼源S.agalactiae进行PFGE分型,没有发现同一基因型的菌株,表明67株S.agalactiae流行菌株比较复杂且流行的优势菌群存在差异。
4.4 菌毛岛屿分型
菌毛岛屿分型方法是利用菌毛基因组的菌毛岛屿结构分类,该方法在研究较为成熟的国内罗非鱼中鲜有报道,适合在临床科研使用,不适合在临床实验室广泛使用。
菌毛在细菌黏附和入侵宿主细胞的过程中发挥重要作用,而且与细菌生物膜的形成密切相关。菌毛结构是由:骨架蛋白(Bone Protein,BP)和位于骨架顶端或基底部的菌毛辅助蛋白(Ancillary Protein,AP)AP1和AP2在分选酶(Sortase,Srt)的作用下组装而成[86]。S.agalactiae有3种类型的菌毛:PI-1、PI-2a和PI-2b,三者分别对应基因组3个菌毛岛屿,每种菌毛岛屿蛋白由5种菌毛岛屿基因(菌毛辅助蛋白基因AP1和AP2)调控,一般情况下S.agalactiae至少存在一个菌毛岛屿结构[87]。不同的菌毛岛屿其功能也不尽相同,PI-1可能与S.agalactiae在宿主体内的免疫逃逸相关,PI-2b菌毛岛屿则与S.agalactiae黏附和入侵宿主细胞能力密切相关[88]。对印度和美国流行的S.agalactiae菌毛岛屿进行分析比较,发现印度流行的人源S.agalactiae菌毛岛屿类型是PI-1+PI-2b型,构建菌毛蛋白缺失的S.agalactiae突变菌株,发现其黏附力和入侵宿主的能力较正常菌株出现大幅降低[89]。
4.5 细菌前噬菌体基因分型
细菌前噬菌体基因分型是利用细菌基因组进行检测,该方法在研究较为成熟的国内少有报道,适合在临床科研使用,不适合在临床实验室广泛使用。
噬菌体(bacteriophage)是能感染杀死细菌、真菌及螺旋体等微生物的一种病毒[90]。温和性噬菌体能将自身基因组整合于宿主细菌基因组中进行复制及传代,与宿主菌之间是寄生关系;这种整合于宿主菌基因组中的噬菌体则为前噬菌体,研究发现约65%的细菌基因组中携带有前噬菌体[91]。Schmieger等[92]对173株伤寒沙门氏菌菌株进行前噬菌体检测,发现78.6%的菌株携带有前噬菌体。Tang等[93]对12株猪链球菌进行基因组序列分型检测出5种前噬菌体基因类型。
5 展 望
本文主要从S.agalactiae流行性致病信息、S.agalactiae耐药性和分子分型方法的优缺点三方面对S.agalactiae目前的研究现状进行了阐述和分析,从β-内酰胺类抗菌药物和优化分子分型方法两方面进行展望。
S.agalactiae对β-内酰胺类抗菌药物的研究主要集中在耐药基因、毒力基因以及分子分型方法方面的研究,对其耐药机制研究甚少。建议下一步工作可针对β-内酰胺类抗菌药物耐药机制找到新的突破口,开发S.agalactiae治疗的新型药物,为临床合理用药、优化治疗方案提供重要的科学依据。
理想的分子分型方法需要满足以下条件:操作简单、高效;实验结果重复性好;适用范围广,实用性较强。而S.agalactiae分子分型方法相对较多,各有优缺点,离理想的分子分型方法还有一定的距离,优化S.agalactiae检测、分型的方法显得尤其重要。优化好S.agalactiae最佳方法可为临床实验室检测提供更加合理、高效的检测手段,同时也能为S.agalactiae的感染控制和临床诊断提供便捷服务。
