异源表达海苏特氏菌Argonaute蛋白基因提高酿酒酵母脂肪酸含量研究
2018-02-26张晓伟郭敏瑞郭慧静陈国刚
张晓伟,郭敏瑞,郭慧静,陈国刚
(石河子大学 食品学院,新疆 石河子 832000)
Argonaute蛋白在小RNA分子(siRNA、piRNA、miRNA)沉默通路中起到重要的作用,它是RNA诱导的沉默复合物(RISC)的核心成分[1]。成熟的小RNA需要被结合到Argonaute蛋白以及其他相关蛋白质上形成RNA诱导的RISC[2]。RISC可以催化小RNA去抑制mRNA的翻译或者直接降解靶mRNA,从而实现小RNA的生理功能[3]。目前研究发现,Argonaute蛋白广泛存在于生物界中,是高度保守的一类蛋白质[4]。Argonaute蛋白质通常由N末端、PAZ、MID和PIWI 4个结构域组成,主要结构域是PAZ和PIWI。PAZ结构域含有110个氨基酸,结合到siRNA的3′的二核苷酸突出端,是小RNA的结合位点[5-6]。尽管大多数种类的小RNA在一定程度上都能和不同类型的Argonaute蛋白结合,但特定的小RNA与特定的Argonaute蛋白结合更容易[7]。PIWI结构域是一类生殖系细胞专一性蛋白,是Argonaute蛋白家族行使切割功能的活性中心,一些Argonaute蛋白质的PIWI结构域赋予slicer以内切酶的活性,切割并降解靶mRNA[8]。Argonaute蛋白的作用非常广泛而且极其重要,目前Argonaute蛋白的基本结构、功能和作用机制已经成为研究热点。Argonaute蛋白家族不仅分布的数量和种类具有物种差异性,而且成员之间所发挥的生物学功能也具有特异性[9]。根据温剑[10]的研究,作为真核生物的代表,酿酒酵母体内已经发现了近32种miRNA分子,这些小RNA分子中的大多数可能与动植物细胞中的小RNA一样,也是通过与Argonaute蛋白结合作用靶mRNA来影响mRNA的稳定性或翻译,进一步调控生物体的基因表达。但研究人员发现,作为RISC核心物质存在的Dicer酶和Argonaute蛋白在酿酒酵母中是没有的[11],因此本研究将海洋细菌Argonaute蛋白基因在酿酒酵母细胞中进行表达,用以研究海洋细菌Argonaute蛋白的功能。相关研究表明,在动物体中,小RNA中的成员miRNAs参与了脂肪细胞分化、脂代谢等多种生物过程调控,而其自身也受到转录因子、脂肪细胞因子和环境因子等调控[12],但这些具有调控功能的小RNA通常都是和相关蛋白质结合而发挥其功能,因此Argonaute蛋白很可能参与脂肪酸代谢通路的调控过程。Argonaute蛋白作为RISC的关键蛋白在所有已知的小RNA沉默通路中起到关键作用。在动植物中,Argonaute蛋白还具有切割活性,能抑制靶mRNA的翻译,在转录和转录后层面具有调控作用[13]。由此可见,无论是在复杂或简单的生物体中,Argonaute蛋白和小RNA的相互作用都是普遍存在且具有特殊功能的。多种动植物和真菌的Argonaute蛋白基因已被克隆并验证了功能,并且已有的研究主要集中在高等的动植物中[14-15]。目前,关于海洋细菌的Argonaute蛋白功能性研究鲜有报道,尤其是海洋细菌Argonaute蛋白能否通过与miRNA结合从而对脂肪酸代谢产生调控作用还尚未被研究。海苏特氏菌(Joostellamarina)是一种从海水中分离出来的海洋细菌,其基因组中包含Argonaute蛋白基因。为了克隆和表达Jm-Argonaute蛋白基因并验证其对酿酒酵母脂肪酸的影响,本研究克隆了含有SIR2和Piwi结构域的海苏特氏菌Argonaute蛋白基因,并构建基因表达载体转化至酿酒酵母BY4742细胞进行表达,分析该蛋白对酵母脂肪酸含量和种类的影响。实验结果为研究Argonaute蛋白提供了新的思路,也为进一步探究Argonaute蛋白在酿酒酵母脂肪酸合成和分解代谢过程中的作用,进而为应用基因工程技术改造酿酒酵母脂肪酸代谢途径,用以生产油脂的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒以及引物设计 海苏特氏菌(Joostellamarina)购自中国普通微生物菌种保藏管理中心,按照说明书复苏并活化菌株,使用海洋细菌培养基2216E在30 ℃条件下培养。酿酒酵母细胞表达载体pCRCT由本实验室保存。所有的大肠埃希菌DH5α感受态细胞均购自青岛擎科生物技术有限公司,酿酒酵母细胞BY4742由国家海洋局第一海洋研究所馈赠。研究中所涉及到

表1 菌株和质粒Table 1 Strains and plasmids
的野生型菌株、重组菌株以及原始质粒和重组质粒均由本实验室完成,由青岛擎科生物技术有限公司测序验证正确性,结果如表1所示。实验过程中用到的引物均由本实验室自己设计,由青岛擎科生物技术有限公司合成,引物序列如表2所示。

表2 实验中用到的所有引物Table 2 All of the primers used in this study
1.1.2 培养基 所有的大肠埃希菌DH5α(TSINGKE China)均用LB液体培养基(蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L)在37 ℃下培养,并按照剂量要求加入100 mg/L的氨苄抗生素。酿酒酵母BY4742(国家海洋局第一海洋研究所馈赠)保种从-80 ℃取出,并转接至5 mL YPD液体培养基(葡萄糖 20 g/L,蛋白胨20 g/L,酵母膏10 g/L)过夜活化。然后转接2 mL菌液至100 mL YPD液体培养基中,将突变菌株与对照组OD600 nm值调节至0.2,30 ℃、250 r/min摇床培养72 h,通过离心和冷冻干燥收集细胞,-20 ℃保存备用。URA缺陷型液体培养基:0.8 g/mL URA,调节pH值至6~6.5,灭菌后加入质量分数为5%的葡萄糖。
1.1.3 试剂与仪器TaqDNA聚合酶T5,高保真DNA聚合酶I5均购自TaKaRa公司;细菌DNA提取试剂盒、细菌质粒小提试剂盒、酵母细胞质粒提取试剂盒、胶回收试剂盒均购自Omega公司;无缝克隆试剂盒购自青岛擎科生物技术有限公司;DNA maker、蛋白maker、酵母提取物、胰蛋白胨、琼脂糖等购自青岛瑞德合益商贸有限公司;其他化学试剂均为分析纯和色谱纯购自国药。基因脉冲电转仪(BIO-RAD,USA)。
1.2 方法
1.2.1 Jm-Argonaute基因克隆与表达载体的构建 依据NCBI上已有的海苏特氏菌Argonaute蛋白基因,使用primer5.0软件设计P1、P2、P3和P4四种PCR引物并送至青岛擎科生物技术有限公司合成。使用细菌DNA试剂盒提取海苏特氏菌基因组DNA作为模板,进行巢式PCR扩增目的基因,设计引物为目的基因两端添加核定位信号,并组装各表达原件,最后使用Hieff CloneTM一步PCR无缝克隆试剂盒将重叠PCR的产物TEF1-Jm-Argonaute-ADH2组装到pZMG中,得到pZMG-Jm-Argonaute基因表达载体。
1.2.2 重组质粒的电转化 按照基因脉冲电转仪说明书,制备酿酒酵母BY4742感受态细胞,准备用于电转化。随后将构建成功的重组质粒pZMG加入到含有酿酒酵母BY4742感受态细胞的1.5 mL微量离心管中,使用基因脉冲电转仪调节至真核细胞脉冲参数后对混合后的样品进行电击,脉冲电击一次后,立即加预冷1 mL山梨醇复苏酿酒酵母BY4742细胞,同时做对照,30 ℃孵育1 h后涂板30 ℃过夜培养,用于挑选阳性克隆测序鉴定。
1.2.3 海苏特氏菌Argonaute蛋白基因的生物学信息分析 使用引物P1和P2扩增海苏特氏菌基因组得到3 165 bp的CDS区片段,经测序鉴定序列正确后与其他生物Argonaute蛋白序列进行多重序列比对,利用SMART数据库在线分析海苏特氏菌Argonaute蛋白序列的结构域。
1.2.4 重组菌株海苏Argonaute蛋白的表达 将鉴定成功的重组菌株单克隆接种于20 mL URA缺陷型液体培养基(含5%的葡萄糖)中,置于恒温培养箱30 ℃培养12 h。待OD600值达到2.0后取5 mL转接至100 mL URA缺陷型液体培养基中扩大培养(30 ℃、180 r/min摇床培养72 h),取10 mL发酵菌液超声破碎(功率30 kW)处理,4 ℃、8 000 r/min离心5 min后分别取上清和沉淀用于SDS-PAGE电泳检测。
1.2.5 重组菌株脂肪酸的GC-MS分析 将含有原始质粒pCRCT和重组质粒pCRCT-Jm-Argonaute的菌株转接至URA缺陷型液体培养基中,将两组OD600值调为0.2左右后再同时于30 ℃、200 r/min摇床培养72 h,离心并收集菌液,冷冻干燥后置于-20 ℃保存,用于脂肪酸的测定。参考Leber等[16]方法提取两株菌的脂肪酸送GC-MS上机检测,GC-MS分析所得脂肪酸含量数据均使用成对样本均值分析t检验计算样本间的显著性差异。
2 结果与分析
2.1 海苏特氏菌Argonaute蛋白基因的克隆与载体的构建
从海苏特氏菌中克隆了Argonaute蛋白基因,随后通过巢式扩增得到了海苏特氏菌Argonaute蛋白基因的编码区,产物通过琼脂糖凝胶电泳检测,与预期大小3 156 bp一致。NCBI比对分析表明该基因包括SIR2 和 Piwi_piwi-like_ProArk结构域。对片段长度为3 156 bp的海苏特氏菌Argonaute蛋白基因进行扩增和测序验证。使用DNA man软件分析表明,海苏特氏菌Argonaute蛋白基因编码1 052 bp氨基酸的蛋白质,分子量约为121.467 kDa。利用Hieff CloneTM一步PCR无缝克隆试剂盒将TEF1-Jm-Argonaute-ADH2组装到pZMG中,得到pZMG-Jm-Argonaute基因表达载体,通过测序验证载体序列正确无突变位点。
2.2 海苏特氏菌Argonaute蛋白基因多重序列比对及结构域分析
利用GeneBank对海苏特氏菌Argonaute蛋白及其同源序列进行BLAST比对,为了发现海苏特氏菌Argonaute蛋白与其他Argonaute蛋白家族的关系,将各类Argonaute蛋白家族的代表性成员与其进行多重序列比对,使用Clustal-W进行所有Argonaute蛋白质序列比对,通过邻接方法,用MEGA v5软件分析,基于序列比对构建了来自植物、动物、真菌和其他代表性Argonaute蛋白的系统发育树,结果表明海苏特氏菌Argonaute蛋白与动植物以及真菌类Argonaute蛋白亲缘关系较远,属于某些细菌类蛋白家族,这也证明Argonaute蛋白在进化上是高度保守的(图1)。
蛋白结构域在线分析软件SMART分析表明,海苏特氏菌Argonaute蛋白不仅具有Argonaute蛋白行使切割活性的Piwi结构域,还具有与寿命通路和基因沉默机制相关的SIR2结构域,并且其已被证明可调节基因沉默、DNA修复及酶的代谢。其中研究最多的功能是基因沉默,包括调控关键基因、使染色体结构域失活、将其包装成DNA结合蛋白不可接近的专门染色质的结构等[17]。
2.3 重组菌株目的蛋白的表达
将构建好的重组载体pZMG-Jm-Argonaute电转化至酿酒酵母BY4742感受态细胞中,培养一定时间后,分别取上清液和超声破碎后的沉淀用于SDS-PAGE检测,发现沉淀中有1条分子量为120 kD左右的蛋白条带(见图2),与目的蛋白分子量一致,而上清液中无特异性条带,这是海苏特氏菌Argonaute蛋白基因两端核定位信号引导的结果,对照菌株无特异性条带,证明pZMG-Jm-Argonaute蛋白在核定位信号的引导下成功在酿酒酵母BY4742细胞内特异性表达。

图1 Jm-Argonaute蛋白结构域图示及进化树分析Fig.1 Jm-Argonaute protein domain and phylogenetic tree analysisA:Jm-Argonaute蛋白结构域: Jm-Argonaute protein结构域包括了SIR2和Piwi-like亚结构域;B:与其他Argonaute蛋白家族的系统发育分析: 包括来自NCBI BLAST 的拟南芥Argonaute蛋白(8),秀丽隐杆线虫Argonaute蛋白(5)和其他文献中讨论的Argonaute蛋白。 进化树被分为5组( ■ 拟南芥、 ◆ 秀丽隐杆线虫、△ Piwi、● 原核和原始真核生物、○ Jm-Argonaute蛋白)。系统发育树显示了Jm-Argonaute蛋白质与其他Argonaute蛋白家族的关系A:Jm-Argonaute protein domain: Jm-Argonaute protein domain includes both SIR2 and Piwi-like superfamily domains;B:phylogenetic analysis of other Argonaute protein families: Included are Argonaute proteins found using NCBI BLAST from Arabidopsis (eight),Caenorhabditis elegans (five) and others discussed in the literature.The tree has been divided into four groups ( ■Arabidopsis,◆C.elegans-specific,△Piwi,●prokaryote and primitive eukaryote,and ○Jm-Argonaute protein family).Phylogenetic tree indicating the relationship of Jm-Argonaute protein relative to other Argonaute protein families
2.4 重组菌株脂肪酸成分和含量
在计算酿酒酵母BY4742的脂肪酸含量之前,通过测量37种饱和、不饱和脂肪酸甲酯混合物建立了标准曲线,酿酒酵母中脂肪酸主要以合成C14∶0、C16∶0、C16∶1和C18∶1为主[18]。实验结果表明,重组菌株和对照菌株都包含C12∶0、C14∶0、C16∶0、C16∶1 、C18∶0 和C18∶1脂肪酸,这表明Argonaute基因没有改变酿酒酵母BY4742脂肪酸的种类。
为了清晰地了解海苏特氏菌Argonaute蛋白对脂肪酸代谢的影响,使用GC-MS分析了重组菌株和对照菌株的脂肪酸成分和含量(表3和图3),与带有原始载体的对照菌株相比,重组菌株具有更高的总脂肪酸含量,达到98.8 mg/g。t-检验结果表明2株菌在脂肪酸含量上具有显著性差异(P(T<=t)=0.017<0.05),同时不饱和脂肪酸C16∶1的含量提高得最多,具有显著性差异(P(T<=t)=0.013<0.05)。综上所述,发现海苏特氏菌Argonaute蛋白对酿酒酵母脂肪酸含量的提高起到了调控作用,并且主要提高的是不饱和脂肪酸C16∶1的含量。

图2 海苏特氏菌Argonaute蛋白表达Fig.2 Induced expression of Argonaute protein from Joostella marina1.61代表对照菌株;海苏代表重组菌株;两者表达条件一致1.61 represents the control strain,D represents the mutant strain,and the expression of both is consistent
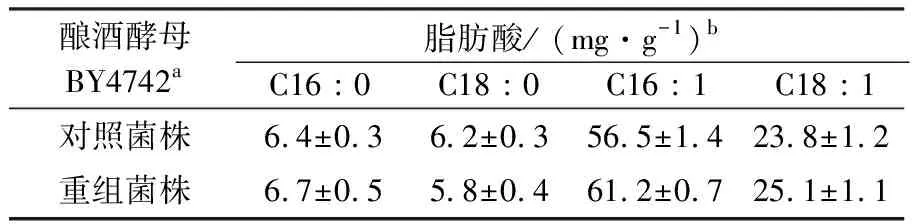
表3 Jm-Argonaute对酿酒酵母BY4742成分和含量的影响Table 3 Affection of Jm-Argonaute on the composition and content of S.cerevisiae BY4742
注:a代表100 mg的干燥粉末样品用于计算脂肪酸含量;b代表每个样品做3组生物学平行并且数值加减误差值(n=3)

图3 Jm-Argonaute对酿酒酵母脂肪酸含量的影响Fig.3 Ffatty acid content in Mutant and wild S.Cerevisiae“*”代表两组间具有显著性差异“*”represents a significant difference between the two groups
3 讨 论
酿酒酵母脂肪酸代谢涉及两个过程:脂肪酸生物合成和分解代谢过程。其中包含不同的辅酶因子和催化酶。相关研究表明,在脂肪酸生物合成途径中,各种饱和以及不饱和脂肪酸的形成受到不同酶的调节,例如乙酰辅酶A羧化酶、脂肪酸延长酶、脂肪酸去饱和酶等[19]。与脂肪酸合成途径不同,脂肪酸分解代谢是释放能量的过程,特别是β-氧化通路最为重要,但此过程也需要与脂肪酸分解相关的酶系统参与,如酰基辅酶A合成酶和肉碱酰基转移酶等[20]。根据本研究结果,推测与脂肪酸代谢相关的关键酶基因与其调节因子可能在海苏特氏菌Argonaute蛋白参与的小RNA基因转录后R 调控中受到调节,从而影响了与酿酒酵母脂肪酸代谢相关的生物通路,进一步影响了酿酒酵母脂肪酸的含量,但是具体调控机制尚不清楚。虽然一些miRNAs具有调节脂类代谢的功能[21],但是作为小RNA调控脂肪酸代谢通路中的重要参与者,Argonaute蛋白在其中的具体功能尚不清楚,这有待于进一步实验探究。
本研究分离纯化并鉴定了海苏特氏菌Argonaute蛋白基因,SMART软件分析显示其结构域包含与细胞寿命相关SIR2结构域[22],这在以往的Argonaute蛋白基因研究中未被报道,SIR2结构域的存在不仅是Argonaute蛋白基因一个新的序列,也表明本研究中得到的海苏特氏菌Argonaute蛋白基因在进化水平上可能与以往的Argonaute蛋白基因不同,为深入研究不同生物Argonaute蛋白进化关系提供了新的信息。本研究中,重组酵母饱和脂肪酸占总脂肪酸的百分比含量与对照菌株无明显变化,但不饱和脂肪酸的百分比含量由对照的86.4%上升至90.5%(数据中未显示),其中重组菌株脂肪酸C16∶1的含量与对照菌株有显著性差异(P(T<=t)=0.013 5<0.05),这证实海苏特氏菌Argonaute蛋白基因可能具有调控脂肪酸碳链延长和去饱和的功能。实验结果虽然表明海苏特氏菌Argonaute蛋白基因与酿酒酵母脂肪酸代谢有关,但具体机制尚不明确。
海苏特氏菌Argonaute蛋白基因不仅具有与长寿通路和基因沉默机制相关的SIR2结构域,并且在酿酒酵母BY4742的脂肪酸代谢途径中起到了提高含量的调控作用,这些发现可能为海洋细菌Argonaute蛋白在脂肪酸代谢中的功能提供新的研究方向,并且Argonaute蛋白可以作为一种可行的工具用来研究酿酒酵母中的RNAi通路,需要进一步探究海苏特氏菌Argonaute蛋白对酿酒酵母BY4742脂肪酸代谢的潜在调控机制。
