缓冲蛋白胨水前增菌对冷鲜鸡表面微生物变化的影响
2018-02-26桂国弘陈小敏温雪婷肖英平
桂国弘,徐 娥,杨 华,陈小敏,温雪婷,肖英平*
(1.贵州大学 动物科学学院,贵州 贵阳 550025;2.浙江农业科学院 农产品质量标准研究所,浙江 杭州 310021)
随着近年来禽流感的不断爆发,全国多地市禁止活禽交易,冷鲜鸡成为未来生鲜鸡肉消费的主要品种,具有广阔的发展前景[1]。鸡肉营养丰富,适于大多数细菌生长繁殖,且冷鲜鸡从宰杀、运输、贮藏到消费者餐桌上[2-3],受到污染的病原菌种类繁多,造成一定的质量安全隐患,污染微生物也导致冷鲜鸡的货架期缩短[4-5]。对鸡肉中病原菌的检测,传统分离培养方法或是分子检测方法基本均需选择特定的前增菌介质进行菌体修复和富集,以获得相对丰度较高的目标菌体[6]。常见的非选择性前增菌介质主要是缓冲蛋白胨水(buffer peptone water,BPW)、胰酶大豆肉汤(trypticasesoy broth,TSB)、营养肉汤(nutrient broth,NB)等[7]。其中BPW是食品安全国家标准GB4789.4-2016《食品微生物学检验 沙门氏菌检验》和《食品微生物学检验 克罗诺杆菌属(阪崎肠杆菌)检验》 中用于沙门氏菌和克罗诺杆菌属检验的前增菌液,也广泛用于其他微生物的增菌中。BPW营养相对匮乏,Mackey等[8]认为菌体修复过程不需要营养太丰富的介质,营养缺乏对菌体修复会更有利;Ray等[9]认为,在非营养介质中,由低温、冷冻引起的部分损伤菌体更能得到较好的修复。但非营养介质不能修复热激损伤的菌体[10]。冷鲜鸡在生产过程中,经过了预冷、冷藏以及冷链运输等环节,表面污染微生物主要存在一定的冷损伤,因此采用BPW前增菌对于后续菌体的修复具有重要作用。此外,有研究报道不同的增菌时间对于目标菌的分离培养至关重要,如BPW前增菌分离沙门氏菌,增菌时间选择不当,会造成漏检或检出率降低[11]。然而,目前对于不同增菌过程中菌群的结构变化研究甚少,缺乏整个微生物结构在前增菌过程中演替的相关数据。因此本研究以前增菌液BPW和冷鲜鸡微生物为研究对象,采用平板计数法、变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)和高通量测序技术,阐明冷鲜鸡污染微生物在BPW前增菌过程中微生物数量和结构的变化,为前增菌研究提供参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 实验用20只冷鲜鸡样品为三黄鸡,于2017年4月购买于杭州超市。
1.1.2 培养基 缓冲蛋白胨水培养基(Buffer Peptone Water,BPW)(杭州微生物试剂有限公司),平板计数琼脂培养基(Plate Count Agar,PCA)(杭州微生物试剂有限公司),孟加拉红(虎红)培养基(Rose Bengal Medium)(杭州微生物试剂有限公司)。
1.1.3 试剂与仪器 ZR Fungal/Bacterial DNA MiniPrepTM(Zymo Research),KOD FX DNA 聚合酶(日本东洋坊公司),Applied Biosystems® Veriti® Thermal Cycler (美国Bio-RAD公司),凝胶成像仪(美国Bio-RAD公司),DGGE D Code 电泳仪(美国Bio-RAD公司),NanoDrop 2000 超微量分光光度计(美国Thermo Fisher 公司)。
1.2 方法
1.2.1 样品处理 将从市场上购买的冷鲜鸡放置于无菌袋中,每500 g冷鲜鸡加入500 mL BPW冲洗液,用手握住无菌袋激烈振荡1 min,取出鸡肉样品,将冲洗过鸡肉样品的BPW冲洗液继续置于自封袋,36 ℃培养箱中分别培养0、2、6、12、24 h时取 BPW增菌液用于后续实验。
1.2.2 微生物平板计数 不同增菌阶段菌落总数分别按照食品安全国家标准GB 4789.2-2016《食品微生物学检测 菌落总数》计数。
1.2.3 沙门氏菌检测 取不同阶段的BPW增菌液,参考食品安全国家标准GB 4789.4-2016《食品微生物学检测 沙门氏菌检验》对沙门氏菌进行检测分析。
1.2.4 DNA的提取 从20只冷鲜鸡增菌液样品中随机选择2只冷鲜鸡(编号为A和a)不同阶段的BPW增菌液30 mL,8 000 r/min离心10 min,得到细菌,采用试剂盒提取细菌基因组DNA用于DGGE分析和高通量测序分析,具体操作参见试剂盒说明书。
1.2.5 16S rDNA V3区扩增和DGGE分析 参照Muyzer等[12]的方法,使用341F和534R引物进行PCR扩增,在上游引物5′ 端添加GC序列:341F-GC(5′-CGCCCGCCGCGCGCGGCGGGCGGG-GCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3′),534 R(5′-ATTACCGCGGCTGCTGG-3′)。选择浓度为8%的尿素-丙烯酰胺凝胶,选择变性梯度范围为40%~65%将V3区段的扩增产物进行DGGE分析。采用DGGE D Code 电泳仪进行电泳,电泳缓冲液为1×TAE 缓冲液,60 ℃、50 V 电泳14 h,用EB染色,弃浸泡液,用MQ水清洗3次去除染色液。将胶放入凝胶图像分析仪照相。
1.2.6 高通量测序分析 以提取的DNA为模板,引物338 F(5′-ACTCCTACGGGAGGCAGCA-3′) 和806R (5′-GGACTACHVGGGTWTCTAAT-3′) ,对细菌16S rRNA基因V3-V4区进行PCR扩增。上机测序采用双端测序法(Pair end,150 bp×2),Hiseq2500平台进行PE150测序。
1.2.7 数据处理与分析 根据条码序列(barcode)匹配双端测序序列(read)与样品,对条码序列及引物序列进行切除。使用FLASH 软件(version 1.2.7)将双端序列进行融合(merge),得到未加工序列。使用QIIME软件(Quantitative Insights Into Microbial Ecology,V1.7.0)将序列进行质控和过滤后,获得优质序列[13-14]。通过UCHIME算法将得到的优质序列与参考数据库(Gold database)进行比对,发现嵌合体序列,去除后获得有效序列[15-16]。使用Uparse软件(Uparse V7.0.1001)依据相似性≥97%将质控后的有效序列聚类成为操作分类单元(operational taxonomic unit,OTU)[17]。采用QIIME(Version 1.7.0)默认参数计算各样品的alpha多样性指数和物种分布。为了比较使用BPW增菌剂增菌不同时间的菌群结构差异,使用R软件(Version 2.15.3)内的FactoMineR软件包对样品之间的菌群结构相似度进行主坐标分析(PCoA)。
1.2.8 统计分析 根据菌落计数结果计算成每毫升样品中细菌的含菌量(cfu/mL),SPSS18.0分析实验数据的的显著性,P<0.05为差异显著,P<0.01为差异极显著。并用GraphPad Prism 6 绘图。
2 结果与分析
2.1 不同增菌时间菌落总数变化
由图1可见,菌落总数随着增菌时间的延长而增加,在0和2 h菌落总数无显著差异(P>0.05),在6 h菌落总数极显著升高(P<0.01),24 h与其他四个时间点差异极显著(P<0.01)。有研究认为[18-19]增菌的修复过程发生在繁殖前6 h内,本实验在增菌2 h时,菌落总数无显著变化,在增菌6 h后,细菌数量均大量增加。
2.2 不同增菌时间对沙门氏菌检测结果的影响
由图2可见,沙门氏菌检出率在增菌前12 h呈上升趋势,检出率分别为0%、5%、30%、40%,说明BPW增菌12 h时沙门氏菌的数量最多,利于其检出,到24 h时其检出率下降至15%,同时沙门氏菌也是在6 h 后开始增多,也证实了增菌的修复过程发生在繁殖前6 h[18-19]的观点。
2.3 不同增菌时间的菌群DGGE图谱
冷鲜鸡表面菌群DGGE图谱如图3A所示,在BPW增菌0、2、6、12 h 的菌群条带均较为丰富,但在增菌24 h后,菌群结构图谱发生明显变化,条带数据减少;多样性聚类分析表明(图3B)使用BPW增菌24 h后,与其他时间点菌群的相似性仅为0.20,菌群结构发生显著变化。
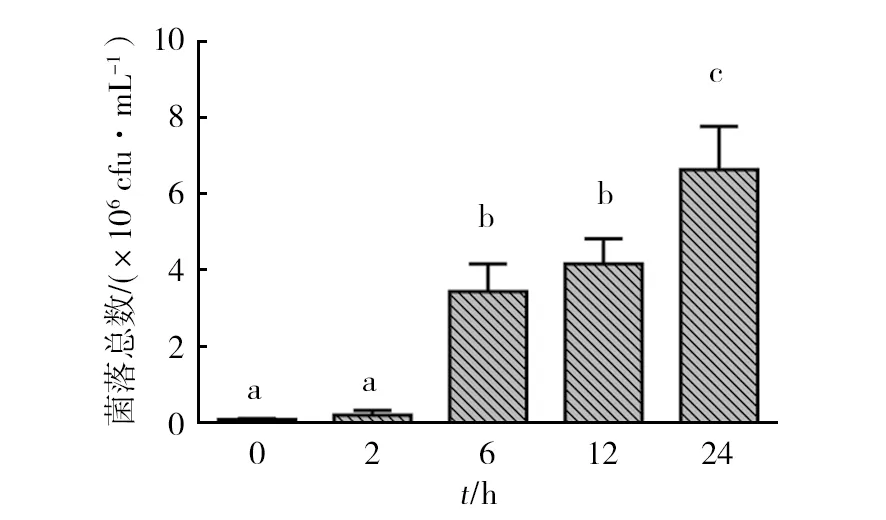
图1 不同增菌时间BPW中的菌落总数(n=20)Fig.1 Total microflora counts at different enrichment time in BPW
数据标有相同字母为差异不显著(P>0.05),标有相同字母为差异显著(P<0.05)
Bars with same superscripts the difference are not significant(P>0.05),bars with different superscripts are statistically different(P<0.05)
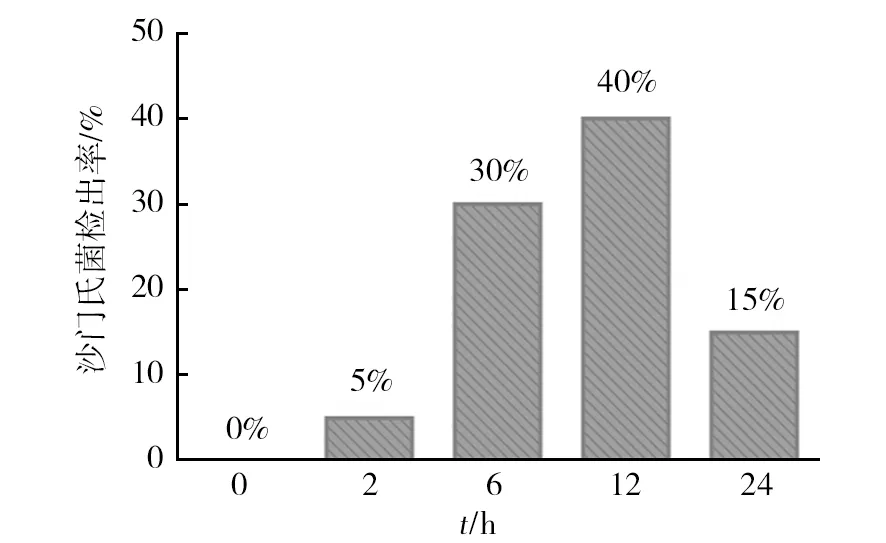
图2 不同增菌时间BPW中的沙门氏菌检出率(n=20)Fig.2 Salmonella′s detection rate at different enrichment time in BPW
2.4 不同增菌时间的菌群高通量测序结果
从10个样品中最终获得540 247条有效片段,其中样品有效序列为48 656~59 748条(表1),样品间的有效序列差异性较小。10个样品最终获得116~188个OTU,且各个样品的覆盖度指数(Good coverage)均为0.999~1,并且由图4可看出其稀释曲线已经趋于平稳,说明样品中序列已基本全部检测出。
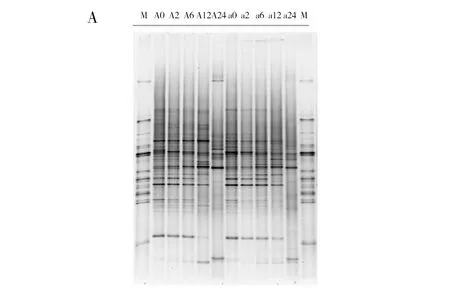
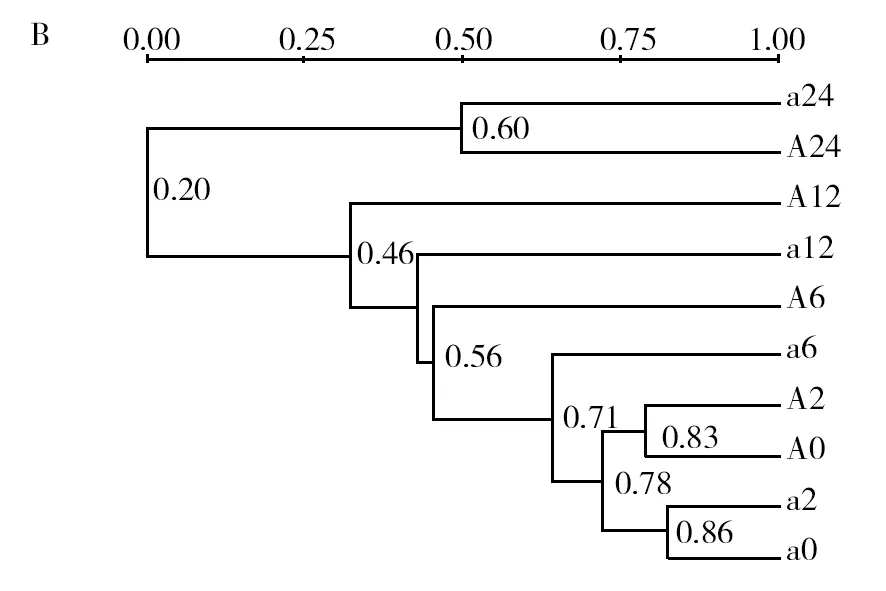
图3 不同增菌时间菌群DGGE结果和聚类结果Fig.3 The result of DGGE and microflora cluster in different enrichment timeM:Marker;A0、A2、A6、A12、A24:分别用BPW增菌0、2、6、12、24 h;a0、a2、a6、a12、a24:分别用BPW增菌0、2、6、12、24 h;下图同M: Maker; A0,A2,A6,A12,A24: enriched by BPW in 0,2,6,12,24 h; a0,a2,a6,a12,a24: enriched by BPW in 0,2,6,12,24 h;the same as below
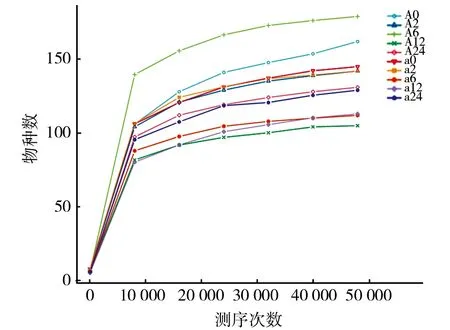
图4 各样品稀释曲线Fig.4 Rarefaction curves of 10 different samples
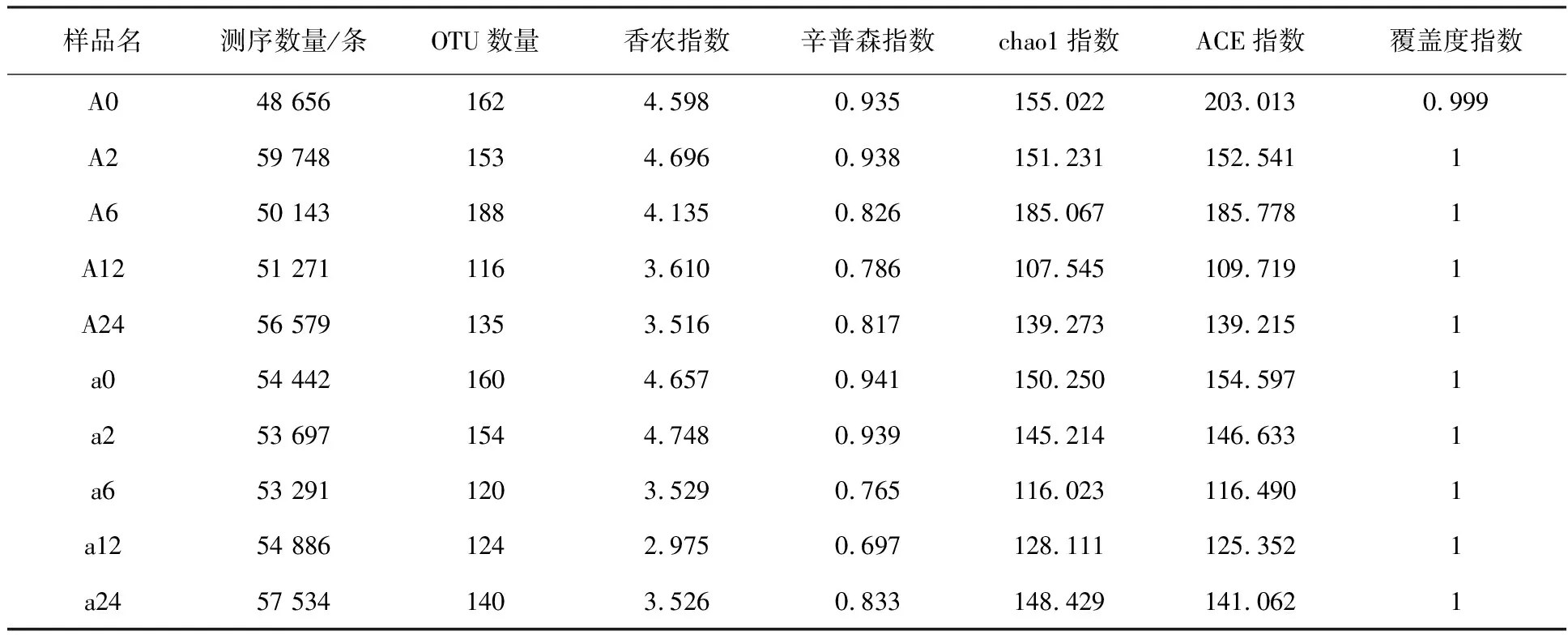
表1 样品测序概况Table 1 Overview of sequencing results of each sample
在门水平上,变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)是冷鲜鸡表面优势菌门,占总菌群85%以上(图5A)。在BPW增菌12 h内变形菌门(Proteobacteria)和厚壁菌门的相对丰度未明显变化,在增菌24 h后,变形菌门相对丰度降低,但依然维持较高的相对丰度,为46%以上,大量病原菌如大肠埃希菌、沙门氏菌、霍乱弧菌、幽门螺旋杆菌等均属于变形菌门;而厚壁菌门相对丰度大幅度增加,由0~12 h时的5.82%~18.21%增加至35.09%~39.19%。同时,梭杆菌门(Fusobacteria)在0~12 h时相对丰度为0.16%左右,24 h时分别增加到3.80%~10.73%。另外拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)的丰度也在增菌24 h后增加。
在属水平上,从图5B 组中反映出0~12 h间相对丰度较高的属到24 h时降低,如编号为A的冷鲜鸡样品,0 h时不动杆菌属(Acinetobacter)、希尔氏菌属(Shewanella)、假单胞菌属(Pseudomonas)、嗜冷杆菌属(Psychrobacter)的相对丰度分别为29.49%、21.96%、20.64%、10.26%,到24 h时分别下降到1.17%、0.65%、0.91%、0.51%;而0 h时消化链球菌属(Peptostreptococcus)、梭杆菌属(Fusobacterium)、变形杆菌属(Proteus)、漫游球菌属(Vagococcus)、拟杆菌属(Bacteroides)和摩根氏菌属(Morganella)的相对丰度分别为0.40%、0.14%、0.15%、1.23%、0.14%、0.17%,到24 h时分别上升到28.45%、3.75%、7.19%、3.15%、5.72%、3.10%。
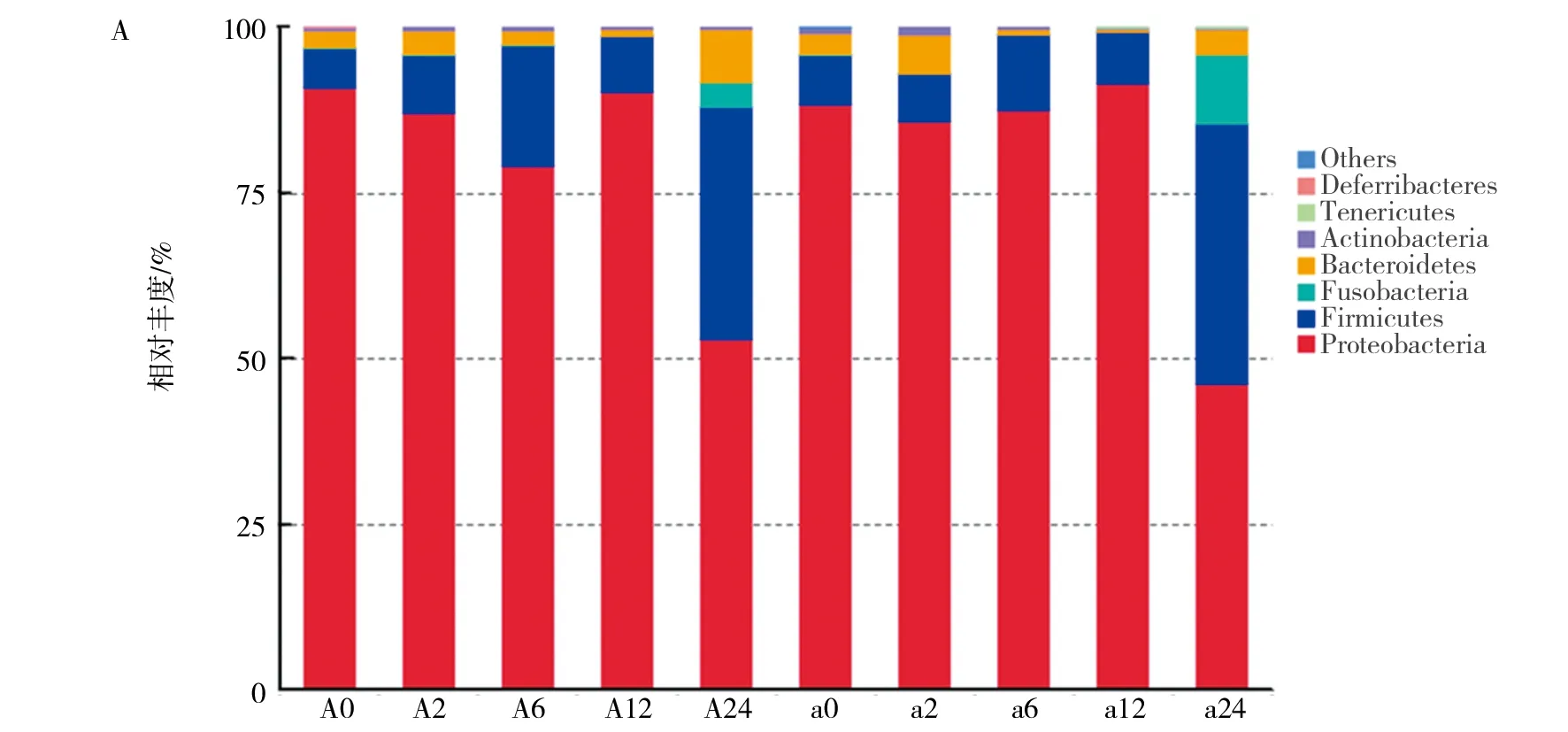

图5 各样品的细菌菌群结构Fig.5 The bacterial community structures of different samples.A:在门的水平上;B:在属的水平上A: at the phylum level; B: at the genus level
郭洪波等[20]研究报道,食品主要致病菌增菌时间在12~18 h时为宜。本试验的研究也证实了BPW前增菌时间为12 h阶段细菌数量显著增加,而菌群结构未发生明显改变,有利于沙门氏菌等特定病原菌的复苏和分离。
从主坐标分析(图6)中可以看出,相同时间点不同样品的菌群结构相似性较高;不同时间点,相同样品的菌群也有较高的差异性,其中24 h时和其他时间点都有较大的差异。这与上述DGGE聚类分析的实验结果相同。
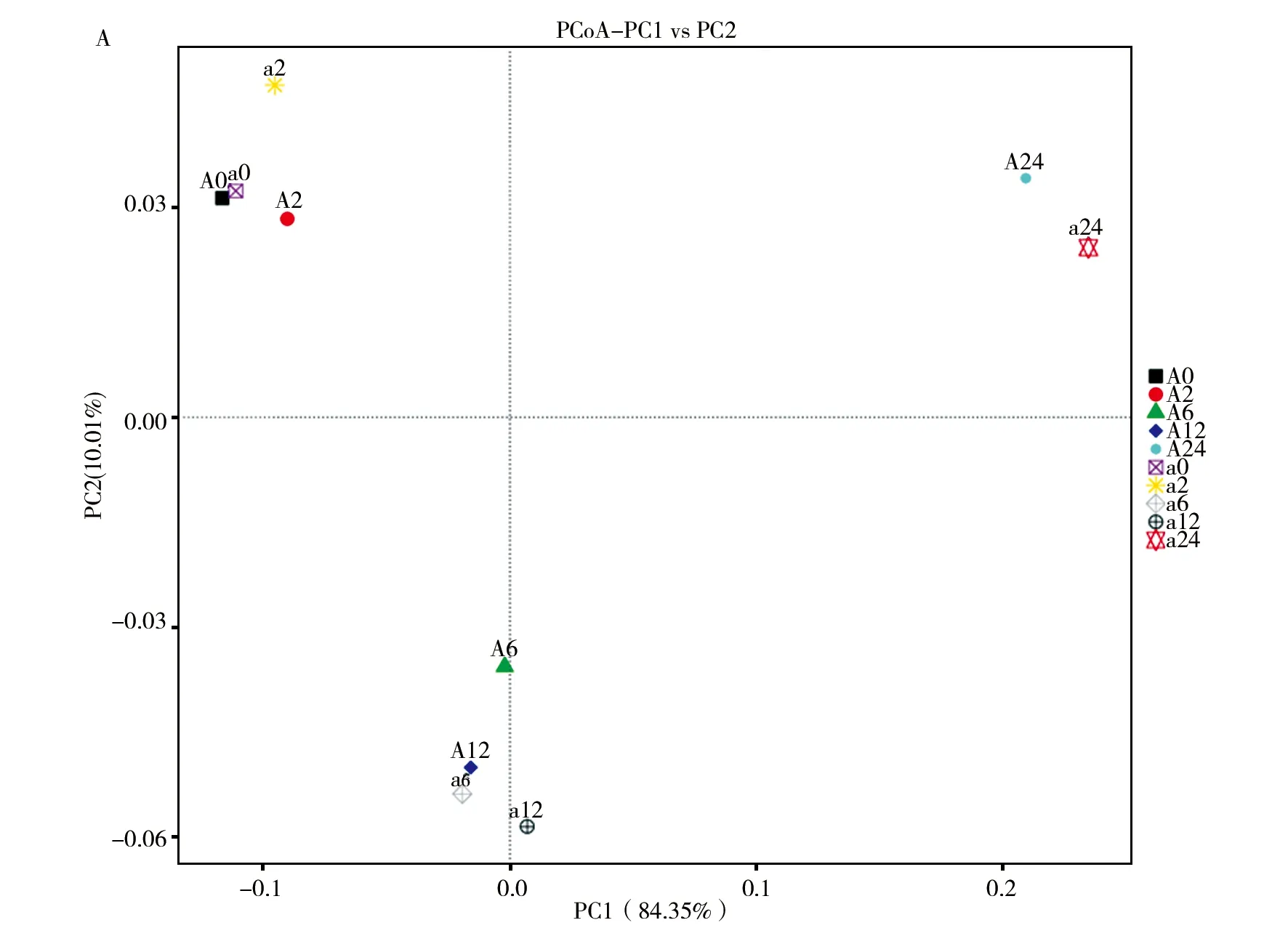

图6 各样品菌落结构的聚类和主坐标分析Fig.6 Cluster analysis and principal coordinates analysis (PCoA) of the dissimilarity of bacterial community structure among the samples A:样品间的加权UniFrac 距离;B:样品细菌菌群结构的主坐标分析,PC1 和PC2为两个主坐标成分,百分比表明二者的相对贡献A: weighted UniFrac distance among the samples; B: PCoA of the dissimilarity of bacterial community structure among the samples,which is plotted against the PC1 vs.PC2 axes,with the percentages indicating the relative contributions of the two principal coordinates
3 讨 论
使用BPW对冷鲜鸡中微生物进行前增菌处理时,增菌时间对菌群结构具有显著影响。细菌总数随着增菌时间的延长而显著增多;沙门氏菌的检出率在BPW增菌12 h阶段,检出率最高,为40%;BPW作为常见非选择性前增菌液,能有效地增加细菌总数,提高沙门氏菌检出率。
变形菌门在各时间点都占有很高比例,变形菌门中包含很多病原微生物(大肠埃希菌、沙门氏菌等),同时也是细菌中最大的一个门。随着培养时间的增加,24 h时变形菌门的比例减少,而厚壁菌门比例增多。由于很多厚壁菌门的细菌可以产生芽胞,在营养物质匮乏时也能生存下来,在营养条件不佳时,厚壁菌门的细菌依然能增殖。
消化链球菌属和不动杆菌属在临床上与炎症、感染的发生有相关性[21-22]。希瓦氏菌属和假单胞菌属都是食品中常见的腐败菌,在很多研究中[23-24]都证实了其在冷藏过程中能作为优势生存,且能产生氨等腐败产物。本研究在增殖0~2 h内不动杆菌属、希瓦氏菌属和假单胞杆菌属为优势菌,但是到了24小时时其菌群结构发生了较大改变,消化链球菌属成为优势菌,不动杆菌属、希瓦氏菌属和假单胞杆菌属的比例变少。所以增菌到24小时后其菌群结构发生极大改变,不能准确地判断其真正的结构。从菌群结构变化的角度阐明BPW增菌时间为12 h有利于沙门氏菌等细菌复苏分离的作用机制。
使用BPW对冷鲜鸡样品进行前增菌处理时,增菌时间对菌群结构具有显著影响:①细菌总数和沙门氏菌检出率随着增菌时间的延长而增多;②DGGE和基于16S rRNA基因的高通量测序分析均表明,BPW增菌12 h内,菌群结构变化相对较少,优势菌属为不动杆菌属(Acinetobacter)、希尔氏菌属(Shewanella)、假单胞菌属(Pseudomonas)、嗜冷杆菌属(Psychrobacter);而增菌24 h,菌群结构发生显著变化,消化链球菌属(Peptostreptococcus)、梭杆菌属(Fusobacterium)、变性杆菌属(Proteus)、漫游球菌属(Vagococcus)、拟杆菌属(Bacteroides)和摩根氏菌属(Morganella)成为主要的优势菌属。
