慢性肾衰竭合并胃窦血管扩张症1例并文献复习
2018-02-26刘爱玲李晓青伍东升钱家鸣
刘爱玲 李晓青 伍东升 钱家鸣
中国医学科学院 北京协和医学院 北京协和医院消化科(100730)
病例:患者女,71岁,因“黑便2年,加重7个月”于2017年3月21日收治入院。两年前无明显诱因下排成形黑便,50~100 mL/d,无腹痛、腹胀、恶心、呕吐、反酸、烧心等,血红蛋白(Hb)80~100 g/L(接受血液透析以来Hb 100~110 g/L)。7个月前症状加重,排成形柏油便150~200 mL/d,伴乏力、头晕,就诊于当地医院。Hb 60 g/L,胃镜检查示糜烂性胃炎;结肠镜检查进镜约25 cm,见直肠一直径为1.2 cm的息肉,后因患者疼痛难忍,未能继续配合检查;胶囊内镜检查未见明显异常。予患者每2周输注2 U红细胞,Hb维持在60~80 g/L,同时予抑酸、保护胃黏膜治疗,患者乏力、头晕症状减轻,但仍排黑便。遂就诊于我院,考虑患者不能耐受结肠镜检查,行结肠CT示降结肠管壁略增厚,余未见异常。为进一步诊治收入院。整个病程中,患者精神、睡眠可,食欲减退,尿量约100 mL/d,体重下降约3 kg。既往慢性肾小球肾炎7年,慢性肾衰竭(chronic renal failure, CRF)5年,保留左前臂动静脉瘘,规律每周2次血液透析,2年前出现黑便后未再用肝素抗凝。入院查体:体温36 ℃,心率86次/min,呼吸20次/min,血压135/56 mm Hg(1 mm Hg=0.133 kPa);贫血貌,心肺查体未见明显异常;腹软,无压痛、反跳痛,肝脾肋下未及,肠鸣音5~6次/min,双下肢轻度可凹性水肿。直肠指诊未见异常。
入院后完善相关检查:血常规:WBC 5.46×109/L,Hb 59 g/L,MCV 102.8 fl,MCH 32.6 pg,PLT 153×109/L。粪常规示外观黑褐色软便,WBC 0~1/HPF,RBC 10~15/HPF,隐血试验(+)。生化指标:K+4.0 mmol/L,肌酐586 μmol/L,尿素25.26 mmol/L,白蛋白30 g/L,ALT 20 U/L。凝血指标:凝血酶原时间12.5 s,活化部分凝血激酶时间27.7 s,Fbg 3.15 g/L,D-Dimer 1.34 mg/L FEU。铁四项:Fe2+57.7 μg/dL,总铁结合力(TIBC)298 μg/dL,铁蛋白248 ng/mL,转铁蛋白饱和度16.7%。叶酸+维生素B12(-)。肿瘤指标:AFP、Ca19-9、CEA均无明显异常。胃镜检查示胃窦可见红色条状血管扩张,病变由胃窦延续至幽门口,呈辐射状,外观似西瓜皮条纹(图1)。十二指肠球腔、球后以及降段黏膜可见多发点状糜烂充血灶,接触易出血。胶囊内镜示小肠毛细血管扩张(图2)。遂诊断为胃窦血管扩张症(gastric antral vascular ectasia, GAVE),十二指肠毛细血管扩张。予患者质子泵抑制剂(proton pump inhibitor, PPI)、促红细胞生成素、补铁等治疗,住院期间行2次氩离子凝固术(argon plasma coagulation, APC)治疗。患者仍每日排2~3次黑便,总量约150 mL/d,仍需输血支持,Hb维持在70~80 g/L。因病变范围广泛,难以手术切除。患者自动出院。
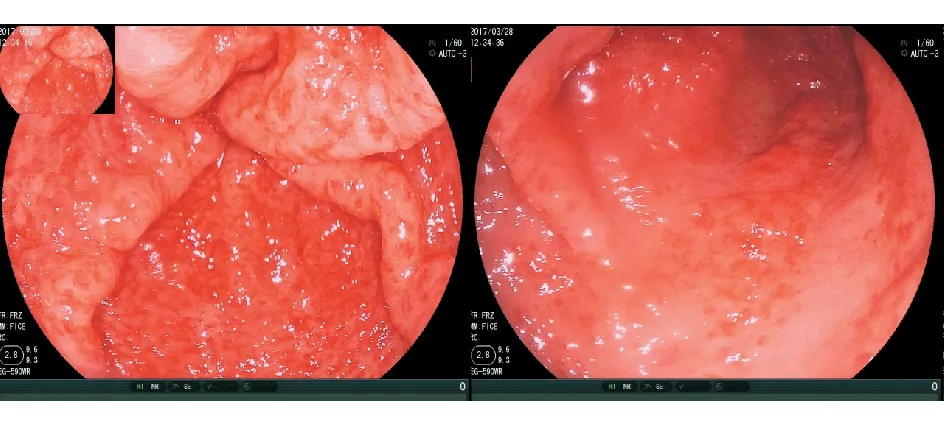
图1胃镜示胃窦红色条状血管扩张,病变由胃窦延续至幽门口,呈辐射状,外观似西瓜皮条纹

图2 胶囊内镜示十二指肠、小肠毛细血管扩张
讨论:GAVE是一种少见病,由Rider在1953年首次报道,约占非食管静脉曲张消化道出血病因的4%[1]。GAVE常见于老年女性,临床表现为严重的、不明原因的上消化道出血。GAVE常合并慢性病,如肝硬化、自身免疫性疾病、CRF等。目前CRF合并GAVE的病例报道较少见。
GAVE的发病机制尚不明确,可能与机械应力、血管活性因子(如胃泌素、前列腺素、5-羟色胺、血管活性肠肽等)有关。研究发现,CRF患者易合并GAVE[2],其可能的机制为:CRF患者胃排空减弱、胃窦机械应力增高;肾脏排泄功能受损,血管活性物质代谢能力降低;CRF诱导的血小板功能障碍等[3]。
GAVE的诊断主要依靠典型的内镜表现。内镜下分为条状和点状两种类型:条状GAVE胃镜下表现为红色条状血管扩张,沿胃长轴自幽门向胃窦部呈辐射状排列,外观类似西瓜皮条纹,故称西瓜胃;点状GAVE胃镜下表现为胃窦弥漫分布的红色斑点,呈弥散蜂巢样改变,故称蜂窝胃。病理表现为胃窦黏膜增生肥大、毛细血管扩张伴血栓形成、固有层纤维肌性增生。GAVE通常位于胃腔,少数位于胃肠道其他部位,包括贲门、十二指肠、空肠、回肠等[4]。Gubatan等[5]报道了1例病变位于胃窦和十二指肠的GAVE患者,经APC治疗后缓解,推测其发病机制可能与胃黏膜异位相关。本例患者为老年女性,病程较长,临床表现为黑便,伴乏力、头晕,检查示缺铁性贫血,胃镜提示胃窦、十二指肠毛细血管扩张,因粪常规可见红细胞,不除外下消化道出血,建议行结肠镜和胶囊内镜。因既往患者不能耐受结肠镜,故行胶囊内镜检查,发现小肠毛细血管扩张,病变范围广泛。
GAVE易误诊为糜烂性胃炎、出血性胃炎、门静脉高压性胃病(portal hypertensive gastropathy, PHG)、遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasia, HHT)等。糜烂性胃炎内镜下表现为胃黏膜单个或多个糜烂灶,出血量较少;出血性胃炎多急性起病,有大量饮酒或应激等诱因。PHG多见于门静脉高压患者中,主要发生于胃底和胃体,胃镜下表现为马赛克样改变、红点样损伤、樱桃红斑等。HHT为显性遗传性疾病,无地域、性别差异,病理变化为病变处血管成结节样或瘤样扩张,可发生在任何部位的毛细血管。本例患者老年起病,病程较长,未合并肝硬化等导致门静脉高压的疾病,且内镜下表现不符合PHG、糜烂性胃炎,故不考虑上述疾病。本例患者曾被误诊为糜烂性胃炎,未得到尽早诊治。提醒临床医师应熟悉GAVE内镜下表现,对其提高警惕。
GAVE治疗方案包括药物、内镜和手术治疗。治疗首选为APC,其可封闭扩张的毛细血管[6]。但Garg等[7]发现APC的治疗有效率低(40%),复发率高(25%)。其他内镜下治疗包括热凝固、冷冻和套扎治疗。治疗药物包括H2受体阻滞剂、PPI和硫糖铝,但治疗效果差;个案和小样本临床研究指出,雌激素、糖皮质激素、氨甲环酸、赛庚啶、环磷酰胺、奥曲肽、沙利度胺等对GAVE有治疗效果。但雌激素、糖皮质激素、氨甲环酸、赛庚啶的不良反应较多,并不推荐作为常规治疗[6]。Swanson等[8]一项系统性分析纳入了63项研究,结果显示对于血管发育不良,沙利度胺可减少出血,而雌激素无治疗效果;对于GAVE,尚缺乏药物的比较研究。难治性GAVE患者可行手术切除胃窦[9]。多数GAVE患者经内镜治疗后好转。据报道[10],1例合并CRF的GAVE女性患者给予反复内镜下治疗,2年后死于失血性休克。本例患者经PPI等药物、APC治疗后无效,但因病变范围广,无法行手术切除,预后较差。
目前对于CRF合并GAVE的患者适合哪种透析方式,仍有争议。Iguchi等[11]的研究中,3例CRF合并GAVE患者均表现为便血和难以纠正的贫血,且对APC治疗无效,经血液透析治疗后,未再便血。考虑原因为血液透析减轻了胃窦的机械应力,从而起治疗GAVE的作用。Yorioka等[12]发现,1例CRF合并GAVE患者改变透析方式(从血液透析改为腹膜透析)后,便血减少,推测机制可能为腹膜透析可维持血压稳定,从而改善胃窦缺血,减少胃泌素等分泌,减轻GAVE。但Stefanidis等[10]报道2例CRF合并GAVE患者,从血液透析改为腹膜透析后,便血并未减轻。
总之,本例CRF合并GAVE的患者临床表现为便血、贫血,曾误诊为糜烂性胃炎。明确诊断后,予药物和APC治疗,但效果并不理想。通过本例患者的诊治过程和文献复习,建议临床医师诊治GAVE时注意以下几点:①对于CRF患者出现反复上消化道出血和难治性缺铁性贫血时,需考虑GAVE的可能;②GAVE病变并不仅仅局限于胃窦,有可能累及消化道其他部位,如十二指肠、小肠等,除胃镜外,尚需行胶囊内镜和结肠镜检查。③治疗上首选内镜下治疗,如药物和内镜下治疗效果均不理想时,手术治疗是一种选择。目前CRF合并GAVE的病例报道较少,还需进一步探究其发病机制,寻找有效的治疗方法。
1 Nighute S, Shiddhapur GS. Gastric antral vascular ectasia[J]. J Assoc Physicians India, 2016, 64 (1): 104.
2 Chalasani N, Cotsonis G, Wilcox CM. Upper gastrointestinal bleeding in patients with chronic renal failure: role of vascular ectasia[J]. Am J Gastroenterol, 1996, 91 (11): 2329-2332.
3 Ahn Y, Wang TK, Dunlop J. Treatment resistant gastric antral vascular ectasia in a patient undergoing haemodialysis[J]. J Ren Care, 2014, 40 (4): 263-265.
4 Stotzer PO, Willén R, Kilander AF. Watermelon stomach: not only an antral disease[J]. Gastrointest Endosc, 2002, 55 (7): 897-900.
5 Gubatan J, Raines N, Khosravi H, et al. Hemorrhage from Extra-Antral Gastric Antral Vascular Ectasia in a Patient with Duodenal Heterotopic Gastric Mucosa[J]. Case Rep Gastrointest Med, 2016, 2016: 4325302.
6 Naidu H, Huang Q, Mashimo H. Gastric antral vascular ectasia: the evolution of therapeutic modalities[J]. Endosc Int Open, 2014, 2 (2): E67-E73.
7 Garg S, Aslam B, Nickl N. Endoscopic resolution and recurrence of gastric antral vascular ectasia after serial treatment with argon plasma coagulation[J]. World J Gastrointest Endosc, 2017, 9 (6): 263-266.
8 Swanson E, Mahgoub A, MacDonald R, et al. Medical and endoscopic therapies for angiodysplasia and gastric antral vascular ectasia: a systematic review[J]. Clin Gastroenterol Hepatol, 2014, 12 (4): 571-582.
9 Pljesa S, Golubovic G, Tomasevic R, et al. “Watermelon stomach” in patients on chronic hemodialysis[J]. Ren Fail, 2005, 27 (5): 643-646.
10 Stefanidis I, Liakopoulos V, Kapsoritakis AN, et al. Gastric antral vascular ectasia (watermelon stomach) in patients with ESRD[J]. Am J Kidney Dis, 2006, 47 (6): e77-e82.
11 Iguchi A, James Kazama J, Komatsu M, et al. Three cases of gastric antral vascular ectasia in chronic renal failure[J]. Case Rep Nephrol Urol, 2011, 1 (1): 15-19.
12 Yorioka N, Hamaguchi N, Taniguchi Y, et al. Gastric antral vascular ectasia in a patient on hemodialysis improved with CAPD[J]. Perit Dial Int, 1996, 16 (2): 177-178.
