不同醚类药物对胆囊结石的溶石效果及其生物安全性*
2018-02-26何崇信肖静波宛新建
何崇信 肖静波 宛新建
上海交通大学附属第一人民医院上海市胰腺疾病重点实验室 上海市第一人民医院消化科(201620)
胆囊结石是消化系统疾病诊疗中最常见的病种之一,其发病率在西方发达国家约为10%~15%,我国为4.4%~8.2%[1],80%~90%的胆囊结石属于胆固醇结石。胆囊结石可引起胆绞痛、急性胆囊炎、胆汁性腹膜炎、继发性胆总管结石、急性胰腺炎甚至胆囊癌等合并症[2],因此临床上需予积极治疗。
随着对胆囊生理功能以及功能型胆囊切除对人体不利影响认识的不断深入,研究者对胆囊结石的治疗是行胆囊切除术还是保胆取石术产生了争议。有学者认为,保留胆囊手术后所谓的结石易 “复发”是由于“术中残留”而非“术后复发”[3],如能保证取尽结石,同时改善脂质代谢,则可显著减少治疗后复发。灌注药物溶石是指将溶石药物通过特定途径灌注入胆囊,通过直接接触结石发挥溶石作用,该技术也是保留胆囊的碎石术尤其是微创碎石术后迅速取尽残留结石的有效方法[4]。目前最为经典、有效的灌注溶石药物为甲基叔丁基醚(methyl tertiary-butyl ether, MTBE),但挥发性大、生物安全性欠佳限制了该药的广泛应用。本文通过比较四种相对分子质量依次增加的醚类药物对胆囊结石的溶石效果及其生物安全性,以期为设计新型溶石药物提供依据。
材料与方法
一、细胞株、实验动物和主要试剂
人正常肝细胞株LO2购自中科院上海细胞库。健康雄性Sprague-Dawley大鼠30只,体质量140~160 g,购自上海斯莱克实验动物有限责任公司。MTBE、乙二醇单叔丁基醚(ethylene glycol mono-tert-butyl ether, ETB)(上海阿拉丁生化科技股份有限公司);乙基叔丁基醚(ethyl tertiary-butyl ether, ETBE)(上海麦克林生化科技有限公司);二乙二醇单叔丁基醚[di(ethylene glycol) tert-butyl ether, DETB](上海安研商贸有限公司);CCK-8细胞增殖/细胞毒性检测试剂盒(MedChemExpress.);HE染色试剂盒(上海翊圣生物科技有限公司)。
二、方法
1. 体外溶石实验:收集上海交通大学附属第一人民医院普外科患者的胆囊结石(患者均签署知情同意书),使用紫外分光光度仪将结石分为混合性结石和胆固醇结石。实验设四个组别,分别为MTBE组、ETBE组、ETB组和DETB组。将两类结石分别分为四组,置于试管中,各组结石质量、体积相近,每试管5颗,分别加入上述药物原液10 mL,置于37 ℃烘箱中。前12 h每3 h取出结石烘干后称重,之后每9 h称重一次,直至结石破碎或到达观察终点72 h。药物作用后直径小于2 mm的结石不计入称重范围。实验期间不更换药物。
2. CCK-8实验:LO2细胞以含10% FBS的DMEM培养基于37 ℃、5% CO2条件下培养,培养至第3代后调整细胞浓度至2.5×105/mL,接种于96孔板,培养24 h,使细胞密度达到80%。细胞培养24 h后换液,对照组予等量DMEM培养基、干预组分别予终浓度为200 mmol/L的相应药物处理12 h,更换为含10% CCK-8的DMEM培养基,37 ℃孵育1 h。使用酶标仪测定450 nm波长处吸光度值(A值),细胞活力=(干预组A值-空白组A值)/(对照组A值-空白组A值)×100%。每组药物设5个复孔,实验重复3次。
3. 动物模型实验:30只Sprague-Dawley大鼠经适应性喂养1周后,随机分为对照组和四组药物干预组,每组6只。大鼠自由进食,饮用无菌水。参考既往文献[5],按800 mg/kg的剂量分别予四种药物灌胃(药物溶于大豆油中),每日1次,连续2周;对照组予等量大豆油灌胃。2周后,所有大鼠禁食12 h,3%戊巴比妥钠40 mg/kg麻醉,常规解剖,取门静脉血置于无致热原试管中,室温静置30 min,4 ℃ 3 000 r/min 离心15 min,取血清,使用全自动生化分析仪检测生化指标。摘除肝、肺、肾、胃、十二指肠和空肠,各切取约1 cm×l cm×0.5 cm大小的组织块,4%中性甲醛固定,常规石蜡包埋、切片,HE染色,光学显微镜下观察组织病理学改变。
三、统计学分析
结 果
一、四种醚类药物溶石效果比较
体外溶石实验结果表明,MTBE溶石效果最为显著(P<0.05);ETBE对混合性结石的溶石效果与MTBE相当,对胆固醇结石的溶石效果次于MTBE,但优于ETB和DETB,差异均有统计学意义(P<0.05);ETB和DETB的溶石效果虽有所下降,但仍较显著(图1)。
二、四种醚类药物增殖毒性比较
CCK-8实验结果显示,与对照组和MTBE组相比,ETBE组、ETB组、DETB组LO2细胞活力明显降低,提示增殖毒性增强,差异有统计学意义(P<0.05),对照组与MTBE组间差异则无统计学意义(P>0.05);ETBE组细胞活力最低,增殖毒性最强,与ETB组、DETB组相比差异有统计学意义(P<0.05),ETB组与DETB组间差异无统计学意义(P>0.05)(图2)。

与同时间点ETB组、DETB组比较,*P<0.05,**P<0.01;#与同时间点ETBE组比较,#P<0.05,##P<0.01

两组间比较,**P<0.01,***P<0.001
三、动物模型血清生化指标比较
血清生化指标检测显示,各组间ALT、碱性磷酸酶(ALP)、肌酐(Cr)、尿素氮(BUN)水平差异均无统计学意义(P>0.05);各组γ-谷氨酰转肽酶 (GGT)水平均低于对照组,除ETB组外,差异均有统计学意义(P<0.05);DETB组与对照组间AST水平差异无统计学意义(P>0.05),MTBE组、ETBE组、ETB组AST水平均明显高于对照组和DETB组,差异有统计学意义(P<0.05)(表1)。
四、动物模型脏器组织病理学表现比较
各组动物模型脏器HE染色观察显示,MTBE组空肠组织部分区域有淋巴滤泡形成、淋巴组织增生,各组胃肠道均未出现糜烂、明显炎症表现;MTBE组肺脏部分区域出现肺泡腔轻度扩张、少量炎细胞浸润,其余各组肺脏组织病理学表现与对照组相比无明显差异;其他各脏器各组间组织病理学表现与对照组相比均无明显差异(图3)。
讨 论
胆石症在我国胆道疾病中居首位,是胆道疾病治疗的重点,其治疗手段包括手术以及各种碎石、溶石方法。已知手术切除胆囊存在一定风险和一系列近、远期不良反应,如十二指肠胃反流、原发性胆总管结石、急性胆道感染、结肠癌、胃癌等[6-9]。碎石、溶石方法主要有体外震波碎石、口服或直接接触溶石,其中直接接触溶石具有患者痛苦和损伤小、疗效确切的优点,尤其适用于不能耐受麻醉、手术或拒绝手术的患者。研究还证实,对于接受保留胆囊碎石术的患者,直接接触溶石是取尽残留结石的有效方法[4]。MTBE和ETBE的挥发性和特殊气味限制了两者的临床应用,因此寻找新型低挥发、 低毒性醚类溶石药物具有重要临床意义。

表1 四种醚类药物对动物模型血清生化指标的影响
*与对照组比较,P<0.05;#与DETB组比较,P<0.05;△与MTBE组比较,P<0.05
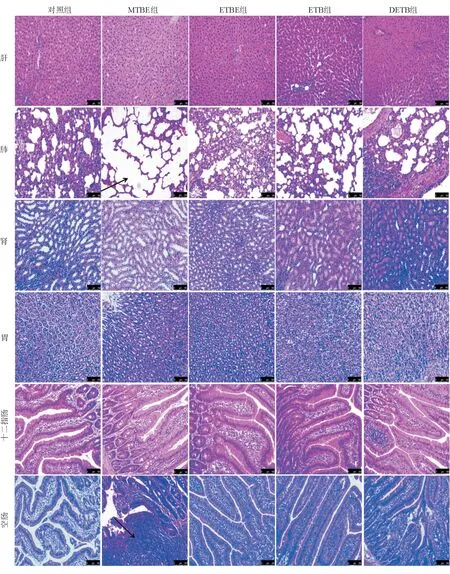
图3 四种醚类药物对动物模型脏器组织病理学表现的影响(HE染色,×200)
本研究采用体外溶石实验模拟人体正常体温下的溶石效果,结果显示随着药物相对分子质量的增加,叔丁基醚类药物的溶石效果逐渐降低。尽管ETB和DETB的作用较MTBE和ETBE有所下降,但仍有良好的溶石效果,在混合性结石和胆固醇结石溶石实验中均有体现。值得注意的是,ETB和DETB的密度接近1,因此两者在胆囊内的实际溶石效果与MTBE溶石效果的差异可能小于体外实验,因为MTBE密度较低,灌注进入胆囊后会漂浮于胆汁和结石之上,难以充分接触结石发挥作用。
既往研究发现MTBE尽管溶石效果极佳,但安全性差,可降低细胞活力、诱导氧化应激、引起线粒体和溶酶体损伤,并具有遗传毒性[5,10-12],此外还有诸如胃肠道反应、黏膜刺激以及代谢产物甲醇的神经毒性等诸多不良反应。既往文献报道ETBE对动物局部组织和全身的毒性作用均较MTBE轻,且不会分解产生甲醇[13]。本研究采用人正常肝细胞株LO2研究四种醚类药物的增殖毒性,CCK-8实验结果显示MTBE增殖毒性最低,ETBE增殖毒性最强,与既往研究[13]结果矛盾,可能与MTBE的强挥发性影响其毒性发挥有关。鉴于ETBE亦有一定挥发性,推测ETB和DETB的实际毒性与之相比可能更低,两者增殖毒性降低可能与其相对分子质量增加、细胞吸收减少有关[14]。药物相对分子质量增加可减少其在胃肠道的吸收,此点对于无需肠道吸收的灌注溶石药物尤为重要,可提高其生物安全性。本研究动物模型实验显示,仅MTBE可引起大鼠空肠和肺脏轻微炎症反应,其他醚类药物对各脏器组织病理学均无明显影响。血清生化指标检测显示四种药物对肝、肾功能亦无明显影响。上述结果初步阐明了醚类药物的一般安全性,但仍需通过更严密的实验,如设置药物浓度梯度、延长给药时间等加以验证。
本研究的不足之处在于未能在体内环境中进行分析,未来拟建立猪或狗等大型动物模型并进一步优化实验条件,以更好地模拟体内溶石,并探索内镜下给药方法及其安全性。笔者的设想是采取内镜下经十二指肠乳头鼻胆囊管引流(endoscopic naso-gallbladder drainage)途径,即于内镜下将导管经乳头插入胆总管,造影后将导丝插入胆囊管,随后通过导丝将鼻胆管置入胆囊[15]。灌注药物溶石产生的结石残余可通过负压吸引的方式吸出,以有效避免结石复发。
综上所述,本研究初步阐述了醚类药物的毒性和生物安全性与其相对分子质量之间的关系,相对分子质量的增加虽会部分降低醚类药物的溶石效果,但同时极大地提高了药物的生物安全性。未来可通过化学修饰的方法进一步优化醚类药物的生物安全性,同时兼顾溶石效果。目前比较成熟的修饰方法为聚乙二醇(PEG)修饰,即将活化的PEG 通过化学方法与被修饰药物耦联,从而改善药物的理化特性和生物学活性,可明显降低药物的肠道吸收水平和血药浓度,同时药物分子结构的改变导致其药代动力学改变,药物稳定性增高,从而避免代谢生成毒性产物,最大限度地减轻不良反应。这为新型溶石药物的研制提供了新的理论依据。
1 刘厚宝,王越琦. 胆囊息肉及胆囊结石与胆囊癌的争议与共识[J]. 中国实用外科杂志, 2014, 34 (1): 47-51.
2 Marschall HU, Einarsson C. Gallstone disease[J]. J Intern Med, 2007, 261 (6): 529-542.
3 郭伟,张忠涛. 保胆取石术尚存争议的问题[J]. 中国实用外科杂志, 2015, 35 (9): 923-925.
4 Kelly E, Williams JD, Organ CH. A history of the dissolution of retained choledocholithiasis[J]. Am J Surg, 2000, 180 (2): 86-98.
5 张云,骆文静,郑刚,等. 甲基叔丁基醚对大鼠脏器毒性作用[J]. 中国公共卫生, 2007, 23 (8): 953-955.
6 Nano M, Palmas F, Giaccone M, et al. Biliary reflux after cholecystectomy: a prospective study[J]. Hepatogastro-enterology, 1990, 37 (2): 233-234.
7 Wu SD, Tian Y, Kong J, et al. Possible relationship between cholecystectomy and subsequent occurrence of primary common bile duct stones: a retrospective review of data[J]. Hepatobiliary Pancreat Dis Int, 2007, 6 (6): 627-630.
8 Shao T, Yang YX. Cholecystectomy and the risk of colorectal cancer[J]. Am J Gastroenterol, 2005, 100 (8): 1813-1820.
9 Chen YK, Yeh JH, Lin CL, et al. Cancer risk in patients with cholelithiasis and after cholecystectomy: a nationwide cohort study[J]. J Gastroenterol, 2014, 49 (5): 923-931.
10 Salimi A, Vaghar-Moussavi M, Seydi E, et al. Toxicity of methyl tertiary-butyl ether on human blood lymphocytes[J]. Environ Sci Pollut Res Int, 2016, 23 (9): 8556-8564.
11 贺性鹏,蔡亚平,贺栋梁. 汽油添加剂甲基叔丁基醚对小鼠遗传毒性的作用[J]. 中国职业医学, 2003, 30 (1): 8-9.
12 薛惠中,王禹,高明,等. 甲基叔丁基醚职业暴露人群淋巴细胞遗传损伤研究[J]. 预防医学, 2017, 29 (8): 757-761.
13 刘君,蔡端,张群华,等. 乙基叔丁醚对动物局部和全身的毒性研究[J]. 上海医学, 1997, 20 (5): 270-272.
14 周婧婧,周庆颂,孙若飞,等. 不同分子量美沙拉嗪PEG修饰物的大鼠在体肠吸收研究[J]. 中国药理学通报, 2016, 32 (10): 1446-1451.
15 Mori Y, Itoi T, Baron TH, et al. Tokyo Guidelines 2018: management strategies for gallbladder drainage in patients with acute cholecystitis (with videos)[J]. J Hepatobiliary Pancreat Sci, 2018, 25 (1): 87-95.
