铁与氯气反应途径及产物的探究
2018-02-22黄燕燕宋巧颖沈甸
黄燕燕+宋巧颖+沈甸


摘要:从实验和理论的角度分析研究了Fe与干燥或湿润cl2的化学反应的可能途径及产物。结果表明,在室温及加热条件下,Fe与干燥及湿润Cl2的化学反应途径及产物有所不同。室温时Fe与干燥Cl2发生钝化反应,而加热时两者化合生成FeCl3; Fe与湿润cl2有两种反应途径,其主要反应途径及产物随反应条件的变化而有所不同:室温时,以原电池反应为主生成FeCl2,而加热时以化合反应为主牛成FeCI3。同时,从实验和理论两方面得出Fe与Cl2在一定条件下反应可生成FeCI2的结论。
关键词:铁与氯气反应;钝化反应;反应途径;实验探究
文章编号:1005-6629(2017)8-0059-04
中图分类号:G633.8
文献标识码:B
1问题提出
氯气(Cl2)是中学阶段需掌握的一种重要气体,在通常情況下其为黄绿色、具有刺激性气味、有毒、密度比空气大、可溶于水。在25℃时,1体积水可溶解约2体积的氯气,同时与水发生可逆反应,生成盐酸和次氯酸。在苏教版高中化学教材中明确指出,在加压条件下,氯气转化为液态,可储存于钢瓶中,便于运输和使用。由此,大多数中学教师及教辅资料中得出了室温下Fe与干燥Cl2不反应的结论,加之该结论观点在一些高等院校教材中也可找到出处,于是Fe不与干燥Cl2反应的练习和测试题频频出现,而其科学性尚待验证。
同时,苏教版教材中通过实验也说明了,将铁丝灼烧至红热时,铁可与氯气发生化学反应,铁丝剧烈燃烧,产生棕黄色的烟,溶液呈棕黄色,其反应的化学方程式为2Fe+3Cl2点燃2FeCl3。但是此处却并没有指明Cl2是干燥的还是未经干燥的,而在各种考试中也经常出现有关Fe与Cl2的化学反应的辨析,例如过量Fe在Cl2中燃烧是否会生成FeCl2,但通常也不强调是干燥还是湿润的。对此,笔者存在以下困惑:(1)液氯可储存于钢瓶中是否可推出“室温时,干燥氯气不与铁反应”的结论?(2)在室温及酒精灯加热至铁丝红热条件下,Fe与干燥Cl2能否发生化学反应?(3)在室温及酒精灯加热至铁丝红热条件下,Fe与湿润Cl2发生怎样的化学反应?(4)湿润或干燥Cl2如与Fe均发生化学反应,化学反应途径及其产物是否一致?哪一种反应更容易进行,为什么?水所起的作用是什么?(5)Fe与Cl2的反应,无论Fe是否过量,Cl2是否干燥,能否生成FeCl2?
在寻求问题解决的过程中,通过与部分教师及学生的交流,发现这些问题也—直存在于中学的教学当中,尚未得到有效的解决。部分教师表示也曾对“Fe与干燥或湿润Cl2之间的化学反应能否发生或有何不同”感到困惑,但并未对其进行深入探究;部分教师表示曾无意间注意到“室温下,湿润Cl2较干燥Cl2与Fe的反应来得更易进行”,但同样未对其进行探究解惑,在教学中避重就轻,仅依照常见考点要求学生明确“室温下Fe与干燥Cl2不发生化学反应”及“过量Fe与Cl2反应不会有FeCl2生成”;还有部分教师表示从未关注过此现象的差异及对此问题进行思考;在与学生的交谈中,发现大多数学生仅仅是将此作为特殊知识点进行机械记忆而不明其理。
通过进一步查阅文献,发现虽然对Fe与Cl2反应的研究也不少,但几乎都是相关实验的优化与改进,对不同条件下,Fe与干燥或湿润Cl2的化学反应途径及产物的差异尚待研究。因此,本文将通过不同条件下湿润或干燥Cl2与Fe的实验探究与理论分析,厘清Fe与湿润或干燥Cl2的化学反应的差异,以期为中学化学教学提供参考。
2实验探究
事先参考皮振雷的实验室制取氯气的新方法收集两瓶干燥Cl2和两瓶未经干燥的Cl2,依次对室温及加热(使用酒精灯加热至铁丝红热,下同)条件下Fe与干燥或湿润Cl2的化学反应进行探究,以下实验均在20℃室温条件下进行。
2.1铁丝与干燥氯气的反应
分别进行以下操作:(1)将铁丝放人干燥Cl2瓶中(瓶口盖上玻片),反应停止后,加入蒸馏水;(2)加热铁丝至红热并迅速放入干燥Cl2瓶中(瓶口盖上玻片),反应停止后,加入蒸馏水。具体的实验现象及结论详见表1。
2.2铁丝与湿润氯气的反应
分别进行以下操作:(1)将铁丝放人湿润Cl2瓶中(瓶口盖上玻片),反应停止后,加入蒸馏水;(2)加热铁丝至红热并迅速放入湿润cl2瓶中(瓶口盖上玻片),反应停止后,加入蒸馏水。具体的实验现象及结论详见表2。
2.3干燥Cl2与湿润Cl2的比较
通过实验,证明了在室温及加热条件下,干燥与湿润Cl2皆可与Fe发生化学反应,但有所差别,详见表3。
综上,通过本次的实验探究,我们可以得出以下结论:(1)室温下,干燥及湿润Cl2均与铁发生化学反应。其中,干燥Cl2使铁钝化,从而阻止了反应进一步进行;湿润Cl2与铁生成FeCl2。(2)室温下,湿润Cl2与Fe的反应速率程程度明显大于干燥Cl2。(3)在加热条件下,干燥及湿润Cl2均与Fe发生剧烈的化学反应,且两者的反应产物存在明显差异。(4) Fe与Cl2反应可生成FeCl2。endprint
3理论分析
通过实验探究,明确了室温及加热条件下干燥及湿润Cl2均与Fe发生化学反应的事实,后面将通过热力学分析从理论上予以支撑。同时我们也很清晰地看到,在室温条件下湿润Cl2中铁丝变黑的速率及程度均大于干燥Cl2,在加热条件下两者的反应均较为剧烈,肉眼无法判断其先后,但并不排除同样也存在湿润Cl2反应较快的可能性。那么也就引出了一个新的问题:在室温条件下,Fe与湿润Cl2的化学反应更易进行且彻底,其产物为FeCl2,这是为什么?水在此起到了什么作用?是否水的存在会影响Fe与Cl2的反应途径及产物?如果是,又是如何影响的?针对此现象,本文试图通过理论分析寻求合理的解释。
3.1 水的存在影响Fe与湿润Cl2反应的可能途径
干燥Cl2中只含有氯气分子,而由于氯气能与水发生化学反应生成盐酸和次氯酸,因此湿润Cl2中可能含有Cl2、H2o、HC1、HC1o几种物质。基于此,猜想并分析了湿润Cl2的反应途径存在的几种可能性。
(1)氯气与水进行化学反应,而其产物进一步与Fe反應。
大多数中学教师都将“为何强调室温时不与Fe发生化学反应的Cl2是干燥的”这个问题解释为在湿润Cl2中,氯气与水反应生成了盐酸,铁与盐酸反应生成了氯化亚铁,而氯化亚铁被次氯酸进一步氧化成了氯化铁。显然这个说法是有待商榷的。通过本实验,我们可以很清晰地看到,室温时,湿润Cl2使铁丝变黑的速率及程度明显大于干燥Cl2,更重要的是,其所形成的水溶液是浅绿色的,而湿润Cl2如果是经历了以上的反应过程,则与实验现象不符,因此,这种说法是不合理的。
(2)氯气、水与铁之间形成了原电池。
O2与Cl2均为可与铁反应的氧化性相近的非金属单质气体,又铁在潮湿空气中形成原电池,因此猜想铁在潮湿Cl2中形成了原电池,发生如下电极反应,正极:C12+2e-=2Cl-;负极:Fe-2e-=Fe2+;电极总反应式为Fe+Cl2一FeCl2。实验证明,室温条件下,Fe与湿润或干燥Cl2的实验现象有明显区别,Fe与潮湿Cl2的反应速率大于干燥Cl2,且湿润Cl2无论是室温还是加热条件下,其反应后的水溶液都可观察到绿色,这与铁在潮湿Cl2中形成了原电池的猜想相符合。
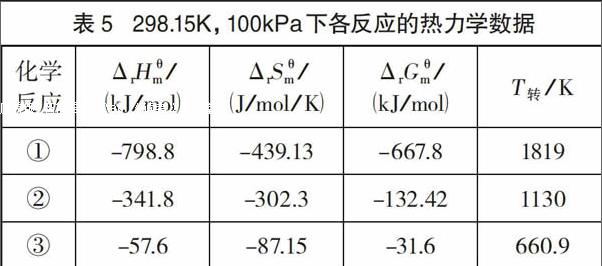
通过查阅资料,获得了化学反应2Fe+3Cl2=2FeCl3①,Fe+cl2=FeCl2②,2FeCl2+Cl2=2FeCl3③,它们的相关热力学数据见表4。通过进一步的计算求得了各化学反应的相关数据,具体详见表5。
由表5可知,三个化学反应方程式的标准吉布斯自由能△rCmθ均小于零,也就是说在298.15K,lOOkPa下,反应①②③皆可自发进行。而虽然△rH和△rS随温度的变化一般是很小的,几乎可以忽略不计,但是△rC随温度的变化存在着明显的变化,不可忽略。由吉布斯一亥姆霍兹公式△rCmθ(T)=△r Hmθ(T)-T△rCmθ(T)可知,在温度低于1819K时反应①可自发进行,温度低于1130K时反应②可自发进行,也就是说满足了原电池形成条件中的白发的氧化还原反应,同时也从热力学的角度支持了室温及加热条件下,干燥及湿润Cl2均与Fe发生化学反应的事实。
3.2水的存在影响Cl2氧化性的强弱
在室温条件下,湿润Cl2使铁丝变黑的速率及程度均大于干燥Cl2,除了形成原电池之外,也存在着由于水的存在加强了Cl2的氧化性的可能性。假设这种可能性成立,则毫无疑问是水与氯气反应生成了氧化性更强的物质,也就是次氯酸。而虽然次氯酸的氧化性大于氯气,但在氯气与水的反应中,由于其为可逆反应且部分氯气会溶于水等,因此次氯酸的浓度是非常小的,其对Cl2氧化性强弱的影响可忽略不计。即使假设其存在增强了Cl2的氧化性解释了反应速率及程度的问题,但却与室温时反应后的水溶液呈浅绿色相违背,因此,由于水的存在加强了Cl2氧化性的可能性假设不成立。
综合以上分析,铁与干燥Cl2直接进行简单的化合反应而与湿润Cl2的反应存在着两种途径,即简单的化合反应和形成原电池,而具体以哪一种为主与反应条件有关。室温时,Fe与干燥Cl2发生钝化反应,而在加热条件下,钝化消失,两者简单化合;而Fe与湿润Cl2在室温时则以原电池的反应为主生成FeCl2,在加热时以简单化合反应为主生成FeCl3。
4铁与氯气的产物
一般情况下,我们认为Fe与Cl2直接化合生成FeCl3(S),而FeCl3(S)与Fe是不发生化学反应的,因此,过量的Fe与Cl2反应,其产物也只有FeCl3,而不生成FeCl2。而由表5可知,当T>660.9K时,△rC>O,反应③逆向进行,FeCl2(s)与Cl2不再结合生成FeCl3(S),同时FeCl3(S)开始分解生成FeCl2(s)与Cl2。由此,从实验探究及热力学理论分析可知,Fe与Cl2的反应,无论Fe是否过量,Cl2是否干燥,皆可生成FeCl2。
5结论
本文通过实验探究及理论分析,一方面解决了中学教学中存在的困惑及误区,否定了中学教师及学生脑中“室温时,Fe不与干燥Cl2反应”、“Fe与Cl2反应不生成FeCl2”的错误观念。另一方面探究出了Fe与干燥或湿润Cl2的化学反应的不同途径,即室温时,铁与干燥Cl2发生钝化反应而加热时两者简单化合生成FeCl3;与湿润Cl2有两种反应途径,其主要反应途径及产物随反应条件的变化而有所不同,室温时以原电池反应为主生成FeCl2,加热时则以简单化合反应为主生成FeCl2。
