冷藏雄鼠尸体应用于小鼠运输及意外死亡后品系恢复的可行性
2018-02-21周建丽曾文滔
周建丽 王 颖 曾文滔 梅 云
(南京医科大学医药实验动物中心,南京 211166)
模型鼠的大量涌现使得动物交流变得频繁,增加科研合作的同时也给饲养环境及微生物安全带来风险,多数动物房对活体动物采用生物净化或是引进冷冻精子和胚胎[1],但对于少量品系的运输还是存有弊端,公共交通工具对活体动物和液氮罐实行禁运,而专门机构的运输价格较昂贵。因此,简单易行的运输方法对小鼠品系交流有较好的实用意义。此外,部分基因模型鼠由于基因表达或实验使用等原因造成种鼠数量少,期间出现小鼠病重或意外死亡,对该品系往往是毁灭性的,而这些品系雄鼠精子多数仍具备可受精能力,如果合理保存小鼠尸体并借助辅助生殖技术可挽回品系[2-4],避免品系的丢失和资源的浪费。小鼠的运输及突发性死亡的应急方案被越来越多的实验者所关注。
辅助生殖技术在小鼠中应用广泛[5-9],有报道对4 ℃冷藏20多天的精子经单精子注射(ICSI)获得了健康后代,冷藏24 h内的精子可得到IVF后代[10-11],附睾尾携带方便,经IVF或ICSI得到后代能有效避免活体携带病原微生物的感染风险[1],同时减少了种资源冷冻复苏的繁琐流程。目前关于配子冷藏的文献多见ICR、B6D2F1等封闭群或杂交品系,周龄也是刚成年的小鼠[2],本文对5月龄C57BL/6 J雄鼠尸体4 ℃冷藏24、48、72 h和96 h后进行IVF,以期为同业人员的小鼠品系运输和意外死亡品系恢复等提供短期保存方案。
1 材料与方法
1.1 实验动物及饲养环境
5月龄C57BL/6 J雄鼠、3~4周龄体质量9~14 g 的C57BL/6 J雌鼠和2~3月龄ICR雌鼠,均购自南京医科大学实验动物中心(SCXK(苏)2016-0002)。雄鼠单只饲养,雌鼠适应光照周期1周,饲养与实验均在南京医科大学实验动物中心屏障环境(SYXK(苏)2016-0016),环境温度20~26 ℃,湿度40%~70%,光照周期12 L:12 D,光照时间 08:00—20:00。动物实验方案经过南京医科大学实验动物使用与管理委员会(IACUC)批准,并按实验动物使用的3R原则给予人道的关怀。
1.2 主要仪器与耗材
生物安全柜(Esco,class II type A2)、冰箱(Haier)、CO2培养箱(Binder)、体视显微镜(Olympus)、冷光源(Olympus)、移植器械1套。促卵泡液(Equine chorionic gonadotropin,eCG,PMSG)、促排卵液(Human chorionic gonadotropin,HCG)、获能液(Modified KrebsRinger bicarbonate solution,TYH)[5,12]、受精液(Human tubal fluid,HTF)[5]、培养液M16(Sigma, M7292)、石蜡油(Sigma,M8410)、35 mm培养皿(Corning,430165)、φ2.5 mm毛细管、胚胎测试水(H2O;Sigma,W1503)、溶液配制试剂全部购置于Sigma。
1.3 配子分组准备
实验组雄鼠每3只一组,分为4组,脱颈处死后,整只装入自封袋放于4 ℃冰箱冷藏,分别冷藏24、48、72 h和96 h后取附睾尾IVF,对照组雄鼠处死后立即取附睾尾IVF。雌鼠于16:30腹腔注射5 IU/只 PMSG,48 h 后腹腔注射5 IU/只HCG促排卵。
1.4 体外受精与培养
按Takeo和Nakagata[5]及刘科等[6]的方法进行精子采集、获能和体外受精。φ2.5 mm玻璃管拉制洗卵针,吸取精卵复合体在M16培养液中反复吹洗3遍,去除碎裂、未成熟等不具受精能力的卵子,体视显微镜下统计受精卵数目,移入干净的M16培养液中培养。
1.5 胚胎移植及附植率统计
每只ICR受体鼠单侧输卵管移植6枚2细胞胚胎,第13.5天处死孕鼠记录胚胎附植率,受体制备及胚胎移植参见文献方法[8]。
1.6 统计方法
χ2独立性检验、Fisher确切概率法分析IVF受精率,以P<0.05为差异有显著性。
2 结果
2.1 IVF受精率
受精率随冷藏时间急剧下降,对照组受精率为95%、冷藏24~96 h分别为70.3%、24.7%、1.6%、0%(图1),72 h和96 h冷藏后不能用作IVF,对照组与冷藏24、48 h受精率差异极显著(P<0.01)(表1)。
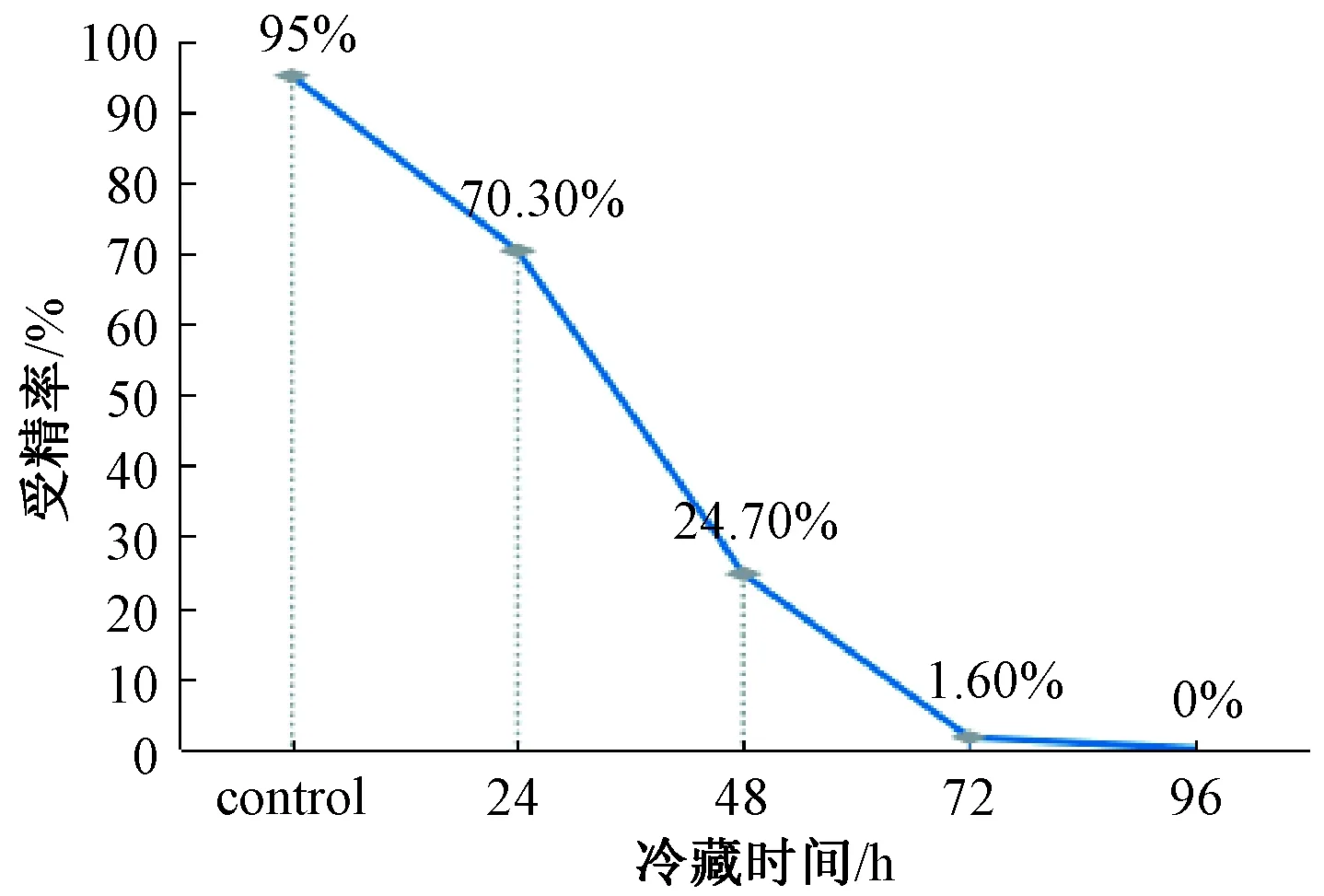
图1 受精率趋势Fig.1 Tendency of fertilization rate

组别GroupsMII卵/枚Number of MII eggs受精卵/枚Number of fertilized eggs受精率/%Rate of fertilized24 h14510270.3∗∗48 h1944824.7∗∗对照组Control20719795
注:**表示与对照组差异极显著(P<0.01)
Note:**Extremely significant difference(P<0.01)
2.2 组内受精率比较
冷藏24 h组受精率分别为73.0%、60.0%和77.0%,组内差异极显著(P<0.01),但受精率均达到50%以上,可用于冷藏IVF。48 h组有1只雄鼠精子的受精率达到50%以上,受精率分别为3.7%、0%和55.4%,组内差异极显著(P<0.01),组内波动很大,不可用于冷藏IVF。对照组受精率为94.4%、93.7%和97.1%,组内无显著性差异(表2)。
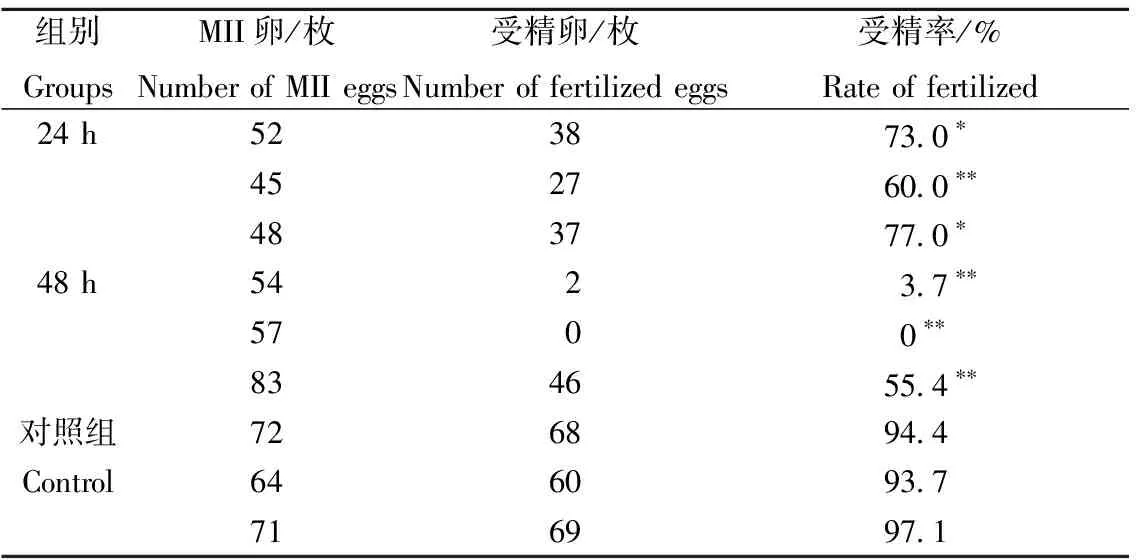
表2 冷藏24 h、48 h与对照组组内受精率比较Table 2 The comparison of the fertilization rate in therefrigerated groups and the control group
注:*表示组内差异显著(P<0.05)、**表示组内差异极显著(P<0.01)
Note:*Significant difference(P<0.05)、**Extremely significant difference(P<0.01)
2.3 胚胎发育能力
各实验组受精卵均发育至2 细胞胚胎。将24 h组和对照组得到的2细胞胚胎分别单侧输卵管移植5只受体,分别妊娠4只、5只,第13.5天获得胎儿15只(60%)和20只(66%),证明冷藏精子对早期受精卵发育无影响(表3、图2、图3)。

表3 胚胎发育能力Table 3 The ability of embryonic development
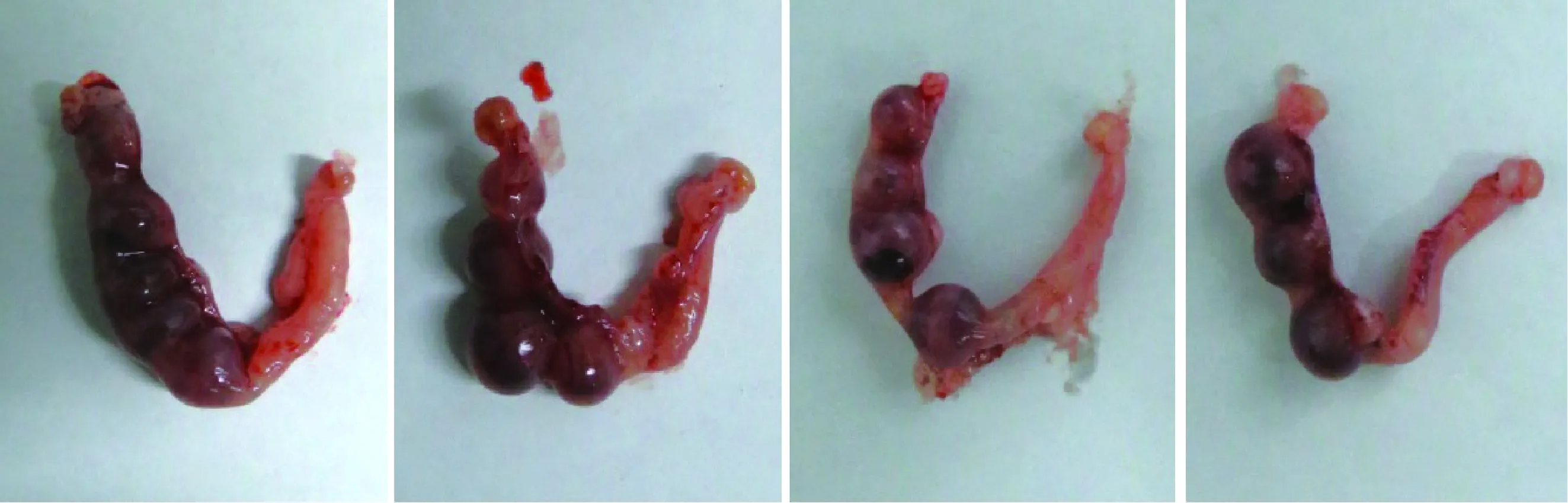
图2 24 h组移植第13.5天的附植胚胎Fig.2 The implantation embryos for 13.5 days in 24 h group
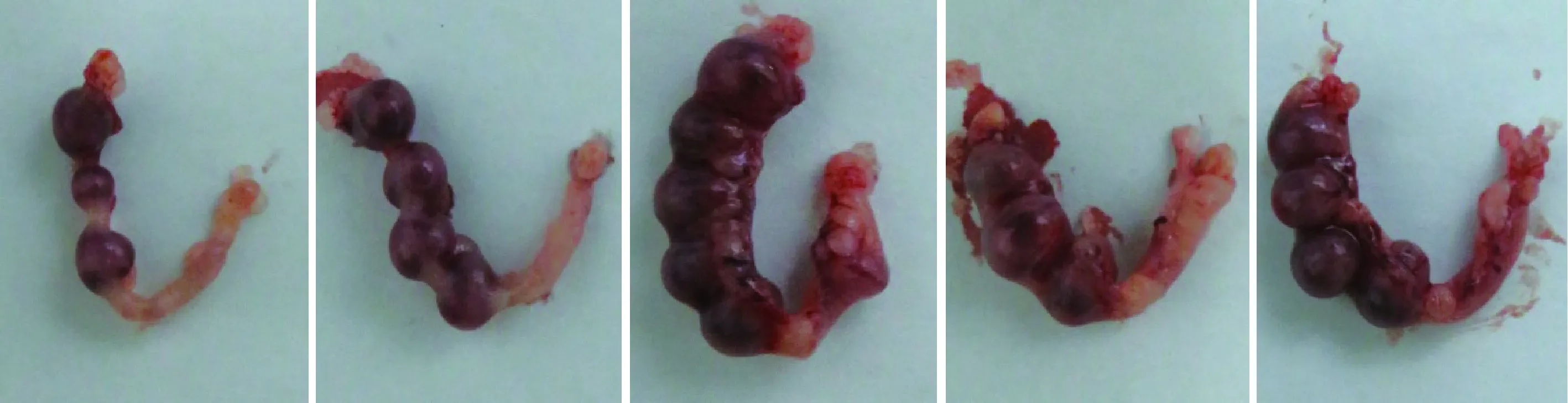
图3 对照组移植第13.5天附植胚胎Fig.3 The implantation embryos for 13.5 days in control group
3 讨论
结果显示,精子冷藏24 h的受精率虽然与对照组受精率差异显著,但单只受精率均可达到50%以上,完全具备品系恢复的能力;冷藏48 h 后仍具备IVF能力,但组内差异显著,仅1只鼠达到50%以上;冷藏72 h仅个别卵子受精;冷藏96 h显微镜下观察仍有很大一部分活动精子,但已不具备受精能力。各组所得受精卵全部可发育至2细胞胚胎,胚胎移植后能正常附植,证明精子经冷藏后对胚胎发育没有影响。受精失败的主要原因是随着冷藏时间增加对精子的活力影响增大,精子运动速度和尾部摆动幅度都相应减小,精子获得动能的时间也相应增加,96 h组精子需要在培养箱内孵育2 min左右才出现游动精子。对于长时间冷藏的小鼠只有通过透明带打孔或是ICSI才能得到后代[10-11]。
所有保存方法对精子的伤害是不可避免的[10],Takeo等曾对比了器官保存液(Lifor)、石蜡油、M2和CPS-l在4~8 ℃冷藏附睾尾对精子受精能力的影响,发现72 h后Lifor较其它组效果好[4],证明不同的保存液以及留样方式对精子活力具有一定影响,本实验考虑到饲养过程中病重鼠或意外死亡做的紧急处理,采用整鼠冷藏后取精子IVF,腔内脏器腐败对附睾内精子可能也存在一定影响,有条件的设施可采用Lifor辅助保存。实验结果证明大周龄小鼠在冷藏24 h内具备稳定IVF受精能力,为小鼠运输和意外死亡提供一个安全便捷的处理方案。
