scFv17改善12月龄三转基因小鼠步态的作用*
2018-02-21胡梦明张秀敏董雪帆祁金顺
王 婷, 曹 越, 胡梦明, 张秀敏, 董雪帆, 祁金顺, 张 军, 杨 威
(山西医科大学生理学系, 细胞生理学省部共建教育部重点实验室, 太原 030001)
目前全世界有4680万人患有痴呆症,这一数字估计到2050年会增加至1亿3150万,这将对社会和家庭带来越来越重的负担[1]。阿尔茨海默病(Alzheimer’s disease, AD)是一种发生在中枢神经系统的原发性、进行性、神经退行性疾病[2],AD 的主要临床症状包括认知、记忆和精神行为方面的损害,典型的病理改变包括脑内出现高密度的老年斑(senile plaques, SP)、神经原纤维缠结(neurofibrillary tangles, NFT)以及突触功能障碍和神经元的丢失,SP的主要成分是有神经毒性的淀粉样β蛋白(amyloid β protein, Aβ),NFT是由细胞内过度磷酸化的tau蛋白形成的[2]。虽然AD的典型症状是进行性的认知和记忆损害,但是平衡和步态紊乱带来的生活无法自理已经干扰了老年人多年[3, 4]。AD病人摔倒风险较正常老年人要大,这些病人多数步幅长度缩短,步幅速度减慢,步间变异度增加[5, 6]。同时AD动物模型,APPswe /PS1dE9双转基因小鼠以及PS1M146V/APPswe/tauP301L三转基因小鼠(3xTg-AD)的步态变化也有文献报道[7, 8]。但迄今为止,关于造成痴呆病人步态紊乱的病理原因还不清楚。
虽然大脑是AD病理影响的主要部位,但是有研究报道在小脑皮层的分子层和颗粒细胞层也有Aβ的散在沉积[9, 10]。除了Aβ沉积,AD病人小脑也同大脑半球一样,体积缩小[11]。家族性阿尔茨海默病(familial Alzheimer’s disease,FAD)与散发性阿尔茨海默病(sporadic Alzheimer’s disease, SAD)相比,小脑浦肯野细胞明显减少,而且反应性星形胶质细胞增多[12]。小脑是控制机体运动协调性和平衡的关键结构,小脑萎缩多由于浦肯野细胞死亡引起,而浦肯野细胞作为小脑皮层的唯一传出神经元,在小脑回路中扮演着中心作用,它的损害/退化表现为共济失调、异常的肢体运动和步态[13, 14]。以上研究结果说明AD病人小脑存在同大脑相似的病理改变并可能参与步态紊乱的发展过程。但是目前为止,人们对AD的小脑病理关注甚少,特别是小脑以及小脑浦肯野细胞的变化对AD的步态影响更是鲜有报道。
Aβ一直被认为是免疫治疗AD的重要靶点[15, 16]。目前关于Aβ免疫治疗的研究虽然很多,但多集中在药物对AD认知或精神障碍的相关作用,尚未有大量文献报道药物对AD步态的作用。我们实验室利用噬菌体展示肽库技术合成的scFv17抗体,是针对Aβ31-355个氨基酸序列作用的单链可变片段,能够在清除Aβ的同时不会因为作用于Aβ的N端而增加可溶性Aβ寡聚体[17],从而大大减轻了副反应。本实验将采用步态行为学和病理学实验手段,观察3xTg-AD小鼠步态变化,研究scFv17对3xTg-AD小鼠步态和相关小脑病理的影响,旨在为AD步态治疗提供新策略及实验依据。
1 材料与方法
1.1 实验动物
实验选用6月龄PS1M146V/APPswe/tauP301L(3x Tg-AD)小鼠和野生型 C57BL/6J (C57)对照小鼠,各24只,雌雄各半。其中,3xTg-AD小鼠购自美国JaksonLab,C57小鼠由山西医科大学动物实验中心提供。所有动物在本实验室的独立送风系统(IVC)动物房繁殖及饲养,动物房温度为20~25 ℃,室内保持12 h光照 -12 h 黑暗循环,并保证小鼠充足的进食和饮水提供。
1.2 实验试剂
药物单链抗体scFv17是上海生工生物工程有限公司根据我们给予的Aβ31-355个氨基酸序列经过多肽合成→小鼠免疫及RNA提取→scFv重组抗体噬菌体抗体库构建→单链抗体文库筛选→蛋白表达纯化的过程制备生产而来。药物溶解于pH=7.4的PBS中,终浓度为1.85 mg/ml,分装后储存于﹣80℃冰箱。在小鼠12月龄时,以鼻饲方式每次给予给药组小鼠1.5 mg/kg的scFv17,即给药组每只小鼠每次20 μl的scFv17滴鼻处理,对照组每只小鼠每次则给予同体积0.01 mol/L PBS。每周两次,持续给药12周后开始步态行为学测试。实验中采用的抗体及主要试剂:尼氏染色液(碧云天,中国);Biotin-羊抗兔IgG、Biotin-羊抗鼠IgG (博士德,中国);Anti-β-Amyloid(6E10)抗体(BioLegend,美国);Anti-Human PHF-Tau (AT8)抗体(Thermo Science,美国)等。
1.3 主要实验仪器
步态分析仪器RunwayScan3.0平板步态分析系统(CleverSys Inc., Reston, VA, USA)、石蜡包埋机(EG1150H,Leica,德国)、石蜡切片机(RM2245,Leica,德国)、摊片机(KD-P,KEDEE,浙江,中国)、Scanscope数字病理切片扫描成像系统(Aperio,Leica,德国)等。
1.4 实验分组及给药
给与药物单链抗体scFv17前,利用RunwayScan3.0平板步态分析系统对6月龄,9月龄和12月龄的3xTg-AD 小鼠和野生型 C57BL/6J (C57)对照小鼠进行步态变化监测,12月龄时发现步态变化明显,便将两组不同的小鼠随机分为WT给PBS (WT+PBS)、WT给药(WT+scFv17)、3xTg-AD给PBS (3xTg-AD+PBS)以及3xTg-AD给药(3xTg-AD+scFv17)四组。药物溶解于pH 7.4的PBS中。在小鼠12月龄时,以鼻饲方式按照1.5 mg/kg/次的剂量将scFv17给予给药组小鼠,即给药组每只小鼠每次20 μl scFv17滴鼻处理,给PBS组每只小鼠每次则给予同体积0.01 mol/L PBS。每周两次持续给药12周后开始步态行为学测试。
1.5 步态行为测试
3xTg-AD实验鼠和C57BL/6野生型鼠在20 s (2 000帧)内2~3次自由通过暗环境中的长115 cm,宽6.5 cm的玻璃跑道,此期间其中一段设定好长度范围(30 cm)的玻璃跑道的爪印被BcamCapture软件采集并且由RunwayScan软件分析。实验前每只小鼠放至跑道中让其探索习惯跑道以确保其每次必须连续无停顿地朝一个方向通过设定好的30 cm长度范围玻璃跑道。RunwayScan3.0分析系统在识别并标记出每—个脚印后,将自动产生一系列步态参数,包括站立时间百分比(stance time percent)、迈步时间百分比(swing time percent)、两后脚距离即后爪步幅宽度(rear track width)等,每个足至少采集到连续的11个脚印其参数才能被统计。因为步态参数会受体重影响而有所波动[18],进行步态实验之前,我们对每组的小鼠称重,每只小鼠体重接近25±5 g。实验过程中体重过大或者过小的鼠,在设定好30 cm长度范围内停顿、转向或停滞不前的鼠,均不纳入统计范围。
1.6 小脑组织取材
步态行为学之后,WT+PBS组和WT+scFv17各取4只小鼠,3xTg-AD+PBS和3xTg-AD+scFv17各取3只小鼠,将其用5%的水合氯醛麻醉后,剪开胸腔,暴露心脏和肝脏,将灌注针头插入左心尖,同时剪开右心耳,先快后慢灌注30 ml 0.01 mol/L PBS后改灌30 ml的4%多聚甲醛,灌注结束后小鼠尾巴直立翘起,四肢僵硬,此时,断头,取下全脑放入4%多聚甲醛固定24 h。固定之后的全脑经过修整,弃去大脑和小脑一侧半球,将剩余小脑脑组织经梯度酒精脱水,透明,矢状面朝下浸蜡包埋。包埋好的蜡块-20℃冰箱放置一段时间后进行连续矢状位切片,厚度2 μm,每个脑组织选取4~6片小叶完整的脑片进行各项试验。
1.7 HE染色
将小脑石蜡切片烘干后常规脱蜡至水,后用苏木精水溶液染10 min,再经盐酸乙醇分化数秒,乙醇伊红染色液染色5 min后脱水透明,封片。后经Scanscope数字病理切片扫描成像系统扫描以及截图,观察比较小脑组织结构变化。
1.8 尼氏染色
将烘干的小脑切片严格按照试剂盒的说明书进行脱蜡染色。脱蜡:二甲苯中脱蜡5~10 min,共三次,无水乙醇5 min,90%乙醇2 min,70%乙醇2 min,蒸馏水2 min;尼氏(Nissl)染色:尼氏染色液染色3~10 min,蒸馏水洗涤2次(每次数秒钟即可),95%乙醇约5 s;脱水、透明、封片:95%乙醇脱水2 min,换用新鲜的95%乙醇再脱水2 min,二甲苯透明5 min,换用新鲜的二甲苯,再透明5 min,用中性树胶封片。显微镜下观察,细胞呈现斑驳的蓝紫色染色。晾干的片子经Scanscope数字病理切片扫描成像系统扫描、截图、处理,每张小脑脑片选取4~5个区域,进行尼氏染色阳性细胞计数,最后取一张脑片的平均计数,并比较单位长度尼氏染色阳性细胞数。
1.9 免疫组化
石蜡切片置60℃烤箱烘烤2 h后常规脱蜡至水;蒸馏水洗2次,各2 min;微波修复抗原:将切片浸入枸橼酸盐缓冲液(pH 6.0)中,放置在微波炉中加热至沸腾,冷却至室温;0.01 mol/L PBS洗涤,2 min×2次;3% H2O2溶液阻断过氧化物酶, 10 min;0.01 mol/L PBS洗2 min×2次;血清封闭30 min;弃去血清,滴加适当比例(6E10为1∶500、 AT8为1∶30)稀释的一抗,4℃冰箱过夜;室温放置1 h,PBS洗2 min×2次;滴加二抗,37℃孵育30 min;PBS洗2 min×2次;滴加辣根酶标记链霉素卵白素三抗,37℃反应20 min;PBS洗2 min×2次;DAB 显色1~2 min,蒸馏水终止显色后充分水洗。苏木素常规复染、梯度酒精脱水、二甲苯透明、中性树脂封片,阴凉通风处存放。晾干的片子经Scanscope数字病理切片扫描成像系统扫描、截图后采用Image-Pro-Plus 6.0软件处理分析,针对小脑蚓部6E10反应阳性的Aβ 斑块进行计数,而对AT8反应阳性的浦肯野细胞进行灰度值测定,最后比较单位面积的Aβ 斑块数目及NFT的相对光密度值。
1.10 统计学处理
应用SPSS 13.0软件对数据进行统计分析。多组间均数显著性检验应用One-Way ANOVA,其中方差齐性资料采用LSD检验进行两两组间比较;非齐性资料用Tamhane’S T2检验。所有数据均采用均数±标准误表示。作图使用Sigmaplot 10.0 软件。
2 结果
2.1 12月龄3xTg-AD小鼠运动协调和平衡能力观察
平步步态行为测试可以检测小鼠的运动协调和平衡能力。本研究发现(表1),6 月龄、9月龄、12月龄 WT组小鼠的后爪步幅宽度(rear track width)无显著差异(P>0.05);12月龄的3xTg-AD小鼠相对于6、9月龄的3xTg-AD小鼠来讲,后爪步幅宽度更宽(P<0.01);此外,和同月龄WT组小鼠相比,12月龄的3xTg-AD小鼠的后爪步幅宽度明显增宽(P<0.01)。本研究还发现(表1),6、9、12月龄WT组小鼠的站立时间百分比(stance time percent)和摇摆时间百分比(swing time percent)无显著差异(P> 0.05);12月龄3xTg-AD小鼠相比6、9月龄的3xTg-AD小鼠站立时间百分比更大(P<0.01),摇摆时间百分比更小(P<0.01);6月龄的WT组小鼠和3xTg-AD小鼠相比,两个百分比无显著差异(P> 0.05),9月龄的3xTg-AD小鼠的站立时间百分比和摇摆时间百分比与WT组小鼠的相比也无显著差异(P> 0.05),然而12月龄的3xTg-AD小鼠的摇摆时间百分比明显低于同月龄WT组小鼠(P<0.01),站立时间百分比明显高于同月龄的WT组小鼠(P< 0.01)。以上结果表明3xTg-AD小鼠可能在12月龄时运动协调和平衡能力出现严重损伤。
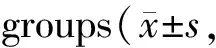
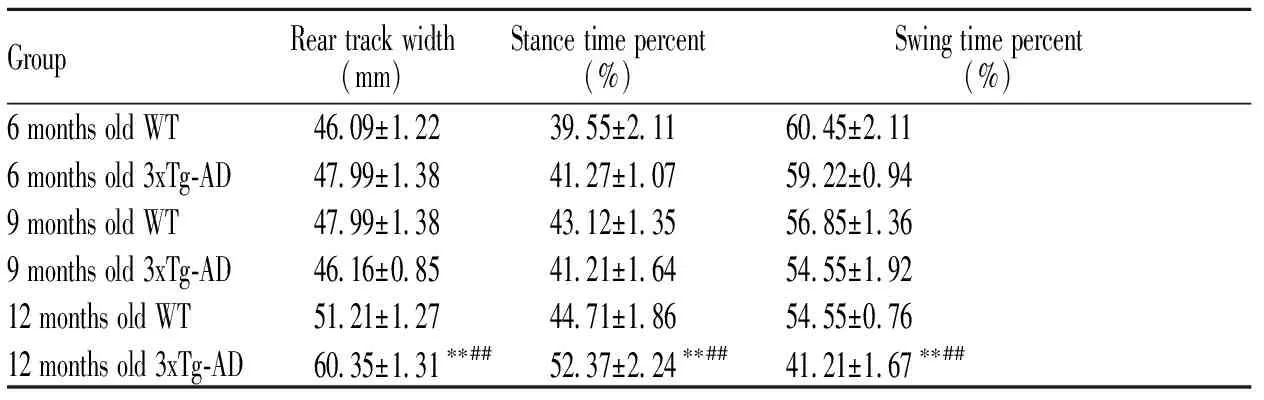
GroupRear track width(mm)Stance time percent(%)Swing time percent(%)6 months old WT46.09±1.2239.55±2.1160.45±2.116 months old 3xTg-AD47.99±1.3841.27±1.0759.22±0.949 months old WT47.99±1.3843.12±1.3556.85±1.369 months old 3xTg-AD46.16±0.8541.21±1.6454.55±1.9212 months old WT51.21±1.2744.71±1.8654.55±0.7612 months old 3xTg-AD60.35±1.31∗∗##52.37±2.24∗∗##41.21±1.67∗∗##
**P<0.01vs9 months old 3xTg-AD group;##P<0.01vs12 months old WT group
2.2 scFv17对12月龄3xTg-AD小鼠运动协调和平衡能力的作用
与WT+PBS组相比较,3xTg-AD+PBS组小鼠的后爪步幅宽度明显增宽(P<0.01);WT+scFv17组的后爪步幅宽度与WT+PBS组无统计学差异(P>0.05),但3xTg-AD+ scFv17组的后爪步幅宽度明显小于3xTg-AD+PBS组(P<0.05,图1,表2,图1见彩图页Ⅰ)。3xTg-AD+PBS组小鼠相比WT+PBS组,站立时间百分比明显增大(P<0.01),而摇摆时间百分比明显减小(P<0.01);WT +scFv17组的两个时间百分比参数与WT+PBS组的无统计学差异(P>0.05),但经scFv17治疗后的3xTg-AD小鼠站立时间百分比明显小于3xTg-AD+PBS组(P< 0.01),摇摆时间百分比明显大于3xTg-AD+PBS组(P< 0.01)。以上结果表明慢性给予scFv17可以改善大月龄的3xTg-AD小鼠出现的运动协调和平衡能力障碍。
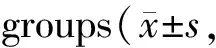
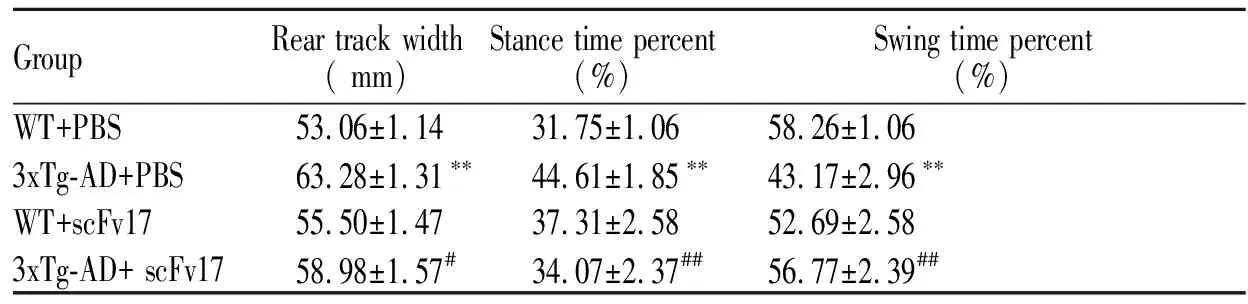
GroupRear track width( mm)Stance time percent(%)Swing time percent(%)WT+PBS53.06±1.1431.75±1.0658.26±1.063xTg-AD+PBS63.28±1.31∗∗44.61±1.85∗∗43.17±2.96∗∗WT+scFv1755.50±1.4737.31±2.5852.69±2.583xTg-AD+ scFv1758.98±1.57#34.07±2.37##56.77±2.39##
**P<0.01vsWT+PBS group;#P<0.05,##P<0.01vs3xTg-AD+PBS group
2.3 scFv17对3xTg-AD小鼠小脑浦肯野细胞形态结构的影响
WT+scFv17组和WT+PBS组小鼠的小脑浦肯野细胞排列整齐密集,细胞结构清晰,胞浆红染胞核蓝染,胞核圆形或椭圆形,核仁清晰,形态正常;3xTg-AD+PBS组小鼠的小脑浦肯野细胞排列比较稀疏,轮廓模糊,凋亡细胞多,经scFv17治疗后的3xTg-AD小鼠细胞凋亡程度轻,形态较3xTg-AD+PBS组小鼠有所改善(图2,见彩图页Ⅰ)。
2.4 scFv17对3xTg-AD小鼠小脑浦肯野细胞损伤的作用
WT+PBS组小鼠的小脑浦肯野细胞排列规则紧密,胞浆尼氏体染色清晰可辨,受染后呈块状,尼氏体大而数量丰富;3xTg-AD+PBS组小鼠的小脑浦肯野细胞胞浆尼氏体减少甚至消失,表现为尼氏体细胞质着色浅,胞体肿胀;WT+scFv17组和WT+PBS组小鼠无明显差别;但经scFv17鼻饲治疗后的3xTg-AD+scFv17组小脑蒲肯野细胞胞浆尼氏小体数目明显增多(图3,见彩图页Ⅱ)。3xTg-AD+PBS组与WT+PBS组相比,浦肯野细胞密度明显降低(P<0.01);WT+scFv17组和WT+PBS组的细胞密度没有显著差异(P>0.05),但scFv17明显上调了3xTg-AD+ scFv17组浦肯野细胞的数目(P<0.01,表3)。尼氏小体与神经元蛋白合成功能密切相关,3xTg-AD的相关病理损害小脑浦肯野细胞胞浆的尼氏小体,继而干扰其蛋白合成功能,但是单链抗体scFv17有效地改善了这一变化。
2.5 scFv17对3xTg-AD小鼠小脑皮层内Aβ斑块的影响
Aβ斑块沉积是AD的典型病理特征,大量文献证明AD患者和AD转基因鼠的小脑中有Aβ斑块沉积。scFv17是抗Aβ31-35片段单链抗体,能够有效清除脑内Aβ斑块沉积。WT组给予PBS和scFv17药物的小鼠小脑未见明显的Aβ斑沉积;而3xTg-AD+PBS组小脑内可见明显的6E10染色阳性斑块,且斑块主要沉积在浦肯野细胞(PCs)层附近(图4,见彩图页Ⅱ)。较WT+PBS组相比,3xTg-AD+PBS组Aβ斑块数量明显增多(P<0.01)。而慢性鼻饲scFv17后,3xTg-AD小脑内Aβ斑块沉积明显减少(P<0.01,表3)。
2.6 scFv17对3xTg-AD小鼠小脑浦肯野细胞层神经原纤维缠结的影响
Aβ斑块作为AD的典型病理特征,它的沉积可以引发tau蛋白的过度磷酸化,继而聚集形成神经原纤维缠结(NFT)。上述实验已证明scFv17有效地减少3xTg-AD小脑内的Aβ斑块数量,我们想进一步验证scFv17是否可以减少浦肯野细胞内NFT的表达。WT+PBS组和WT+scFv17组PCs内几乎不存在神经原纤维缠结(NFT)(P>0.05);但是相对于WT+PBS组3xTg-AD+PBS组小脑PCs存在大量的NFT(P<0.01);单链抗体治疗组3xTg-AD+scFv17组的PCs内的NFT大幅度减少(P<0.01)(图5,表3,图5见彩图页Ⅲ),提示scFv17明显减少了PCs内的NFT。

GroupDensity of Purkinje cells (PCs) stained by Nissl staining(n/μm)Number of Aβ plaques in the cerebellar cortex(n/μm2)Relative optical density of AT8 positive Purkinje cellsWT+PBS0.032±0.0010.001±0.0000.068±0.0033xTg-AD+PBS0.012±0.001∗∗0.001±0.000∗∗0.113±0.005∗∗WT+scFv170.036±0.0010.001±0.0000.065±0.0023xTg-AD+ scFv170.028±0.002##0.002±0.000##0.097±0.002##
**P<0.01vsWT+PBS group;##P<0.01vs3xTg-AD+PBS group
3 讨论
AD作为常见的神经退行性疾病之一,研究者们除了对其病因、发病机制、病理,尤其是认知功能进行探究以外,在发掘AD步态改变方面也取得了重大进展。AD患者较正常人更容易摔倒,平衡能力更差[19]。以往研究结果表明,早期病人或者轻度认知障碍(MCI)患者的小脑共济失调步态变化不明显或者不存在,而家族性伴有基因突变的严重痴呆病人常伴有小脑共济失调步态。如AD患者早期出现双腿支撑时间延长,步幅减小,但步幅宽度无变化[20],PS1-E280A 家族性AD(FAD)患者有小脑共济失调症状和运动障碍[21],携带Osaka (E693)突变体的家族性AD患者有着严重的痴呆和小脑共济失调症状和步态紊乱[22]。在本实验中,我们采用3xTg-AD转基因小鼠作为实验模型鼠,选取更能反映小脑功能的步幅宽度,摇摆时间和站立时间为主要测试指标。步幅宽度是指左右两足间的横向距离,是反映步态稳定性的指标。步幅宽度越窄,步态的稳定性越差。站立相与摇摆相的时间之比可以评定步态的对称性。我们发现12月龄3xTg-AD小鼠后爪步幅宽度明显增大,站立时间和摇摆时间百分比明显改变,提示12月龄3xTg-AD小鼠出现了小脑共济失调步态,运动协调和平衡能力受损。这说明认知严重受损的大月龄3xTg-AD小鼠出现了小脑共济失调步态变化,运动协调和平衡能力严重受损。
小脑是控制机体运动协调性和平衡的关键结构,小脑萎缩多由于浦肯野细胞死亡引起,而浦肯野细胞作为小脑皮层的唯一传出神经元,在小脑回路中扮演着中心作用,它的损害/退化表现为共济失调、异常的肢体运动和步态[13,14]。AD患者和不同种类的AD转基因模型鼠的小脑有着同海马相似的病理改变,这一点在大量研究中已得以证实。APPswe/PS1dE9小鼠18/20月龄时小脑蚓部面积小于野生型对照组;6月龄的小脑中几乎没有斑块,但是12月龄出现斑块,18/20月龄的斑块更多,且主要分布在分子层,少数分布在颗粒细胞层;18/20月龄的浦肯野细胞和蓝状细胞数目减少[23]。本实验结果显示,3xTg-AD小鼠在12月龄时才出现步幅宽度增加等运动协调及平衡能力下降的现象。我们猜测大月龄AD转基因小鼠小脑共济失调症状的出现可能与小脑严重病理改变,Aβ斑块出现较晚,继而引起浦肯野细胞损伤出现较晚有关。
长期以来,人们认为Aβ是治疗AD的重要靶点[15,16],做了大量的针对Aβ的免疫治疗。在斑块沉积早期阶段(5~6月龄)以及有大量Aβ沉积和胶质增生的大月龄(24月龄),对APPswe/PS1dE9 小鼠进行抗pE3-Aβ单克隆抗体mAb被动抗免疫治疗,减少了海马和小脑中Aβ[24],单链抗体scFv-h3D6 能够保护3xTg-AD小脑深部核团神经元[25]。我们实验室利用噬菌体展示肽库技术合成的scFv17抗体,是针对Aβ31-355个氨基酸序列作用的单链可变片段,能够在清除Aβ的同时不会因为作用于Aβ的N端而增加可溶性Aβ寡聚体[17],因此大大减轻了副反应。本实验采用鼻饲给药的方法,进一步观察了scFv17对3xTg-AD小鼠步态和相关小脑病理变化的影响。实验结果显示,长期鼻饲scFv17可使12月龄的3xTg-AD小鼠后爪步幅宽度减小,摇摆时间延长,站立时间缩短,这表明长期鼻饲scFv17改善了大月龄的3xTg-AD小鼠的运动协调和平衡能力。之后本研究免疫组化结果显示,3xTg-AD 小鼠小脑内Aβ斑块和胞内神经原纤维缠结NFT与正常组相比明显增加,但给予了scFv17后,两者的含量均明显下降。此外,scFv17还上调了3xTg-AD小鼠小脑浦肯野纤维胞浆尼氏小体数量。之前曾有实验证实,9月龄的APP/PS1小鼠和3xTg-AD小鼠小脑皮质内沉积的Aβ会损害神经细胞尼氏小体,破坏细胞[26-29]。因此,scFv17改善浦肯野细胞损伤可能与其清除Aβ功能有关。
综合上述实验结果,我们推测AD小鼠步态行为的改变也可能与小脑内Aβ沉积有关。scFv17可能因为清除Aβ斑块而进一步改善Aβ斑块的继发性病变NFT,保护浦肯野细胞,继而对抗3xTg-AD小鼠步态行为的变化。
