厄贝沙坦对糖尿病大鼠心肌损伤中Notch1信号通路的影响*
2018-02-21康品方郭建路李路佳王洪巨
张 恒, 陶 敏,2, 康品方,2, 郭建路,2, 宣 玲, 高 琴, 唐 碧, 李路佳, 王洪巨Δ
(1. 蚌埠医学院第一附属医院心血管科, 安徽 蚌埠 233004; 2. 蚌埠医学院科研中心, 安徽 蚌埠 233030; 3. 蚌埠医学院生理学教研室, 安徽 蚌埠 233030; 4. 蚌埠医学院临床医学院, 第一分党委, 安徽 蚌埠 233030)
糖尿病心肌病(diabetic cardiomyopathy,DCM)被认为是一种来自大血管和冠状动脉粥样硬化的独立心肌病[1],在1974年由Hamby首次提出,它是指由糖尿病引起心脏微血管病变、心肌纤维化等所致的心肌广泛结构异常一种疾病状态,最终可引起左心室肥厚、舒张期和(或)收缩期功能障碍;其机制涉及心肌代谢紊乱、氧化应激、肾素-血管紧张素系统(renin-angiotensin system,RAS)的激活、钙平衡的破坏、线粒体功能障碍等,其中心肌 RAS活性增高是导致DCM发生发展的重要因素。血管紧张素Ⅱ(angiotensin II,Ang II)是RAS的重要成员,被认为是加重糖尿病心肌损伤的有害介质,其最主要的作用是可诱导细胞肥大、血管增生和细胞外基质蛋白的沉着而引起心室重构。厄贝沙坦是临床上应用较广的AngⅡ受体的抑制剂;我们前期研究发现,厄贝沙坦可通过调节基质金属蛋白酶(matrix metalloproteinases, MMPs) 信号通路中的相关因子减轻糖尿病大鼠所致的肺损伤[2],但厄贝沙坦改善DCM心肌损伤的机制并不十分清楚。
Notch1信号通路是现阶段各种疾病机制的研究热点,它参与内环境的信息传递、细胞间通讯及细胞命运选择等生理过程,同时参与维持心血管系统的正常功能。近年研究表明,其在受损心肌保护和心肌再生方面也可发挥重要作用。Zhang[3]等研究发现,Notch1信号通路被激活后,可增强心肌细胞活力,抑制高糖诱导的心肌细胞凋亡。Jiang[4]等也报道,激活Notch1信号通路可抑制血管内皮细胞的增殖。厄贝沙坦是否通过影响Notch1通路在糖尿病心肌损伤中发挥有益作用,目前鲜有报道。
因此,本实验拟采用高脂喂养+小剂量链脲佐菌素(streptocozin,STZ)腹腔注射的方法建立T2DM大鼠模型[2],探讨厄贝沙坦改善DCM的作用,观察厄贝沙坦心肌保护是否通过Notch1信号通路介导,从而为糖尿病患者的治疗提供新的治疗策略。
1 材料与方法
1.1 复制2型糖尿病大鼠模型
SD雄性大鼠共30只,适应性喂养1周,随机分成4组:正常对照组(Control,CON,n=6)、高糖高脂组(High calorie,HC,n=6)、糖尿病组(Diabetes mellitus,DM)和厄贝沙坦+糖尿病组(Irbesartan + Diabetes group,Ir+DM)。糖尿病组和厄贝沙坦+糖尿病组统称为实验组(n=9)。CON组大鼠常规饮食,其余组大鼠高糖、高脂、高胆固醇饮食(67%基础饲料+20%白砂糖+10%猪油+2.5%胆固醇+0.5%胆酸),4周后实验组大鼠禁食12 h,腹腔一次性注射STZ30 mg·kg-1,建立2型糖尿病模型[5]。72 h后尾静脉采血测空腹血糖,随机血糖连续3天≥16.7 mmol/L者模型复制成功。给予同等剂量柠檬酸钠缓冲液腹腔注射CON组、HC组大鼠。剔除不合格大鼠,将成功模型随机分为糖尿病组(DM组,n=6),厄贝沙坦+糖尿病组(Ir+DM,n=6)。Ir+DM组大鼠给予厄贝沙坦50 mg/(kg·d)连续灌胃,其余组大鼠给予同等剂量的生理盐水灌胃,灌胃至8周。本实验中,实验组出现“三多一少”典型症状,随机血糖持续≥16.7 mmol/L提示糖尿病模型构建成功。高糖高脂组、糖尿病组和厄贝沙坦+糖尿病组TG、TC、FBG一直维持在较高水平,提示糖尿病模型出现脂代谢异常,在高血脂的基础上糖尿病模型复制并成功维持。
1.2 大鼠血浆TG、TC、FBG水平
大鼠麻醉后,腹主动脉采血2 ml,3 000 r.min-1离心后5 min后,取血浆在自动生化分析仪上测定甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)及空腹血糖(fasting blood glucose,FBG)水平。
1.3 大鼠H/B、LVWI水平
4%水合氯醛(1 ml/100 g)腹腔注射麻醉,固定大鼠后行气管插管,打开心腔,迅速取出心脏,预冷的生理盐水冲洗,滤纸吸干,称取全心质量,剪除心表面血管及心房,立即称取左心室质量,以全心质量与体质量之比作为心脏指数(heart weight/body weight,H/B,mg/g),以左室质量与体质量之比作为左室重量指数(left ventricular weight index,LVWI,mg/g)。
1.4 大鼠心肌组织SOD活性、MDA含量变化
大鼠麻醉后,各组大鼠取左心室心肌组织约0.1 g,-80℃冰箱保存,在冰上将心肌组织制成10%组织匀浆,3 000 r.min-1离心15 min后取上清,按试剂盒说明书以酶标仪分别测定心肌组织SOD活性及MDA含量。
1.5 免疫组化检测心肌组织Bcl-2及Bax的蛋白表达
大鼠麻醉后,各组大鼠取左室心肌组织约0.1 g收集放在4%多聚甲醛或10%甲醛溶液中固定,将正常心脏及糖尿病心脏组织标本经过石蜡包埋、切片、抗原修复,加入显色剂等一系列处理后晾干加入显色剂等一系列处理后晾干。显微镜下观察读片,Bcl-2、Bax蛋白以细胞浆内出现棕黄色颗粒为阳性,采用HPLAS-2000高清晰度彩色病理图文报告管理系统对Bcl-2、Bax蛋白表达进行定量分析,以单位面积中阳性反应的总面积/单位面积中细胞的总面积为阳性面积率。
1.6 Western印迹分析检测心肌组织Notch1、Hes-1及Jagged-1的蛋白表达
大鼠麻醉后,取左心室心肌组织约0.1 g,-80℃冰箱保存,实验开始时将0.1 g心肌组织进行裂解获取组织匀浆,4℃离心(12 000 r·min-1,15 min),取上清,蛋白定量后,经15%SDS-PAGE分离,随后,电转膜至PVDF膜,先后加入Notch1、Hes-1、Jagged-1或β-acin一抗,4℃过夜。次日洗涤并加入HRP的二抗IgG 孵育,ECL试剂盒进行曝光成像。凝胶成像系统进行条带的灰度值测量,计算Notch1/β-actin、Hes-1/β-actin、Jagged-1/β-actin蛋白表达的相对量。
1.7 统计学处理
2 结果
2.1 各组大鼠H/B、LVWI水平比较
与CON组相比,HC组H/B、LVWI无明显变化;与CON组、HC组相比,DM组大鼠H/B、LVWI显著增加(P<0.01);与DM组相比,Ir+DM组的H/B、LVWI明显降低(P<0.01, 表1)。

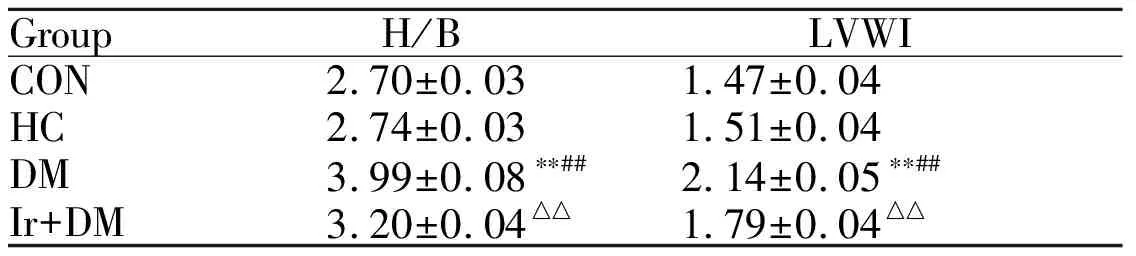
GroupH/BLVWICON2.70±0.031.47±0.04HC2.74±0.031.51±0.04DM3.99±0.08∗∗##2.14±0.05∗∗##Ir+DM3.20±0.04△△1.79±0.04△△
CON: Control group; HC: High calorie group; DM: Diabetes group; Ir+DM: Irbesartan + diabetes group; H/B: Heart weight/body weight; LVWI: Left ventricular weight index
**P<0.01vsCon;##P<0.01vsHC;△△P<0.01vsDM
2.2 各组大鼠血浆TG、TC、FBG变化
与CON组相比,HC组大鼠血浆TG、TC含量均显著增高(P<0.01),FBG无明显变化,DM组及Ir+DM组大鼠血浆TG、TC、FBG明显升高;与HC组相比,DM组及Ir+DM组大鼠血浆TG、TC变化不明显;FBG明显升高(P<0.01);与DM组相比,Ir+DM组的TG、TC、FBG均无明显改变,提示Ir干预后并不影响大鼠血糖和血脂水平(表2)。


GroupTGTCFBG CON0.65±0.251.38±0.215.23±0.27HC7.72±0.62∗∗4.88±0.39∗∗6.12±0.54DM7.65±0.85∗∗4.84±0.52∗∗23.43±3.19∗∗##Ir+DM7.48±1.39∗∗4.82±0.30∗∗21.62±2.37
CON: Control group; HC: High calorie group; DM: Diabetes group; Ir+DM: Irbesartan + diabetes group; TG: Triglyceride; TC: Total cholesterol; FBG: Fasting blood glucose
**P<0.01vsCon;##P<0.01vsHC
2.3 各组大鼠心肌组织SOD活性、MDA含量变化
与CON组相比,HC组大鼠心肌组织SOD活性降低,MDA含量增高(P<0.01,P<0.05),提示高糖髙脂干预引起心肌氧化应激损伤;与CON组、HC组相比,DM组SOD活性进一步降低,MDA含量增高明显(P<0.01),提示心肌氧化应激损伤加重;与DM组相比,Ir+DM组的SOD活性增加,MDA含量降低,提示Ir可减轻糖尿病引起的氧化应激损伤(表3)。

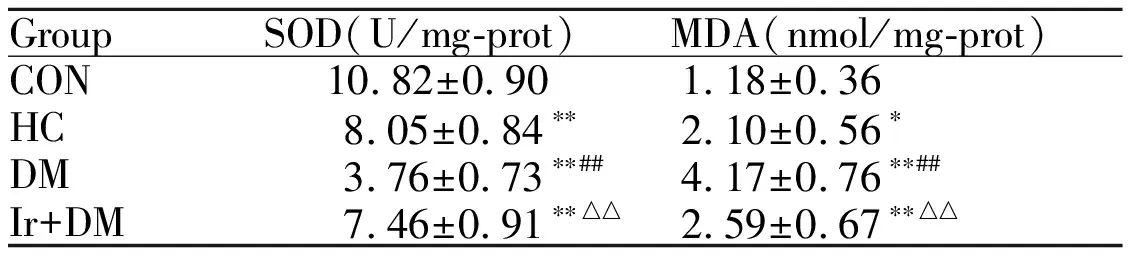
GroupSOD(U/mg-prot)MDA(nmol/mg-prot)CON10.82±0.901.18±0.36 HC8.05±0.84∗∗2.10±0.56∗DM3.76±0.73∗∗##4.17±0.76∗∗##Ir+DM7.46±0.91∗∗△△2.59±0.67∗∗△△
CON: Control group; HC: High calorie group; DM: Diabetes group; Ir+DM: Irbesartan + diabetes group; SOD: Superoxide dismutase; MDA: Malondialdehyde
*P<0.05,**P<0.01vsCon;##P<0.01vsHC;△△P< 0.01vsDM
2.4 免疫组化检测心肌组织Bcl-2及Bax的蛋白表达
与CON组相比,HC组Bcl-2的表达降低,而Bax的表达增加;与CON组相比,DM组Bcl-2的表达明显降低,Bax的表达明显增加,Ir+DM组Bcl-2的表达明显增加,Bax的表达降低;与DM组相比,Ir+DM组大鼠心肌Bcl-2的表达明显增加,而Bax的表达减少,提示Ir干预后可使细胞凋亡减轻(图1,表4,图1见彩图页Ⅲ)。
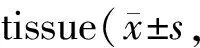

GroupBcl-2 Bax Bcl-2/Bax CON0.81±0.080.16±0.035.40±1.12HC0.65±0.05∗∗0.26±0.04∗∗2.60±0.24∗∗DM0.42±0.04∗∗##0.40±0.04∗∗##1.10±0.09∗∗##Ir+DM0.59±0.05∗∗△△0.28±0.05∗∗△△2.17±0.36∗∗△△
CON: Control group; HC: High calorie group; DM: Diabetes group; Ir+DM: Irbesartan + diabetes group; Bcl-2: B-cell lymphoma-2; Bax: Bcl-2 associated X protein
**P<0.01vsCON;##P<0.01vsHC;△△P<0.01vsDM
2.5 Western印迹分析检测心肌组织Notch1、Hes-1及Jagged-1的蛋白表达
与CON组相比,HC组Notch1、Hes-1及Jagged-1的蛋白表达降低;与CON组相比,DM组Notch1、Hes-1及Jagged-1的蛋白表达明显降低,Ir+DM组Notch1、Hes-1及Jagged-1表达有所增加;与DM组比较,Ir+DM组大鼠心肌Notch1、Hes-1及Jagged-1的表达明显增加,提示Ir的心肌保护作用与Notch1信号通路密切相关(图2,表5)。
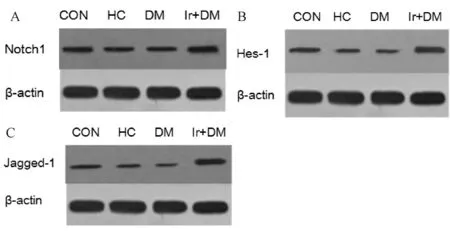

A: Expression of Notch1 detected by Western blot; B: Expression of Hes-1 detected by Western blot; C: Expression of Jagged-1 detected by Western blot; CON: Control group; HC: High calorie group; DM: Diabetes group; Ir+DM: Irbesartan + diabetes group


GroupConHCDMIr+DMNotch10.55±0.010.44±0.02∗∗0.38±0.01∗∗##0.66±0.06∗∗△△Hes-10.45±0.010.32±0.01∗∗0.26±0.01∗∗##0.66±0.05∗∗△△Jagged-10.41±0.010.34±0.02∗∗0.30±0.01∗∗##0.69±0.06∗∗△△
CON: Control group; HC: High calorie group; DM: Diabetes group; Ir+DM: Irbesartan + diabetes group
**P<0.01vsCON;##P<0.01vsHC;△△P<0.01vsDM
3 讨论
糖尿病是一种胰岛素分泌减少或其生物作用受损所引起的代谢紊乱性疾病,DCM是一种独立的糖尿病并发症,主要表现为左心室肥厚和舒张功能降低[6,7]。DCM不仅有心肌细胞的病理改变,且存在间质纤维化与心室重塑。长期高糖状态可导致心肌细胞代谢异常,诱导心脏功能障碍,本实验在高脂血症的基础上成功复制了2型糖尿病模型,8周时FBG水平显著高于正常组,提示模型复制且维持成功,DM大鼠心脏H/B,LVWI增加,TG、TC增加明显,SOD、Bcl-2/Bax表达降低、MDA升高,提示糖尿病可引起心肌重构,使细胞氧化应激和凋亡增加。
MDA是反映脂质过氧化程度的常用检测指标之一,SOD增加可对抗机体氧化应激损伤[8]。Bcl-2家族中Bcl-2抑制细胞凋亡发生,Bax是Bcl-2家族中促进细胞凋亡的成员之一[9]。氧化应激与凋亡之间存在着密切联系,氧化应激可通过多种途径诱导细胞凋亡的发生,同时氧化应激也可调控其他因素介导的细胞凋亡[10]。本实验中,我们观察到,与对照组相比,DM组心肌组织SOD活性降低,MDA含量增加明显,Bcl-2/Bax比值降低,提示糖尿病可明显加重心肌细胞氧化应激和细胞凋亡。与DM组相比,给予厄贝沙坦治疗后,糖尿病大鼠心肌SOD活性增加明显、MDA含量降低明显,大鼠心肌Bcl-2/Bax比值增加,心脏H/B,LVWI降低明显,提示厄贝沙坦可抑制心肌重构,减轻心肌组织氧化应激和细胞凋亡。
RAS在DCM的发病机制中起着重要作用[11],血管紧张素II(angiopoietin II,AngⅡ)可阻断胰岛素信号、加速氧化应激。厄贝沙坦作为AngⅡ受体抑制剂,可通过抑制血管壁的氧化应激,减少动脉粥样硬化斑块的形成,减轻心肌梗死所致的缺血/再灌注损伤[12,13];Liu[1]等发现厄贝沙坦可能通减弱蛋白激酶D和内质网应激改善糖尿病所致的心室重塑;Jiang[4]等过表达Notch1后发现血管内皮细胞增殖受到抑制,同时AngII的表达也减少;我们前期实验观察到,厄贝沙坦可减轻糖尿病诱导的心肌纤维化[5]。在此基础上,我们进一步观察糖尿病状态下,厄贝沙坦是否通过Notch1信号通路发挥心肌保护作用。
Notch1信号通路属于进化保守的信号转导系统,可通过调节发育过程中细胞增殖、分化和凋亡等的发生[14]。它由受体、配体(Jagged-1)和转录因子三部分组成,当Notch配体和相应的受体结合后,可调节磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K-Akt)、Bcl-2等信号分子的表达。Hes-1基因是调控Notch信号通路主要的靶基因之一,通过检查Hes-1的表达可反映Notch1通路的活化程度。研究发现:Notch1信号可调节心肌细胞损伤,Notch1/Jagged1激活后可显著减少早期心肌细胞凋亡,受抑制时可加速心肌细胞肥大、变性和坏死[15,16];Uros等报道,转基因小鼠过表达Notch1/Jagged-1后,可减轻心脏压力负荷诱导的心肌肥厚[17]。本实验中,DM大鼠氧化应激和细胞凋亡增加的同时,心肌组织Notch1及其配体Jagged-1蛋白表达减少,下游靶基因Hes-1蛋白表达降低,提示Notch1通路的抑制可能参与糖尿病引起的心肌损伤。给予厄贝沙坦治疗后,糖尿病大鼠H/B,LVWI、MDA含量均降低,SOD活性、Bcl-2/Bax比值均增加,同时观察到Notch1、Jagged-1表达增加,Hes-1蛋白表达亦增加明显,提示Notch1通路受到活化,我们推测,厄贝沙坦可能通过激活Notch1信号通路对抗糖尿病心肌损伤。
因此,厄贝沙坦干预后可降低心肌细胞氧化应激,减少细胞凋亡,抑制心肌重构;对抗糖尿病大鼠所致的心肌损伤,这一现象可能与厄贝沙坦激活Notch1通路的表达有关。当然,DCM的发病原因极其复杂,具体机制尚有待进一步明确。
