骨形态发生蛋白复合多孔钛铌合金试件的体外成骨分化研究
2018-02-19彭亮权朱伟民王大平
彭亮权,许 鉴,周 勇,陈 康,李 瑛,陆 伟,朱伟民,王大平
作为最常用的金属材料之一,钛及其合金被广泛应用于骨科领域,机械性能优异,骨接触相容性良好。钛铌合金是一种新型骨科植入物材料,具有无毒性、抗腐蚀性良好等特点[1]。本研究自行设计多孔钛铌合金试件,观察体外兔骨髓间充质干 细 胞(bone marrow mesenchymal stem cells,BMSCs)与复合骨形态发生蛋白(bone morphogenetic protein,BMP)、未复合BMP的金属试件共培养后分化生长的情况,分析多孔钛铌合金试件的细胞相容性,探讨BMP对其成骨活性的影响,从而为钛铌合金植入材料的研究提供实验依据。
1 材料与方法
1.1 实验动物
选取3~4月龄健康新西兰纯种大白兔4只(实验动物使用许可证号:SYXK2015-0106),体重2.5~3.0 kg,雌雄不限,以颗粒干饲料及间断青饲料喂养。
1.2 主要实验材料和仪器
1.2.1主要实验材料 FXNb-1钛铌粉(Ti-25Nb,株州硬质合金厂)、聚乙烯醇(PVA,天津光复精细化工研究所)。
1.2.2主要实验试剂 DMEM/F12培养基、胎牛血清、胰蛋白酶(Gibco公司,美国);透明质酸酶、0.1%胶原酶Ⅱ(Sigma公司,美国);PBS液(北京中杉金桥生物技术有限公司);水溶性rhBMP-2(pH值7.25~7.40,纯度95%,上海环亚生物科技有限公司);骨钙素放免分析试剂盒(中国原子能科学研究院);碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(南京建成生物工程研究所)。
流式细胞检测抗体CD44(赛业生物科技有限公司)、CD29(eBioScience公司,美国)、CD34(北京博奥森生物技术有限公司);荧光标记物选用PE荧光染料,抗体采用羊抗兔单克隆抗体(Abcam公司,英国)。
1.2.3主要实验仪器 倒置相差显微镜(Olympus公司,日本)、JSM-6050型LV扫描电子显微镜(日本电子株式会社)、IB-5离子溅射仪(EiKO公司,日本)、GS-15R超净工作台(Beckmen公司,美国)、流式细胞仪(Becton Dickinson公司,美国)。
1.3 实验分组及方法
1.3.1多孔钛铌合金试件的制备 采用粉末冶金法,将钛铌粉、PVA水溶液制备成浸渍浆料,干燥后烧结,制备加工成直径10 mm、厚1 mm、孔径200~500μm、70%孔隙率的钛铌合金圆盘形样品10枚(图1)。随机分为单纯实验试件组(A组)和复合rhBMP-2实验试件组(B组),每组各5枚。

图1多孔钛铌合金试件 1A实物图片 1B电镜扫描图片(70%孔隙率,材料表面粗糙,孔隙间三维连通,孔径为200~500μm,×50)
1.3.2复合rhBMP-2多孔钛铌合金试件的制备 将5枚B组试件分别称重,每克样品加入20 mL浓度为100 ng/L的rhBMP-2,加入盐酸胍溶液振荡,室温下作用5 h。弃去上清液,以3 500 r/min、30℃离心30 min。半透膜打包样本,4℃条件下柠檬酸透析液透析,持续72 h,每隔4 h更换一次透析液。30℃水浴1 h,17 500 r/min高速离心80 min。取沉淀物置入表面经1∶1氯仿甲醇洗涤的容器,4℃下自然干燥4 d。
1.3.3兔BMSCs混悬液的制备 取实验动物,3%戊巴比妥钠l mL/kg耳缘静脉注射麻醉。以16号骨穿针于股骨髁抽取2 mL骨髓,同法抽取另一侧股骨髁上骨髓,抽吸l mL DMEM/F12培养液,将骨髓与培养液充分混匀,离心取细胞层,制成单细胞悬液,经细胞计数后,以3×105个细胞/cm2接种培养瓶,置于37℃、5%CO2饱和湿度孵箱内孵育,3 d后首次全量换液,弃去大量悬浮细胞,以后隔日换液。待细胞融合成单层后随即传代培养,每天在倒置显微镜下观察培养瓶中细胞的形态变化和生长状况。
取处于对数生长期第3代的兔BMSCs进行流式细胞仪分析。采用流式细胞分析仪对干细胞表面抗原进行分析。收集约 2×106个P3代细胞,1 500 r/min离心4 min后弃去上清液,Buffer液重悬,吸取100μL细胞悬液(约3.0×105个细胞)加入Ep管内,按量加入抗体CD44、CD29和CD34抗体。避光孵育30 min,1 500 r/min离心4 min后弃去上清液。每样品管加入300μL Buffer溶液重悬,上机检测,所对应的激发波长488 nm,发射波长575 nm。
取BMSCs第4、5代,0.25%胰酶消化1 min后,加入10%PBS溶液4~5 mL物理吹打后,收集并进行细胞记数。以1 500 r/min离心5 min,加入DMEM培养液制备成3×107/mL的细胞混悬液。
1.3.4 BMSCs与实验试件复合 分别将A组和B组试件置入细胞混悬液中,37℃、5%CO2条件下静置2 h,倒置相差显微镜下观察,待BMSCs贴附于试件后,将各试件移入6孔培养板中,37℃、5%CO2条件下培养。隔日换液。
1.3.5 BMSCs在实验试件上的成骨活性鉴定
1.3.5.1倒置相差显微镜观察 分析BMSCs与两组实验试件复合后细胞贴附增殖情况、形态变化和分化程度。
1.3.5.2培养上清液ALP测定 收集两组试件BMSCs细胞复合后3、6、9、12、15 d各孔培养液,冷冻干燥,取100μL PBS复溶,离心取上清液,按试剂盒说明进行ALP活性检测(标准管中加入50μL酚标准应用液,空白管加入双蒸水50μL,各管加入缓冲液0.5 mL和基质液0.5 mL,充分混匀,37℃水浴15 min,加入显色剂1.5 mL,立即混匀,选择520 nm波长、0.5 cm光径,空白管调零,以分光光度计比色,测各管吸光度),根据下列公式计算ALP活性:ALP(金氏单位/100 mL)=(测定管吸光度/标准管吸光度)×10。
1.3.5.3培养上清液骨钙素检测 两组试件复合于细胞培养液中培养2、4、6、8、10、12、14 d,收集各孔培养液,冷冻干燥,取100μL PBS复溶,离心取上清液,进行骨钙素检测。取125I标记的骨钙素及骨钙素抗体100 pL混匀,4℃放置24 h,每管加入20%PEG 500μL分离剂,充分混匀,室温放置 20 min,4℃、3 500 r离心20 min,弃去上清液,测沉淀cpm数,由自动γ计数仪预先编制程序,直接给出相关参数、标准曲线及样品浓度,结果以ng/mL/孔表示。
1.3.5.4电镜扫描观察 兔BMSCs与试件复合培养24 h、2周、4周,用PBS漂洗细胞表面,4℃预冷的3%浓度戊二醛固定24 h,吸出固定液,PBS浸洗2次,每次10 min。用4℃预冷的锇酸固定1 h。PBS浸洗2次,每次10 min。乙醇系列梯度(30%、50%、70%、80%、90%、95%、100%)脱水,每种浓度酒精通过2次,每次15 min。CO2临界点干燥,离子溅射仪真空喷金,扫描电镜观察试件表面结构及孔洞内细胞生长情况。
1.4 统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 倒置相差显微镜观察结果
兔BMSCs原代接种于培养瓶后,可见细胞呈类圆形悬浮。A组试件置于细胞混悬液24 h后,可见试件下方盖玻片上有BMSCs贴附,细胞形态呈长梭形,胞体多有突起;2周后细胞数量增多,但仍呈单层生长。B组复合培养2周后大部分细胞表现出成骨细胞形态,多数呈三角形、多角形或不规则性,多有伪足,胞核偏于一侧,呈复层生长,镜下视野可见细胞结节。4周后两组弃去培养液,行盖玻片茜红染色,B组可见钙结节生成,A组则无。见图2。
经抗CD29、CD34、CD44兔抗人单克隆抗体流式细胞鉴定,第三代BMSCs中96%表达CD44,95%表达CD29,仅有5%表达CD34(图3)。
2.2 培养上清液ALP活性测定结果


图2兔骨髓间充质干细胞(BMSCs)复合培养显微镜图片(A组:单纯实验试件组;B组:复合rhBMP-2实验试件组)2A BMSCs原代接种传代到第4~5代,细胞呈小圆形悬浮状态(×100)2B BMSCs与A组试件复合培养24 h,细胞已贴壁(×100)2C BMSCs与A组试件复合培养2周,细胞增多,但仍呈单层生长(×100)2D BMSCs与B组试件共同培养2周,大部分细胞已向成骨细胞分化,表现出成骨细胞形态(×200)2E B组试件与BMSCs共同培养4周,可见钙结节生成(茜红染色,×200)
如图4所示,随培养时间延长,两组ALP值逐渐升高,B组第6天表现出明显的陡升趋势,与A组比较差异有统计学意义(P=0.000),培养9、12、15 d时B组ALP均明显高于A组(均P=0.000)。
2.3 培养上清液骨钙素检测结果
随着培养时间的延长,两组培养上清液骨钙素逐渐升高,至12 d时达到高峰;比较2、4、6、8、10、12和14 d两组骨钙素浓度,B组均显著高于A组(均P=0.000),见图5。
2.4 电镜扫描观察结果
共培养2周后电镜扫描观察,A组可见大量细胞附着在材料外表面和孔洞内,细胞形态呈梭形,表现为单层生长,B组则呈复层生长。4周后B组材料孔洞内可见钙沉积,而A组材料孔洞内未有钙沉积(图6)。
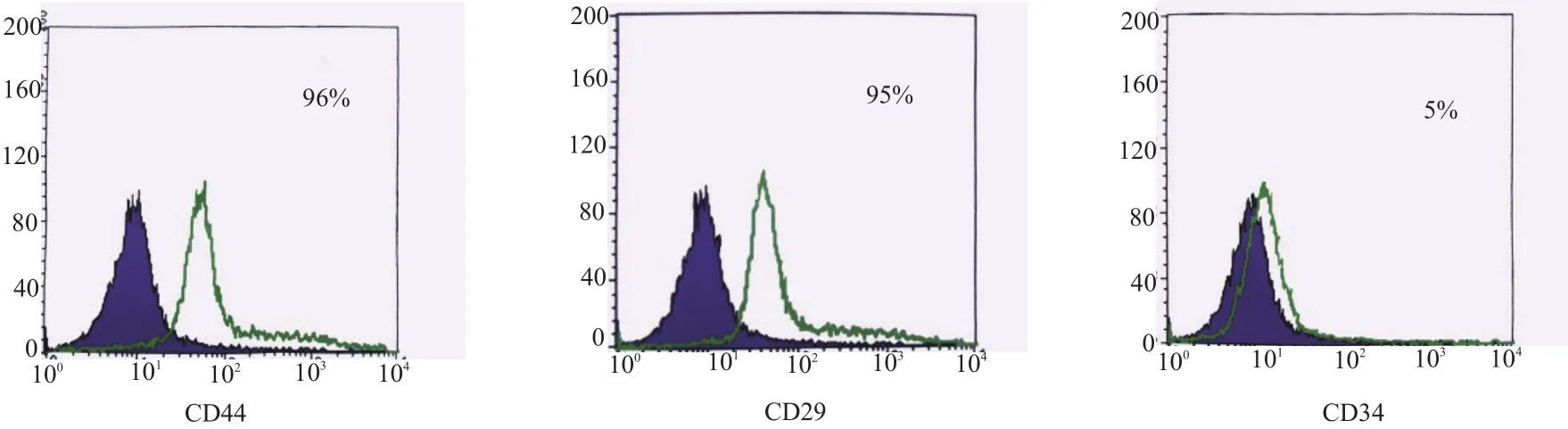
图3第三代骨髓间充质干细胞中96%表达CD44,95%表达CD29,仅有5%表达CD34

图4两组多孔钛铌合金试件与兔骨髓间充质干细胞共培养不同时间点上清液碱性磷酸酶(ALP)活性测定(A组:单纯实验试件组;B组:复合rhBMP-2实验试件组;*与A组比较,P<0.05)

图5两组多孔钛铌合金试件与兔骨髓间充质干细胞共培养不同时间点上清液骨钙素浓度检测(A组:单纯实验试件组;B组:复合rhBMP-2实验试件组;*与A组比较,P<0.05)

图6兔骨髓间充质干细胞(BMSCs)复合培养电镜扫描图片(A组:单纯实验试件组;B组:复合rhBMP-2实验试件组)6A A组试件与BMSCs复合培养后2周,可见孔洞内细胞呈梭形、表现为单层生长(×100)6B,6C A组试件与BMSCs复合培养后4周,材料表面和孔洞内均未见钙沉积(E×50,F×100)6D B组试件与BMSCs复合培养后2周,可见孔洞内细胞呈梭形,表现为复层生长(×100)6E,6F B组试件与BMSCs复合培养后4周,材料表面和孔洞内均可见钙沉积(白色箭头所指为钙沉积部位,×100)
3 讨论
钛合金包括α合金、α+β合金和β合金3种类型,其中α+β合金可作为纯钛的替代品,像钛铝钒合金,是目前骨科植入物最常使用的材料[2-3]。但其含有铝、钒等毒性元素,可能对人体造成潜在的危害。为较好地解决这一问题,人们用金属铌元素、铁元素来替代钒元素,既无毒性,同时又具有良好的抗腐蚀性[4]。
3.1 多孔钛铌合金的生物学性能
骨科内植物尤其是人工关节的力学性能,对于生物材料-骨结合界面及其在体内的稳定性有着至关重要的影响。在满足机体负重所需的力学强度的同时,其弹性模量必须与骨的弹性模量相近,而单纯钛合金的弹性模量均明显高于骨本身,植入后易导致应力遮挡效应,引发骨重塑,改变骨形态,最终导致骨吸收[5-6],进而影响假体的远期效果,引起骨质疏松、植入物松动移位甚至术后再骨折,翻修手术的难度也相应增加。
为降低钛合金材料的弹性模量,多孔设计得到广泛应用。多孔金属材料可使单位截面积下材料本身所承载的应力下降;同时提供良好的生物学固定,促进骨组织长入植入物孔隙,利于骨与植入物之间的应力分布平衡[7-8]。
Xu等[9]利用粉末冶金方法制备的具有不同孔隙度的多孔钛铌合金试件,能够很好地促进BMSCs长入合金试件内部,生物相容性良好;Weng等[10]的动物实验结果亦证实,多孔钛铌合金试件在兔模型体内相容性良好,具有与骨相当的弹性模量;亦有学者对多孔钛铌合金的机械性能和弹性模量进行研究,结果提示,该试件机械性能较好,抗腐蚀性强,具有良好的应用价值[11-12]。本研究所采用的多孔钛铌合金试件同样使用粉末冶金法制备,其在生物学性能方面的表现与上述研究一致。
3.2 BMP-2与钛铌合金试件的复合及其体外成骨分化能力
为了保证生物型人工关节植入后获得长期稳定,通常需要假体与骨之间的牢固结合。既往研究主要集中于对材料表面进行改进或涂层等,如珍珠面、钛丝面、喷砂面、羟基磷灰石面等,能够起到促进骨质长入及整合、利于骨质再生的作用[13-14]。但假体-骨界面接触总面积有限,因此上述改良处理方法对于骨与假体结合范围、深度和强度的影响也较为局限[15-16]。为进一步提高骨长入的速度及骨长入量,目前常用的是将生物活性因子与材料相结合,其中包括BMP-2与多孔材料复合的方法[17-18]。
BMP-2是一种低分子量酸性多肽,存在于骨基质中,可诱导血管周围BMSCs和未分化间充质细胞向软骨和成骨细胞分化,同时具有高效的骨传导作用[19-21]。为了明确多孔钛铌合金支架复合BMP后是否具备体外成骨诱导作用,我们观察BMSCs在具备不同微环境材料上的贴附、分化、增殖情况。
显微镜及电镜结果提示,与A、B两组试件复合24 h、2周、4周后,BMSCs贴附增殖情况良好,说明多孔钛铌合金材料具有良好的细胞相容性。B组BMSCs因富含BMP,2周时即表现出向成骨细胞分化的趋势,细胞形态向成骨细胞改变且数目明显增多;4周时B组材料上有钙结节生成。而A组2周时细胞仅表现为单层生长,4周时玻片染色亦未发现有钙结节生成。这些结果提示BMP复合多孔钛铌金属试件具有诱导BMSCs成骨活性的作用。
ALP是成骨细胞的生化和组织学标志,其表达水平可反映BMSCs向成骨细胞的分化特性。骨特异性ALP定位于骨源性细胞的表面,是评价机体组织分化能力和成骨活性的特异性标志酶[22]。本实验中骨特异性ALP值随培养时间延长而逐渐升高,B组6 d时ALP表现出明显的陡升趋势,且在6、9、12、15 d时ALP测得值均明显高于A组,进一步证实了BMP的成骨诱导作用。
骨钙素是一种小分子蛋白质,主要沉积在骨组织的细胞外间质,可调节骨的矿化及转化过程,被认为是成骨细胞另一特征性的表型标志,可由成骨细胞产生[23]。本实验B组上清液中骨钙素在2、4、6、8、10、12、14 d测得值均高于A组,推测与BMP诱导成骨作用导致的钙成分增加有关。
综上,兔BMSCs在多孔钛铌合金试件中表现出正常的形态及良好的增殖分化能力,提示该金属试件具有良好的细胞相容性;BMSCs在多孔钛铌合金中经rhBMP-2诱导,可向成骨细胞分化,证实BMP对复合试件的成骨活性有重要影响。本实验存在一些不足,实验仅分两组,未充分考虑到实验试件本身对细胞增殖的影响,且BMP为单一浓度,在后续实验中将进一步加以完善。
