敖汉细毛羊Hoxa5基因质粒的构建及在成纤维细胞中表达量的研究
2018-02-18张梦瑶刘开东刘积凤贺建宁
张梦瑶,杨 峰,刘开东,刘积凤,柳 楠,贺建宁
(1.青岛农业大学动物科技学院,山东 青岛 266109;2.青岛畜牧兽医研究所,山东 青岛 266121;3.内蒙古农业大学动物科技学院,内蒙古 呼和浩特 010018)
在早些年我国就培育出细毛羊品种敖汉细毛羊,主要分布在东北地区、内蒙古地区。其羊毛的品质相比于其他羊的毛品质要高,是我国最具有代表性的细毛羊之一[1]。细毛羊毛囊是皮肤的重要附属结构,是产生被毛的组织,它的性状和组织结构决定着被毛品质和羊毛产量。毛囊发育形态结构特征及发育规律,对羊毛性状有重要影响,是探究毛囊生长发育调控机制的基础。毛囊具有自我更新和周期性生长的特点,其周期性变化决定被毛的生长与脱落,并受多种因子调控[2]。因此探究毛囊的生长发育调控的基因已显得非常重要。
Hox家族是重要的转录调节因子,目前共有39个[3],其对毛囊细胞增殖与分化有重要作用[4-5]。对人和小鼠的研究发现,几乎所有的Hox家族基因均在皮肤和毛囊中表达[6]。Hoxa5参与皮肤细胞增殖、分化与凋亡的调控[7],是毛囊退行期调控的关键因子,在诱导细胞周期阻滞和终端分化中发挥作用[8]。张燕军等[9]研究发现,在绒山羊胚胎115 d和成年羊10月时,于初级毛囊内根鞘和毛干皮质层中检测到Hoxa4和Hoxa5基因。Hoxa7在人和鼠的毛囊内、外根鞘中表达[10]。张燕军等[11]研究表明,Hoxa5基因在胚胎不同时期及成年羊皮肤毛囊中均有表达,推断该基因对毛囊细胞增殖起作用。Hoxa5在控制毛生长发育中有重要作用,当过表达时,小鼠会表现出毛生长的缺陷[12]。吴江鸿[13]发现,Hoxa5基因的表达量与绒山羊胎儿皮肤厚度变化趋势一致,成年后则与次级毛囊周期呈显著相关,且在体外培养的毛囊中Hoxa5基因表达导致角质化细胞死亡。
目前,对Hoxa5基因与家畜皮肤毛囊关系的研究主要集中在绒山羊和小鼠身上,主要通过荧光定量PCR在分子水平上有过相应的研究,还有一些是与骨的调节,繁殖等与皮肤毛囊无关的研究,尚未发现Hoxa5基因通过在细胞水平上来研究细毛羊毛囊发育方面的相关报道。因而本研究通过对其质粒的构建及转染成纤维细胞来进行Hoxa5基因表达的分析。结果表明,质粒构建成功且Hoxa5基因转染细胞后过表达。可为此基因在个体层次上的研究提供了坚实的基础。
1 材料与方法
1.1 试验材料 选取健康40日龄的胎羊(由青岛畜牧兽医研究所奥特种羊场提供)。
1.2 主要试验试剂及仪器 pGM-T载体、pcDNA3.1质粒、EcoR1、Nde1限制性内切酶、DH5ɑ感受态细胞、DMEM、标准胎牛血清等,均购自青岛赛尚科贸有限公司。BB5060UV型贺氏二氧化碳培养箱,购自德国Eppendorf公司;Leica DMIRB型倒置显微镜、Redbio CFX ConnectTM荧光定量PCR系统,均购自Bio-Rad公司。
1.3 质粒构建
(1)引物设计:利用RNA提取试剂盒对组织进行RNA的提取及反转录。选取绵羊Hoxa5基因组(GenBank登录号为NM-001009431.1)CDS区 ,在CDS区外侧通过Primer5.0软件设计引物并在上下游引物 5′端加入保护碱基和 EcoR1、Nde1酶切位点。
上 游 引 物:5′-CCGGAATTCATGAGCTCTTATTTTGTAAAC-3′;
下游引物:5′-GGAATTCCATATGTAAACGCTCAAATACTCAGG-3′;并进行PCR扩增及琼脂糖凝胶电泳检测,扩增体系为:DNA模板1 μL,上下游引物各 1 μL,Green Mix 17 μL。
(2)TA克隆:对PCR产物进行琼脂糖凝胶电泳回收连接。pGM-T载体连接体系:T4 DNA连接酶2 μL;T4 DNA 连接酶 Buffer 1 μL;pGM-T 载体2 μL;DNA 片段5 μL;置于16 ℃金属浴中3 h,然后4℃过夜。转化DH5ɑ感受态细胞、涂布在AMP抗生素的平板上,37℃、培养12 h,挑单菌摇菌并送上海生工生物工程技术服务有限公司测序[14]。
(3)Hoxa5基因与pcDNA3.1质粒重组:对TA克隆载体及pcDNA3.1质粒同时进行EcoR1、Nde1双酶切,酶切体系为:EcoR1 1 μL;Nde1 1 μL;pGM-THoxa5 和 pcDNA3.1 5 μL;Buffer 1 μL;ddH2O 42 μL;37℃ 2 h,对 Hoxa5基因和 pcDNA3.1进行胶回收。连接体系:Hoxa5片段5 μL;pcDNA3.1 3 μL;T4 DNA 连接酶 1 μL;T4 DNA 连接酶 Buffer 1 μL;22℃金属浴中反应2 h,16℃ 3 h后转化DH5ɑ感受态细胞,挑单菌摇菌,进行菌液PCR鉴定阳性率,将阳性组送往公司测序,并通过质粒提取试剂盒获得阳性质粒[14]。
1.4 敖汉细毛羊成纤维细胞培养 取40日龄胎羊用75%酒精和PBS清洗。去除头部和四肢剩余躯干用眼科剪将其剪成1.0~2.0 mm3大小的组织块,滴加37.0℃预热的胎牛血清,加入培养液置于CO2培养箱(37℃,5.0%CO2)。24 h进行换液,每日在倒置显微镜下观察细胞形态和生长情况,待细胞密度达到90%左右进行传代。传代时加入0.25%胰蛋白酶1.0 mL,37.0℃消化5 min,当细胞变圆,加入3倍体积的DMEM终止消化,按相应比例进行传代[14]。
1.5 细胞转染 待细胞传代后2~3天用Lipofectamine2000进行瞬时转染。孵育体系:试验组:脂质体 20 μL,DMEM(不含双抗)480 μL;对照组:脂质体 20 μL,DMEM(不含双抗)480 μL;混匀,静置5 min。 转染体系:试验组:质粒 40 μL,DMEM 460 μL;对照组:DMEM 500 μL;静置 20 min,各加入4 mL DMEM,37℃培养6 h后换液,培养36 h。
1.6 转染细胞的定量检测 对转染成功的细胞进行培养,待细胞密度达到90%时加入3 mL的TR-IZol(Roche)裂解细胞并提取RNA。完成后利用核酸蛋白测定仪测定其浓度和纯度,并用反转录试剂盒(Roche)将RNA逆转录成cDNA。根据敖汉细毛羊Hoxa5基因的CDS区和绵羊GAPDH的CDS区,使用PrimerPremier5.0软件设计Hoxa5和GAPDH基因的引物序列,见表1。
实时荧光定量PCR反应程序:94℃预变性10 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,共40个循环。每个样品设置3次重复,采用Ct(2-ΔΔCt)值法计算各样本中Hoxa5相对于内参基因GAPDH的表达量。利用SPSS 17.0软件中t检验对数据进行差异显著性分析,结果以平均值±标准差表示,以 P<0.01作为差异极显著性判断标准[14]。
1.7 质粒转染后Western Blotting检测Hoxa5基因蛋白表达 样品分为对照组和试验组。每个样品3个平行。用细胞裂解液提取细胞总蛋白,收集置于-20℃冻存备用,β-actin作为内参。蛋白样品回收后转印,5%BSA封闭2 h;TBST洗膜3次,每次5 min;将一抗用1∶2 000比例稀释,孵育膜4℃过夜;用TBST洗膜3次,每次5 min。山羊抗兔的二抗用以1∶2 000的比例稀释,孵育膜1 h;用TBST洗膜3次,每次5 min,在暗室中曝光。条带用ImageJ软件分析,同一样本不同处理的结果用SPSS统计分析软件进行t检验,多组数据之间应用SPSS统计分析软件进行方差分析。
2 结果
2.1 Hoxa5基因PCR扩增 以敖汉细毛羊的肌肉组织提取的RNA反转录的cDNA为模板,应用设计的上下游引物进行PCR扩增目的基因片段。1%琼脂糖凝胶电泳分析结果如图1所示,电泳结果表明,引物扩增的条带单一,产物大小为804 bp,与已知的目的基因大小一致,可用于后续的试验。
2.2 TA克隆测序比对 将扩增的目的基因片段与pGM-T载体连接,并转化大肠杆菌DH5ɑ,37℃过夜振荡培养。将菌液送至擎科公司进行测序,测序后的序列用BLAST与已知目的基因的序列进行比对,比对结果显示碱基没有发生突变,与已知目的基因完全一致。

图1 Hoxa5基因PCR扩增
2.3 克隆载体的鉴定 将扩增的目的基因连接到pGM-T载体中,经转化大肠杆菌DH5ɑ,过夜振荡培养后对克隆载体利用试剂盒进行提取,通过1%琼脂糖凝胶电泳检测,结果如图2所示,目的基因大小为804 bp,T载体大小为3 489 bp,连接上目的基因后应在4 293 bp处,条带清晰单一,结果显示克隆载体构建提取成功,可用于后续的酶切试验。

图2 克隆载体的鉴定
2.4 克隆载体及pcDNA3.1载体双酶切 对克隆载体和pcDNA3.1载体分别进行双酶切,克隆载体的双酶切将目的基因片段切下,pcDNA3.1的双酶切把载体切开,对两者双酶切之后的片段进行切胶回收用于后续的连接。结果如图3所示,1~2酶切效果良好1、2是对克隆载体的EcoR1、Nde1双酶切,目的基因为804 bp,T载体为3 489 bp,与图中条带所吻合。3~4是对pcDNA3.1的双酶切,大小为5 428 bp,与图中条带所吻合。因此1~4可进行目的基因与表达载体pcDNA3.1的连接。
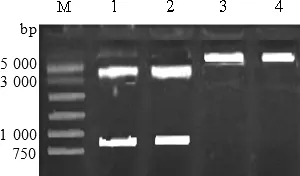
图3 克隆载体及pcDNA3.1载体双酶切
2.5 表达载体pcDNA3.1构建及鉴定 对克隆载体和pcDNA3.1载体EcoR1、Nde1双酶切产物进行切胶回收后用T4 DNA连接酶将目的片段和pcDNA3.1载体进行连接,转化大肠杆菌DH5α,37℃过夜振荡培养,对菌液进行PCR电泳鉴定,如图4所示,在804 bp处有单一明亮的条带,说明目的基因与pcDNA3.1载体连接成功。

图4 表达载体pcDNA3.1的鉴定-PCR扩增
2.6 表达载体菌液测序鉴定 对目的基因Hoxa5连接到pcDNA3.1载体的菌液送至公司进行测序,测序结果与已知目的基因的序列用BLAST进行比对,结果显示碱基完全一致,没有碱基发生突变。说明目的基因成功的连接到了pcDNA3.1载体中去,并能够稳定的存在。
2.7 细胞形态观察 每天定时用电子倒置显微镜观察成纤维细胞的生长情况。细胞生长24 h可观察到组织块附近有梭形、不规则三棱形的成纤维细胞游离生长,除此细胞外还有椭圆形或圆形的上皮样细胞生长。当细胞密度达到90%左右时进行传代,采用胰酶消化法和差速离心法可将成纤维细胞和上皮样细胞及其他细胞分离开,经3~4代培养的细胞仅剩成纤维细胞,经传代后细胞增殖加快,细胞形态上不发生明显的变化。
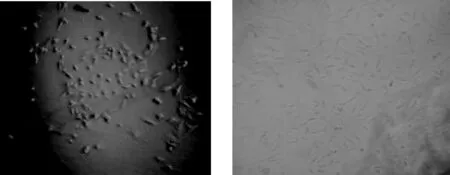
图5 成纤维细胞原代培养 (×100)与成纤维细胞传代培养 (×100)
2.8 实时荧光定量PCR检测Hoxa5基因表达 以cDNA为模板,应用设计的上下游引物进行PCR扩增目的基因Hoxa5和内参基因GAPDH片段。1%琼脂糖凝胶电泳分析结果如图6所示,电泳结果表明,引物扩增的条带单一,GAPDH产物大小为125 bp,Hoxa5产物大小为186 bp与已知的内参基因、目的基因大小一致,可用于荧光定量PCR试验。

图6 内参基因GAPDH(A)目的基因Hoxa 5扩增产物(B)
由图7可见,Hoxa5和内参基因GAPDH的熔解曲线峰值图只有1个明显的峰,表明在实时荧光定量PCR过程中荧光信号均来自特异性扩增产物,Hoxa5和GAPDH均没有产生非特异性扩增及引物二聚体,引物可以用来进行下一步试验。采用SPSS软件对转染的细胞和没有进行转染的细胞mRNA表达量进行分析,Hoxa5基因经过质粒构建转染成纤维细胞后与未进行转染的细胞之间差异显著(P<0.05)见图8。

图7 Hoxa 5和GAPDH熔解曲线峰值图(A)和扩增曲线图(B)
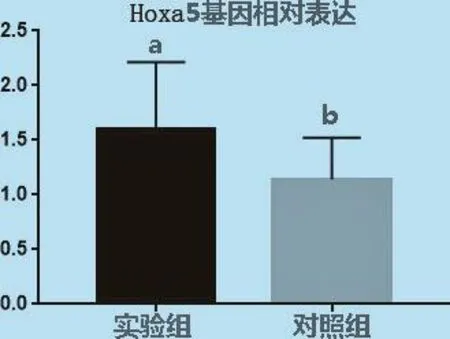
图8 Hoxa 5基因mRNA相对表达量
2.9 Hoxa5基因蛋白表达的检测 以成纤维细胞提取的蛋白为模板进行Western Blot。试验结果显示,试验组细胞瞬时转染Hoxa5基因的条带明显亮、粗与未转染的对照组,经ImageJ和SPSS分析得试验组细胞瞬时转染Hoxa5基因蛋白的表达显著高于对照组(P<0.05),说明质粒pcDNA3.1-Hoxa5能高效表达Hoxa5基因。

图9 Hoxa 5基因表达蛋白条带
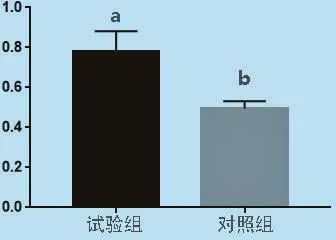
图10 Hoxa 5基因蛋白相对表达量
3 讨论
毛囊发育和周期性生长过程中受多种信号通路调控。这些信号分子73.2%属于Wnt转化生长因子家族、丝裂原活化蛋白激酶家族、NOTCH、JAK-STAT和SHH 6个传导通路[15]。还有一部分属于肿瘤坏死因子(TNF)家族、成纤维细胞生长因子家族、BMP家族等。在毛囊发育过程中,虽然有一些其他分子的参与,但是这些分子大部分是通过上述的6个信号通路参与毛囊的发育过程。Hoxa5作为Hox家族重要成员之一,其编码蛋白是与发育相关的重要转录因子。研究发现[16],Hox家族成员调节人体白色与棕色脂肪发育,并且在身体不同部位脂肪组织中的表达有很大差异,Hoxa5的甲基化水平调节着小鼠不同部位脂肪细胞的分化[17]。柳楠等[18]研究发现,通过基因芯片技术,筛选出在羊皮肤毛囊中表达的Hox基因家族中的基因,在羊的肩部(多毛区)和腹部有显著的表达,在此过程中主要调控毛干的分化。
本研究选择易培养活力高的成纤维细胞作为研究工具。选取子三代进行转染,避免了转染过程中掺杂了其他的细胞,减少了试验的误差。Hoxa5基因在成纤维细胞中能够稳定的存在并表达。首先,在mRNA的水平通过实时荧光定量PCR来检测Hoxa5基因的表达。结果显示,转染组的mRNA量显著高于空白对照组的量。其次,已知Hoxa5蛋白分子量约为30 kD,经过转染的细胞Hoxa5基因蛋白表达量明显高于空白对照。经过显色曝光后条带明显比对照组的条带黑、宽。经Image J分析,相对表达的灰度值也明显高于对照组。将目的基因Hoxa5与内参基因β-actin的灰度值的比值进行SPSS分析,结果显示差异极显著。进一步说明了转染后Hoxa5基因的过表达。
目前尚未发现,Hoxa5基因在细胞水平上的表达量与羊毛性状和毛囊密度之间关系的研究报道,本试验可对此起到补充作用。本研究通过基因的克隆,成功的构建了Hoxa5基因表达载体,将载体转染到成纤维细胞中,采用实时荧光定量PCR、Western Blot来检测基因的表达,从而来进一步的研究基因的作用。经过转染的细胞,Hoxa5基因的mRNA和蛋白表达量明显的升高,这从细胞层次上研究了与羊毛有关的基因。Hoxa5基因本身具有抑制毛囊发育的作用,通过在细胞层次上的研究Hoxa5基因过表达,Hoxa5基因过表达的同时也将影响相关信号通路中基因的表达。Hoxa5基因的过表达,会影响与它相关的基因表达增强与减弱。这为以后的个体水平上的研究提供了坚实的基础,极大可能的解决绵羊羊毛生长的问题。
4 结论
本研究通过对Hoxa5基因质粒的构建、质粒转染成纤维细胞后进行实时荧光定量PCR、Western Blot等,结果成功地构建了质粒并转染成纤维细胞,转染后细胞生长良好,Hoxa5基因过表达,mRNA表达量和蛋白的表达量极显著高于对照组,为进一步在个体水平上研究其功能奠定基础。
