神经胶质细胞生长因子-1β对慢性心衰大鼠心功能及促血管生成素、大麻素受体、蛋白激酶C表达的影响
2018-02-14余振伟王学慧
余振伟,王学慧
近年来,以生长因子和细胞疗法为治疗手段的生物疗法在心力衰竭(心衰)的动物模型中得以广泛研究,旨在促进自身心肌细胞的修复来有效改善慢性心衰(CHF)[1]。神经胶质细胞生长因子(neuregulin-1β)为一类心肌表皮生长因子(EGF),可激动上皮生长因子酪氨酸酶受体[2],研究表明,neuregulin-1β具有抑制大鼠心肌细胞凋亡、促进大鼠心肌细胞增殖和DNA合成的作用,同时neuregulin-1β可使离体的大鼠心肌细胞免受阿霉素诱导的凋亡影响[2],但neuregulin-1β对阿霉素诱导的慢性心衰的大鼠体内心功能的影响尚未可知。相关研究表明促血管生成素(Ang2)、大麻素受体(CB1)、蛋白激酶C(PKC)均参与慢性心衰的调节[3-5],但neuregulin-1β在促进心肌细胞生长和保护心肌细胞同时对Ang2、CB1、PKC表达的影响尚未有相关性研究。因此,本研究拟建立阿霉素诱导的心衰大鼠模型,探讨neuregulin-1β对慢性心衰大鼠心功能的影响,并进一步研究neuregulin-1β对大鼠Ang2、CB1、PKC表达的影响,以期深入阐释neuregulin-1β抗心衰的作用及其相关机制,为临床慢性心衰的治疗提供新的治疗途径。
1 资料和方法
1.1 实验动物健康雄性SD大鼠(体质量150~200 g)购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-2-006,动物批次号:201607012。
1.2 药品与试剂注射用盐酸阿霉素(深圳万乐药业有限公司,批号:1606E1),neuregulin-1β(上海泽生科技开发有限公司,批号:201608016)。CB1(美国Cayman Chemical公司),Ang2单克隆抗体(美国Cayman Chemical公司),PV-6000免疫组化试剂盒(北京中杉生物技术有限公司),DAB显色液(北京中杉生物技术有限公司)。PKC一抗(美国Santacruz公司,批号:sc-10802),二抗辣根酶标记山羊抗兔IgG(北京中杉金桥公司,批号:ZB- 2303)。
1.3 实验仪器彩色多普勒超声心动图仪(GE Vivid 7,USA),生理记录仪及RM6280多导生物信号处理系统(浙江医科大学医疗仪器实验厂),光学显微镜及其成像系统(LEICA DMIRB,Germany),漩涡混匀器(德国LEICA公司),Shan-don325型石蜡切片机(英国Shandon 公司)。
1.4 方法
1.4.1 动物分组将30只SD大鼠随机分为模型组、neuregulin-1β干预组、正常组,每组10只。模型组:尾静脉注射阿霉素(20 mg/kg),1/周,连续8周,完成CHF造模;neuregulin-1β干预组:完成与模型组相同的造模后,尾静脉每天给予neuregulin-1β(10 μg/kg·d),连续1周;正常组:尾静脉注射与模型组等体积的生理盐水,1/周,连续8周。
1.4.2 大鼠心脏超声及血流动力学检测模型组与neuregulin-1β干预组分别在用药8周后及neuregulin-1β连续干预1周后腹腔注射2%的戊巴比妥麻醉大鼠,以HP啮齿动物超声探头(15 MHz)在大鼠胸骨旁以二维超声和M型超声进行心脏形态和功能检测。测量指标包括左心室舒张末期内径(LVEDd),左心室收缩末期内径(LVESd),左室缩短率(LVFS),左室射血分数(LVEF)。三组大鼠均在实验开始第9周末于麻醉后剪开颈部皮肤,暴露右侧颈总动脉后插入聚苯乙烯左心导管(外径1.0 mm,内径0.8 mm)至左心室,左心导管另一端连接八导电生理记录仪观察,记录各血流动力学指标:左心室收缩压(LVSP),左心室舒张末期压(LVEDP),左心室内压最大上升速率(+dp/dtmax),左心室内压最大下降速率(-dp/dtmax)。随后取出心脏标本并投放液氮罐中保存备用。
1.4.3 大鼠心肌组织病理学检测各组大鼠被处死时,取左心室部分心肌,用10%的福尔马林固定后蜡块包埋并切片,行HE染色,每组3张,进行病理学观察。
1.4.4 Western blot法检测大鼠心肌组织中PKC蛋白的表达[6]将大鼠心肌组织低温研磨后裂解,提取总蛋白,BCA蛋白定量,聚丙烯酰胺凝胶电泳、转膜、封闭,后与一抗、二抗孵育,通过化学发光法获取条带,使用IPP 6.0软件分析目的条带灰度,计算PKC 蛋白的相对表达量。
1.4.5 免疫组织化学法检测大鼠心肌组织中Ang2蛋白、CB1蛋白的表达[7,8]SP法检测心肌组织中CB1和Ang2的表达,已知阳性片为阳性对照,PBS缓冲液代替一抗为阴性对照,进行半定量评分:①光镜下按细胞显色有无及深浅记分:无色为0分;浅色为1分;深色为2分。②按显色细胞所占比例评分:占1/2以下为1分;占1/2以上为2分。上述两分值之乘积为最终评分:阴性为0分(-);弱阳性为1~2分(+);强阳性为3~4分(+ +)。
1.5 统计学处理采用SPSS 21.0进行统计分析,计量资料采用均数±标准差(±s)表示,多组间差异采用one-way ANOVA检验,统计前首先对各个检测指标数据进行正态性检验和方差齐性检验;方差分析有差异时,则进一步采用LSD-t法进行两两比较,P<0.05为有统计学差异。
2 结果
2.1 三组大鼠心脏超声及血流动力学指标检测结果模型组和干预组在第8周neuregulin-1β用药前LVEDd、LVESd均高于正常组(P<0.05),LVFS与LVEF均低于正常组(P<0.01);但干预组心脏超声各指标与模型组相比均无统计学差异(P>0.05),表明连续8周的阿霉素用药成功建立慢性心衰大鼠模型(表1)。
表1 三组大鼠第8周及第9周时超声心电图心功能指标(±s,n=10)

表1 三组大鼠第8周及第9周时超声心电图心功能指标(±s,n=10)
注:LVEDd:左心室舒张末期内径;LVESd:左心室收缩末期内径;LVFS: 左室缩短率;LVEF:左室射血分数;与正常组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05;与第8周干预组比较,dP<0.05
第9周指标/组别 正常组 模型组 干预组 正常组 模型组 干预组LVEDd(mm) 5.4±0.2 7.1±0.1a 6.9±0.2a 5.5±0.1 7.5±0.2a 6.0±0.5acd LVESd(mm) 2.7±0.2 4.3±0.2a 4.4±0.3a 2.8±0.4 4.5±0.4a 3.4±0.3acd LVFS(%) 51.6±1.3 38.7±0.8b 40.2±1.6b 53.2±2.1 35.6±1.3b 46.7±1.8ac LVEF(%) 83.6±2.1 67.8±3.2b 64.5±1.6b 85.7±1.8 63.4±2.7b 78.6±2.3ac时间 第8周
neuregulin-1β干预1周后,干预组LVEDd、LVESd均高于正常组(P<0.01),但均低于模型组(P<0.05);干预组LVFS与LVEF均低于正常组(P<0.05),但均高于模型组(P<0.05);且干预组neuregulin-1β连续干预1周后LVEDd、LVESd均较干预前显著降低(P<0.05)(表1)。
neuregulin-1β干预1周后,干预组LVSP、+dp/dtmax、-dp/dtmax均低于正常组(P<0.05),但均高于模型组(P<0.05);干预组LVEDP高于正常组(P<0.01),但低于模型组(P<0.05)(表2)。
表2 三组大鼠血流动力学指标检测结果(±s,n=10)

表2 三组大鼠血流动力学指标检测结果(±s,n=10)
注:LVSP:左心室收缩压;LVEDP:左心室舒张末期压;-dp/dtmax:左心室内压最大下降速率;+dp/dtmax:左心室内压最大上升速率;与正常组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01
指标/组别 正常组 模型组 干预组LVSP(mmHg) 130.4±2.6 98.3±1.8b 117.8±3.2ac LVEDP(mmHg) 4.2±1.6 25.6±2.1b 14.6±2.6bc-dp/dtmax(mmHg/s) -5530.2±206.5 -2365.3±167.5b -3906.7±187.6ad+dp/dtmax(mmHg/s) 6400.7±344.2 3600.6±267.4b 4721.6±242.3bd
2.2 三组大鼠心肌组织病理学检测结果正常组大鼠心肌组织形态结构正常,心肌纤维排列有序,横纹清晰,未见心肌断裂、出血及心肌细胞水肿变性,无显著血管扩张、充血,未见心肌坏死及炎性细胞浸润(图1A)。模型组大鼠心肌间质充血、出血明显,血管明显扩张,局灶性心肌出血,片状心肌肌纤维断裂,广泛的心肌细胞水肿、变性,心肌断裂坏死较为严重(图1B)。干预组心肌病变轻于模型组,除部分心肌水肿外,未见明显的心肌细胞坏死及炎症浸润,也未见明显的血管充血扩张,且心肌细胞排列基本正常(图1C)。

图1 三组大鼠心肌组织HE染色病理结果图示(×400)
2.3 三组大鼠PKC蛋白检测结果模型组和干预组PKC相对蛋白量均高于正常组,但干预组PKC相对蛋白量低于模型组,差异均具有统计学意义(P均<0.05)(图2)。
2.4 三组大鼠心肌组织中Ang2和CB1免疫组化检测结果模型组和干预组Ang2和CB1阳性区域评分均高于正常组,但干预组Ang2和CB1阳性区域评分低于模型组,差异均具有统计学意义(P均<0.05)(图3~4)。

图2 三组大鼠PKC蛋白Western blot检测结果图示
3 讨论
慢性心力衰竭是由多种病因诱发的器质性心血管疾病,可导致心肌收缩力减弱和心脏泵血功能降低。最新流行病学调查表明:发达国家成年人群中CHF发病率为1%~3%,其中65岁以上的老年人群中高达10%,在我国CHF患病率为1.9%。此外,心衰患者的预后较差,病死率较高,重者可高达40%以上[9]。而传统CHF的药物并未产生显著的血管“逆重构”作用,未能显著改善收缩功能。近年,基于心肌本身自有的生长因子为治疗手段的生物疗法在心衰的动物模型中得以广泛研究,为CHF的治疗开辟新路径。
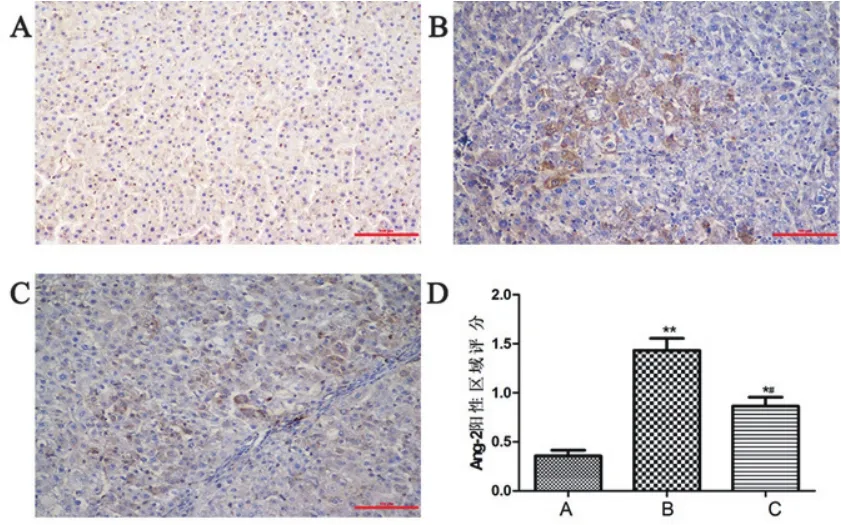
图3 三组大鼠Ang-2蛋白免疫组化检测结果图示(×200)
neuregulin-1β参与细胞内多个信号级联通路(包括Raf/MEK/ERK通路、PI3K/AKT,JNK和cdk5等)发挥促进心肌细胞生长和保护心肌细胞等的作用[10],该研究表明,neuregulin-1β的干预有效减轻阿霉素诱导的CHF大鼠心肌损伤,改善各项心功能指标,纠正心衰,此外,neuregulin-1β的干预显著改善大鼠心肌细胞的病变情况。已有研究结果显示neuregulin-1β具有抑制大鼠心肌细胞凋亡、促进大鼠心肌细胞增殖和DNA合成的作用,同时neuregulin-1β可使离体的大鼠心肌细胞免受阿霉素诱导的凋亡影响[11],但上述研究仅在细胞水平做探讨,本研究进一步在动物体内尤其是验证neuregulin-1β对于阿霉素诱导的CHF的保护作用。
进一步的研究结果显示neuregulin-1β对CHF大鼠的保护作用可能与下调Ang2、CB1、PKC的表达密切相关。研究表明CB1受体激动剂可导致大鼠离体心脏心率减慢,心脏收缩和舒张程度降低,同时表明CB1受体参与大鼠心率和心肌收缩性的调节[12],neuregulin-1β可能通过下调CB1受体的表达而调节CHF大鼠的心率;Ang家族是一类特异性作用于血管内皮细胞的调节因子,研究表明Ang2可竞争性地抑制Ang1稳定血管的作用,在生长因子存在的条件下,Ang2可以加强生长因子的促血管生成作用,诱导血管出芽和重建[13],因此基于以上研究结果,neuregulin-1β可能通过下调Ang2而发挥抑制CHF大鼠心肌重构的作用,同时neuregulin-1β明显抑制PKC的表达,这可能与PKC参与阿霉素介导的心肌肥大有关,当发生心衰时,不同亚型的 PKC表达均有所提高[14],通过进一步研究发现,与正常心肌细胞相比较,PKC 在心衰细胞中可作为肥大信号传导,同时其活性明显增加,但有待于进一步实验研究。

图4 三组大鼠CB1蛋白免疫组化检测结果图示(×200)
综上所述,neuregulin-1β的干预明显改善CHF大鼠各项心功能指标及大鼠心肌细胞的病变情况,而其作用机制可能与下调Ang2、CB1、PKC的表达密切相关。
