辽宁沈阳甜椒曲叶病的病原鉴定
2018-02-10杨彩霞付晶晶廖一鸣于美春
杨彩霞, 付晶晶, 韩 彤, 廖一鸣, 李 莉, 于美春
(沈阳大学生命科学与工程学院/辽宁省城市有害生物治理与生态安全重点实验室,辽宁 沈阳 110044)
植物杆状病毒科(Virgaviridae)烟草花叶病毒属(Tobamovirus)病毒是一类无包膜的大小为(300~310) nm×18 nm的杆状病毒.基因组为一条长6.3~6.6 kb的正单链RNA,至少编码4个蛋白,参与病毒的包装、移动和复制,分别为衣壳蛋白(coat protein,CP)、 移动蛋白(movement protein,MP)和2个复制蛋白(replicase,Rep).自然条件下该属病毒可通过汁液摩擦和种子传染[1].目前,该属病毒有25个确定种.其中,辣椒轻斑驳病毒(Peppermildmottlevirus,PMMoV)发生范围最广,在全球辣椒种植区均能发生和为害[2-8];PMMoV还在土壤、加工食品、饮用水、污水和劳动工具上被检测到,并且具有侵染活性[9-13].PMMoV的高致病性和强抗逆性是其在世界范围内广泛分布的重要原因.依据PMMoV克服寄主L系列等位基因L1、L1a、L2、L3和L4介导的抗性能力,将其分为P0、P1、P1,2、P1,2,3和P1,2,3,45种致病型[14-15].目前,中国报道的PMMoV均属于P1,2型,在北京、河北、宁夏、新疆、江西、贵州、湖南、福建、云南、湖北、四川、江苏、广西、山东和辽宁等地[16-23]被发现,给我国辣椒产业造成重大损失.本研究从辽宁省沈阳市表现严重曲叶症状的甜椒上分离到病菌,对其进行电镜观察和RT-PCR检测,并对其致病性进行测定,以明确该病害的致病菌,为其防治提供依据.
1 材料与方法
1.1 材料

图1 甜椒感染PMMoV的症状(A)和病毒粒子形态(B)Fig.1 Symptoms of the infected sweet pepper plants (A) and morphology of viral particle (B)
2015 年7月于辽宁省沈阳市大东区采集具有严重曲叶症状的甜椒叶片(图1A),置于-80 ℃超低温冰箱内保存.摩擦接种用的辣椒(Capsicumannuum)和心叶烟(Nicotianaglutinosa)种子由福建农林大学植物病毒研究所吴祖建研究员惠赠.
1.2 方法
1.2.1 透射电镜观察 取具有典型曲叶症状的甜椒叶片置于研钵中,加少量磷酸盐缓冲液(phosphate buffer,PB),研磨至匀浆状,6 000 r·min-1离心3 min.取上清,铜网置其中吸附1 min后,于2%磷钨酸中染色10 s,置于透射电镜(Hitachi TEM system)下观察.
1.2.2 植物总RNA的提取及病毒的RT-PCR检测 采用RNA Simple Total RNA Kit[天根生化科技(北京)有限公司]提取甜椒病叶总RNA,再利用TIANScript RT Kit[天根生化科技(北京)有限公司]反转录合成第一链cDNA.具体操作:总RNA 3.0 μL, Oligo(dT)15(10 μmol·L-1) 2.0 μL,Super Pure dNTPs (2.5 mmol each) 2.0 μL,补RNase-Free ddH2O至14.5 μL后混匀,置70 ℃金属浴加热5 min,迅速在冰上冷却2 min,短暂离心后加入TIANScript M-MLV反转录酶(200 U·L-1) 1.0 μL、RNase抑制剂(20 U·μL-1) 0.5 μL、5×First-Strand Buffer 4.0 μL,混匀后置于42 ℃下50 min,90 ℃ 5 min终止反应,置冰上冷却后加入RNase-Free ddH2O至50.0 μL备用.
以上述cDNA作为模板,用Tobamovirus检测通用引物TMV-mpf(AGTTGTTGATGAGTTCATGGA)/TMV-3nr(CAACCCTTCGATTTAAGTGGA)[24]进行PCR扩增(引物由北京奥科鼎盛生物科技有限公司合成).PCR反应体系为25 μL,循环参数:94 ℃ 3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 50 s,共35个循环;72 ℃延伸5 min.用1%琼脂糖凝胶对PCR产物进行电泳检测,目的片段经TIANgel Midi Purification Kit[天根生化科技(北京)有限公司]回收和纯化.将纯化产物与克隆载体pMD18-T[宝生物工程(大连)有限公司]于16 ℃金属浴中连接1 h,连接产物转入感受态细胞DH5α菌株中,于37 ℃倒置培养过夜.挑取单菌落,于37 ℃、280 r·min-1摇床培养7 h,取2 μL菌液进行PCR鉴定.测序由生工生物工程(上海)股份有限公司完成.
1.2.3 序列分析 序列同源搜索利用NCBI(National Center for Biotechnology Information)数据库的BLAST程序(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)完成.同源性分析利用DNAStar的Clustal V程序完成.对于进化树构建,先利用Clustal_X version 1.83[25]进行完全联配,再用软件MEGA version 5.0[26]的最大似然法绘制,置信度设置为1 000,分支节点上的数值为后验概率(>50%).用于序列同源性比较和系统进化树构建的病毒序列信息见表1.
1.2.4 摩擦接种试验 将RT-PCR检测呈PMMoV阳性的辣椒植物作为毒源,采集1.0 g新鲜病叶,置于研钵中,经0.1 mol·L-1PB研磨成匀浆状后用纱布过滤得到初提病汁液.在辣椒和心叶烟健康植物叶片上撒少许金刚砂,蘸取病汁液单向摩擦叶片3次,接种植物放置0.5 h,用蒸馏水洗去叶片残留物,置温室中观察叶片变化.试验设3个重复,同时设阴性对照(健康植物只接种PB溶液,不接种病毒).所有植物置于26 ℃温室中,每3 d观察一次症状并记录.
2 结果与分析
2.1 辣椒病叶的电镜观察结果
将新鲜辣椒病叶于透射电镜下进行病毒粒子的负染色观察,可见300 nm×18 nm的线性粒子,病毒粒子外表面无包膜(图1B).病毒粒子形态特征显示,该病毒应为Tobamovirus成员,而健康植物叶片中没有这种病毒粒子.
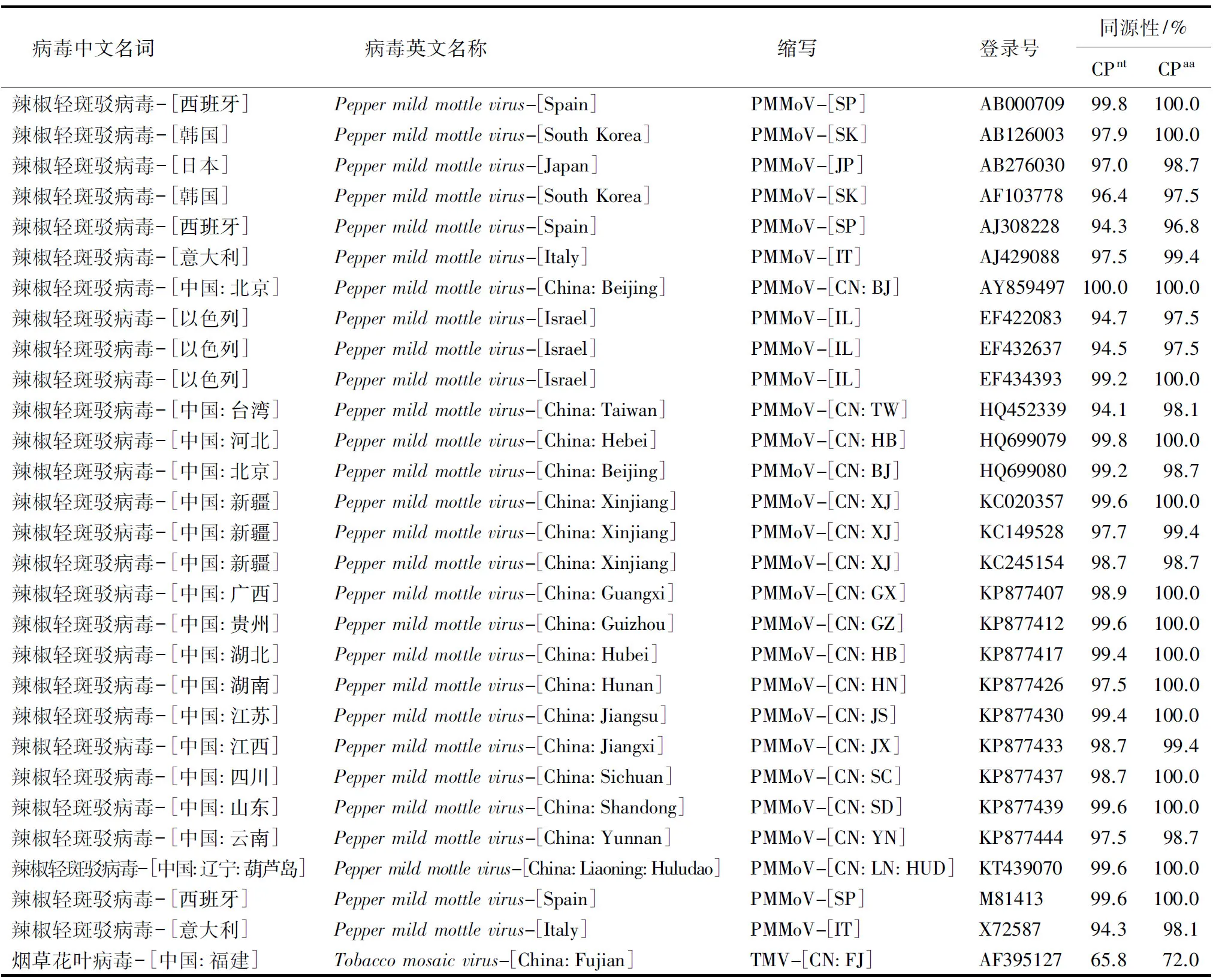
表1 PMMoV沈阳Pepsy分离物与其他报道的PMMoV分离物cp基因的核苷酸和氨基酸序列同源性1)Table 1 Percentage of nucleotide sequence identity and amino acid identity between cp gene of PMMoV isolate Pepsy of Liaoning and other published PMMoV
1)nt:核苷酸;aa:氨基酸.
2.2 RT-PCR检测结果
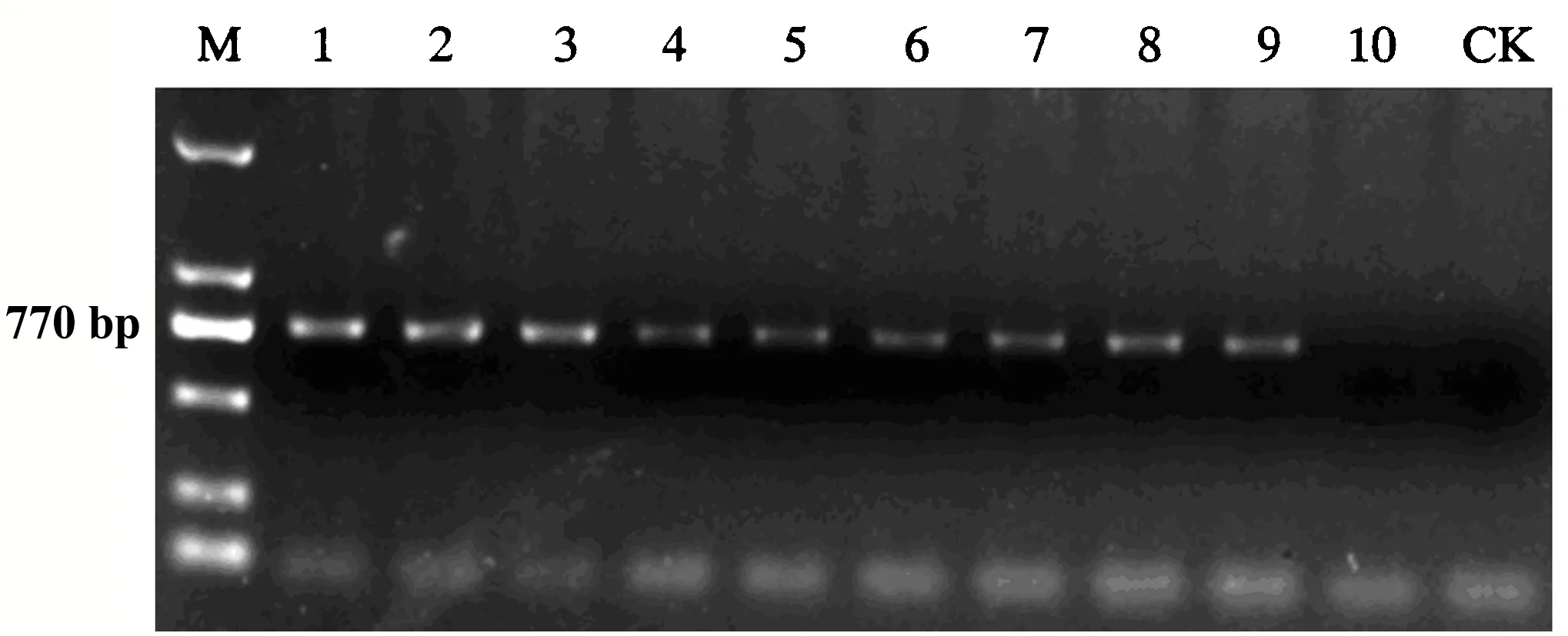
M:DL2 000 DNA marker;1-9:辣椒病样;10:健康辣椒;CK:水.图2 PMMoV的RT-PCR检测结果Fig.2 RT-PCR detection of PMMoV
以甜椒病叶cDNA为模板,利用引物TMV-mpf/TMV-3nr进行PCR扩增,得到1条约770 bp的特异性片段,而健康辣椒中未检测到该片段(图2).测序结果显示,该片段长度为769或771 nts(KX524520-KX5245202, KY234288-KY234293).Blast比对显示该片段序列与PMMoV高度同源,同源性为94%~99%,包含474 nts的完整cp基因.
2.3 序列分析
PMMoV 9个沈阳分离物cp基因的核苷酸序列同源性和CP蛋白的氨基酸序列同源性均为98.3%~100.0%(表2),可见它们属同一个分离物,后续选取分离物Pepsy进行同源性分析.基于cp基因将PMMoV Pepsy分离物与GenBank中已报道的PMMoV各个分离物进行比对,核苷酸同源性为93.7%~99.8%,氨基酸同源性为96.8%~100.0%,其中与PMMoV北京分离物(PMMoV-[CN:BJ], AY859497)的同源性最高,均达100%(表1).系统进化树表明,沈阳PMMoV 9个分离物与P1,2型 PMMoV聚在一个大分支上,而P1,2,3型和P1,2,3,4型聚在另一个分支上,TMV-[CN:FJ](AF395127)作为外群单独聚在一个分支上(图3).
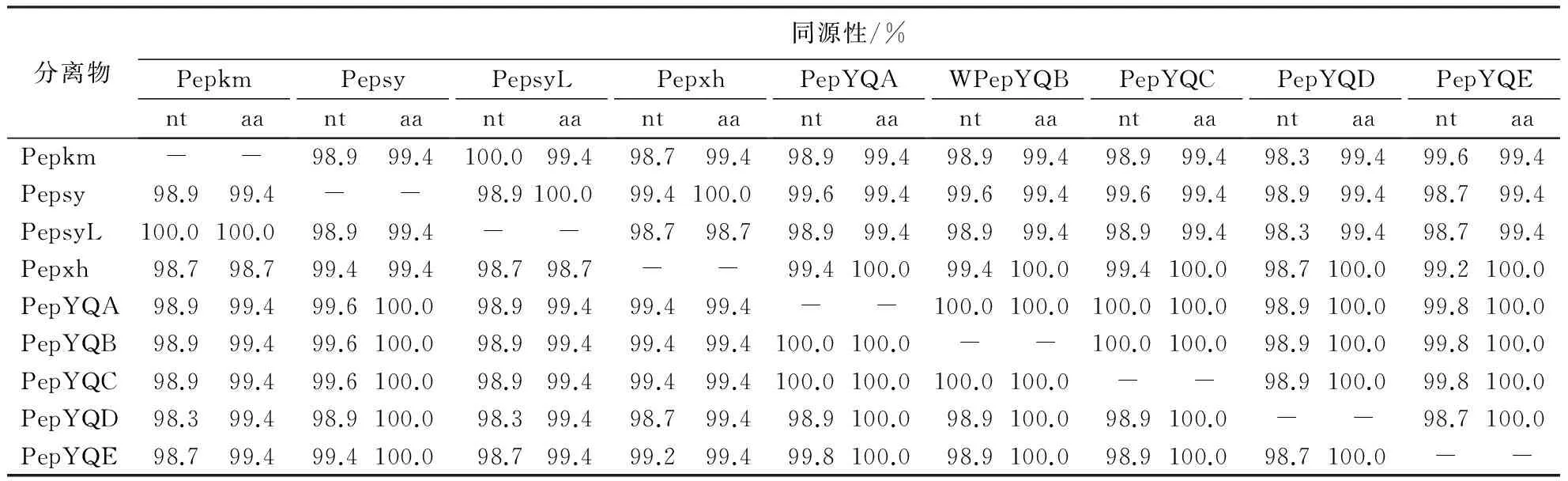
表2 PMMoV沈阳9个分离物之间的CP同源性1)Table 2 Sequence identities based on the cp of 9 Shenyang isolates
1)nt:核苷酸;aa:氨基酸.

图3 基于报道的PMMoV和PMMoV沈阳分离物cp基因构建的系统进化树Fig.3 Phylogenetic trees based on cp sequences of Shenyang isolates and other previously reported PMMoV
2.4 摩擦接种
接种6 d后,心叶烟的接种叶片出现了明显的浅褐色局部坏死斑(图4B),但系统叶片上始终无症状出现(图4C).辣椒的接种叶片在接种9 d后出现局部坏死斑(图4I),系统叶片在接种30 d后出现中度曲叶症状(图4J).利用引物TMV-mpf/TMV-3nr检测接种植物,发现心叶烟接种叶片中PMMoV呈阳性,系统叶片中PMMoV呈阴性(图4G);而在辣椒的接种叶片和系统叶片中PMMoV均呈阳性(图4N).2组阴性对照始终未表现症状(图4D-F,K-M),且PMMoV检测呈阴性(图4G,N).上述结果表明,PMMoV仅可局部侵染心叶烟,根据斑点类型判断其为P1,2致病型;但是可突破辣椒的防御系统实现系统侵染.

IL.接种叶片;SL.系统叶片.A-F.心叶烟接种PMMoV后的症状表现;H-M.辣椒接种PMMoV后的症状表现.G和N分别为心叶烟和辣椒摩擦接种30 d后PMMoV的PCR检测结果[M:DL2 000 DNA marker;1-6:健康植株接种PMMoV;7-8:健康植株接种PB缓冲液.其中,1、3、5和7为接种叶片;2、4、6和8为系统叶片.CK+:PMMoV侵染样品;CK-:健康植株].图4 PMMoV在心叶烟和辣椒上的致病性检测Fig.4 Pathogenicity determination of PMMoV on N.glutinosa and C.annuum plants
3 讨论
李晓冬等[23]发现辽宁省葫芦岛地区温室大棚辣椒上暴发的病毒病与PMMoV有关.2015年起,在沈阳大东区田间有20%甜椒表现严重的曲叶症状.经电镜观察和分子检测确定该病害的相关病毒为PMMoV;进化树分析发现,PMMoV中国分离物均与P1,2型聚类,这与张强等[20]的分析结果一致.摩擦接种试验显示,PMMoV可传播到健康的辣椒上,可系统侵染辣椒并诱导中度曲叶症状的发生,证明PMMoV与甜椒重型曲叶病相关.但接种辣椒未见重型曲叶症状,可能有2种原因:(1)接种辣椒品种与自然发病的辣椒品种不同,接种症状受到辣椒基因型、接种时间以及接种温度等因素的影响;(2)尽管电镜观察和RT-PCR检测均未发现其他病毒的存在,但是不能完全排除这个可能性.例如,PMMoV在自然条件下可分别与属内的烟草花叶病毒(Tobaccomosaicvirus,TMV)和马铃薯Y病毒属的辣椒斑驳病毒(Peppermottlevirus,PepMoV)复合侵染辣椒[21,27].本研究虽然未能完全验证柯赫氏法则,但证明了PMMoV与重型甜椒曲叶病害相关.由于PMMoV的致病性和存活能力较强,极易扩散蔓延,为避免其给农业生产带来威胁,有必要对这类病害进行防控.
[1] KING A M, ADAMS M J, LEFKOITZ E J. Virus taxonomy: ninth report of the International Committee on Taxonomy of Viruses[R]. Amsterdam, Netherlands: Elsevier, 2012:1 152-1 155.
[2] WETTER C, CONTI M, ALTSCHUH D, et al.Peppermildmottlevirus, a tobamovirus infecting pepper cultivars in Sicily[J]. Phytopathology, 1984,74(4):405-410.
[3] MNARI-HATTAB M, EZZAIER K, HAMZA N. Sequence analysis of a Tunisian isolate ofPeppermildmottlevirus(PMMoV) that overcomes L1and L2resistance genes of pepper in Tunisia[J]. Tunisian Journal of Plant Protection, 2006,1:65-71.
[4] HERRERA-VASQUEZ J A, CORDOBA-SELLES M C, CEBRIAN M C, et al. First report ofPeppermildmottlevirusandTobaccomildgreenmosaicvirusinfecting pepper in Panama[J]. Plant Pathology, 2009,58:786.
[5] DE OLIVEIRA L M, INOUE-NAGATA A K, NAGATA T. Complete genome nucleotide sequence ofPeppermildmottlevirusisolated in the Federal District, Brazil[J]. Tropical Plant Pathology, 2010,35(6):373-376.
[6] CAGLAR B K, FDAN H, ELBEAINO T. Detection and molecular characterization ofPeppermildmottlevirusfrom Turkey[J]. Journal of Phytopathology, 2013,161:434-438.
[7] RIALCH N, SHARMA V, SHARMA A, et al. Characterization and complete nucleotide sequencing ofPeppermildmottlevirusinfecting bell pepper in India[J]. Phytoparasitica, 2015,43(3):327-337.
[8] CHOI S K, CHOI G S, KWON S J, et al. Complete nucleotide sequences and genome organization of twoPeppermildmottlevirusisolates fromCapsicumannuumin South Korea[J]. Genome Announc, 2016,4(3):e00411-16.
[9] COLSON P, RICHET H, DESNUES C, et al.Peppermildmottlevirus, a plant virus associated with specific immune responses, fever, abdominal pains, and pruritus in humans[J]. PLoS ONE, 2010,5:e10041.
[10] HAMZA I A, JURZIK L, UBERLA K, et al. Evaluation of pepper mild mottle virus, human picobirnavirus and Torque teno virus as indicators of fecal contamination in river water[J]. Water Research, 2011,45(3):1 358-1 368.
[11] HAN T H, KIM S C, KIM S T, et al. Detection of norovirus genogroup Ⅳ, klassevirus, andPeppermildmottlevirusin sewage samples in South Korea[J]. Archives of Virology, 2014,159:457-463.
[12] HARAMOTO E, KITAJIMA M, KISHIDA N, et al. Occurrence ofPeppermildmottlevirusin drinking water sources in Japan[J]. Applied and Environmental Microbiology, 2013,179:7 413-7 418.
[13] ROSARIO K, SYMONDS E M, SINIGALLIANO C, et al.Peppermildmottlevirusas an indicator of fecal pollution[J]. Applied and Environmental Microbiology, 2009,75:7 261-7 267.
[14] SAWADA H, TAKEUCHI S, HAMADA H, et al. A new tobamovirus-resistance gene, L1aof sweet pepper (CapsicumannuumL.)[J]. Journal of the Japanese Society for Horticultural Science, 2004,73:552-557.
[15] VELASCO L, JANSSEN D, RUIZ-GARCIA L, et al. The complete nucleotide sequence and development of a differential detection assay for aPeppermildmottlevirus(PMMoV) isolate that overcomes L3resistance in pepper[J]. Journal of Virological Methods, 2002,106:135-140.
[16] XIANG B, XIE H, CUI X M, et al. Isolation and identification of pepper mild mottle tobamovirus in Xinjiang[J]. Chinese Journal of Virology, 1994,10:240-244.
[17] WANG X, LIU F, ZHOU G, et al. Detection and molecular characterization ofPeppermildmottlevirusin China[J]. Journal of Phytopathology, 2006,154(12):755-757.
[18] PENG J, SHI B, ZHENG H, et al. Detection ofPeppermildmottlevirusin pepper sauce in China[J]. Archives of Virology, 2015,160(8):2 079-2 082.
[19] LI X D, AN M N, WU Y H. First report ofPeppermildmottlevirusin Northeast China[J]. Plant Disease, 2016,100(2):541.
[20] 张强,张春竹,李克梅,等.辣椒轻斑驳病毒(PMMoV)新疆加工型辣椒分离物的鉴定和致病型分析[J].中国农学通报,2014,30(25):296-302.
[21] 鲁宇文,彭杰军,郑红英,等.一种辣椒轻斑驳病毒和辣椒斑驳病毒复合侵染的线椒病毒病害分子鉴定[J].科技通报,2015,31(9):85-88.
[22] 刘健,张德咏,张松柏,等.湖南和福建辣椒上辣椒脉斑驳病毒的检测及系统发育分析[J].江苏农业科学,2016,44(5):184-185.
[23] 李晓冬,安梦楠,王冠中,等.辣椒轻斑驳病毒辽宁分离物的鉴定及序列分析[J].沈阳农业大学学报,2016,47(1):29-34.
[24] HUANG J G, DENG C L, FAN Z F, et al. Isolation and identification ofTobaccomosaicvirusinfectingSyringaoblate[J]. Acta Phytopathologica Sinica, 2004,34(3):215-220.
[25] THOMPSON J D, GIBSON T J, PLEWNIAK F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997,25:4 876-4 882.
[26] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011,28(10):2 731-2 739.
[27] 冯兰香,张宝玺,谢丙炎,等.3种辣椒新病毒的发生与血清学鉴定[J].中国蔬菜,2005,1(12):33-34.
