沟纹硬皮地蛛粗毒的多肽成分初探
2018-02-10陈连水黄亚洲段志贵刘中华梁宋平
唐 兴, 陈连水, 黄亚洲, 段志贵, 刘中华, 梁宋平
(1.东华理工大学江西省质谱科学与仪器重点实验室,江西 南昌 330013;2.湖南师范大学动物多肽药物国家地方联合工程实验室,湖南 长沙 410081)
作为最有毒的动物之一,蜘蛛通过自身毒液杀死猎物或防御天敌.蜘蛛毒液是复杂的化学混合物,其中成分包括低分子质量有机成分(<1 ku),线性细胞溶解肽和富含二硫键的神经毒素多肽(1~9 ku)、蛋白质和酶(>10 ku)[1].其中,神经毒素多肽在蜘蛛毒液中含量最高,其研究报道也最多.蜘蛛神经毒素多肽的主要靶标是各种离子通道,它们是存在于神经元和肌细胞的电兴奋细胞膜上的蛋白质成分.这些离子通道包括各种不同的电压门控离子通道(钾、钠、钙),还有化学性、热学性、机械敏感性的离子通道[2-4].蜘蛛毒液中也含有一些线性细胞溶解肽,它们主要分离于狼蛛总科蜘蛛的毒液,能够杀灭各种细菌、真菌、寄生虫、昆虫等[4-6].
中国蜘蛛资源丰富,有记载的超过3600种.在我国蜘蛛毒液研究中,涉及种类最多的是捕鸟蛛科蜘蛛,如虎纹捕鸟蛛、敬钊缨毛捕鸟蛛、海南捕鸟蛛等[7-9],因为其个体大和毒液分泌量较多被广泛研究;其次如穴居狼蛛、黑寡妇蜘蛛、雷氏大疣蛛[10,11],因其毒性较高也被研究者关注.但是大多数蜘蛛体型较小,或其毒液分泌量较少,研究开展困难,因此未进行毒素研究的蜘蛛种类占绝大多数.
地蛛科隶属蜘蛛目原蛛下目,是穴居地下生活的蜘蛛类群,在我国已发现的种类有43种.它们可以分为3个属:Atypus(29种)、Calommata(7种)、Sphodros(7种).沟纹硬皮地蛛最早在日本发现,在我国一些地区也有分布,它是农林业重要的害虫天敌,具有一定保护意义.其显著体征是头胸部呈浅橙色, 两侧边缘逐渐呈深褐色.腹部呈褐色,腹部下方前方有一白斑.螯爪呈黑褐色,值得注意的是这对螯肢(连螯爪)在整个身体中占较大的比例.关于沟纹硬皮地蛛的结构形态和农业保护方面已有些研究[12-15],但至今国内外还未有对其毒液以及所含成分进行过研究报道.
本次试验首次通过电刺激法采集沟纹硬皮地蛛毒液,然后进行高效液相色谱分离,再对其所含多肽成分进行MALDI-TOF-TOF质谱鉴定.通过比较沟纹硬皮地蛛毒素多肽成分的分子质量特征与已报道蜘蛛的异同点,揭示该种蜘蛛毒液成分的特异性.
1 材料与方法
1.1 沟纹硬皮地蛛采集与粗毒的制备

图1 沟纹硬皮地蛛Fig.1 Calommata signatum
雌性沟纹硬皮地蛛(图1)采集于贵州省山区的土壤穴洞,然后在实验室人工饲养.沟纹硬皮地蛛毒液通过电刺激器采集(参数为中等强度频率,20 V电压强度).毒液冷冻干燥后即为粗毒,-20 ℃保存.
1.2 沟纹硬皮地蛛粗毒的分离纯化
精确称取沟纹硬皮地蛛粗毒1.0 mg,用0.5 mL双蒸水溶解,高速离心后取上清液即为样品溶液.分离使用Alliance高效液相色谱仪(Waters),色谱柱采用Phenomenex C18反相柱(250 mm×4.6 mm),分离过程采用两相洗脱系统.流动相:A液为含0.1%三氟乙酸(体积分数)的双蒸水;B液为含0.1%三氟乙酸(体积分数)的乙腈.A、B液都通过加入惰性气体除去溶液中气泡.先用A液脱盐15 min,然后再用B液进行洗脱.洗脱流速为1.0 mL·min-1,其监测的波长为215和280 nm,洗脱时柱温为25 ℃.其洗脱梯度为:0~10 min,5~15 B%;10~45 min,15~40 B%;45~50 min,40~100 B%.根据洗脱时间收集各洗脱峰,并冷冻干燥后保存.
1.3 质谱鉴定
通过德国MALDI-TOF-TOF质谱仪(UltraFlex I, Bruker Daltonics)进行多肽分子质量的鉴定,仪器设定为线性工作模式.配制含有0.1%三氟乙酸和50%乙腈的饱和 α-氰基-4-羟基肉桂酸溶液,超声后高速离心5~10 min,取上清溶液作为基质溶液.
沟纹硬皮地蛛粗毒溶液取1 μL,并用双蒸水稀释50倍,然后取0.5 μL与基质按1∶1的比例混合后点样.将干燥后的洗脱成分用2 μL双蒸水溶解,再各取1 μL与基质溶液按1∶1的比例混合后点样于金属靶盘上,在室温下风干10 min后进行分子质量鉴定.
2 结果与分析
2.1 粗毒的色谱分离
通过C18反向色谱柱对沟纹硬皮地蛛粗毒进行分离,在波长280和215 nm下均有检测(图2A和2B).结果显示,同一次分离过程中,在波长215 nm检测明显比波长280 nm检测灵敏,分离效果较好,后者洗脱峰数量较多.因此,本试验在波长215 nm检测下,根据不同洗脱时间共收集37个洗脱峰(图2B).
2.2 质谱鉴定
沟纹硬皮地蛛粗毒通过MALDI-TOF-TOF质谱鉴定后,图3显示了该粗毒的主要离子峰.分子质量([M+H+])可分成两个区域:较低分子质量毒素多肽,分子质量分别为1708.3和3543.0 u;较高分子质量毒素多肽,分子质量为6 445.3、7 771.7、7 878.4 u.

A.波长280 nm;B.波长215 nm.图2 沟纹硬皮地蛛毒素多肽的反相色谱分离图Fig.2 Reversed-phase HPLC profile of toxin peptides from C.signatum
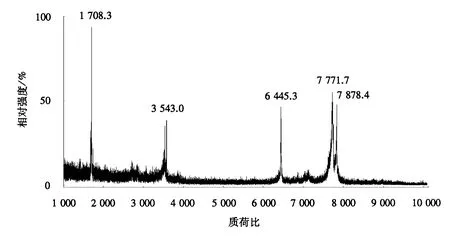
图3 沟纹硬皮地蛛粗毒的MALDI-TOF质谱图Fig.3 Mass spectrum of MALDI-TOF from C.signatum venom
通过MALDI-TOF-TOF质谱检测洗脱峰的质荷比,其中大部分洗脱峰可以鉴定到分子质量结果(表1).绝大多数洗脱峰的质谱图谱中出现了两个以上的的信号峰,主要信号峰一般明显强于其他信号峰,说明该成分为此洗脱峰中的主要成分.另外,少数质谱图谱中仅含有1个信号峰,几乎不存在其他信号峰,说明该洗脱峰所含成分纯度很高;这些成分的洗脱时间和对应的分子质量([M+H+])分别为7 949.0(29.29 min)、2 226.8(29.59 min)、7 771.7(31.97 min)、7 293.1(34.01 min)、2 757.9 u(40.33 min).
但是,几个洗脱面积较大的洗脱峰(洗脱时间分别为17.74、20.82、22.01、24.56、37.77 min)并无鉴定结果(图2B).究其原因,可能是质谱检测时设置的质荷比在1 000~10 000 u,而该蜘蛛粗毒中可能还含有一些小分子多胺类成分,因此无法在此分子质量范围检测.

表1 沟纹硬皮地蛛毒素多肽的分子量列表1)Table 1 Molecular weight of toxin peptides from C.signatum
1)每个洗脱峰的质谱图谱中出现的最强信号峰用下划线显示;“—”表示未鉴定到结果.
2.3 分子质量分布和频率图
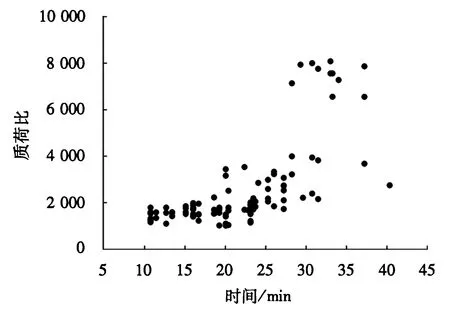
图4 沟纹硬皮地蛛粗毒的多肽分子质量分布图Fig.4 Molecular weight distribution of toxin peptides from C.signatum crude venom
本试验从沟纹硬皮地蛛粗毒中一共鉴定到105种不同分子质量(去冗余)的毒素多肽组分.统计数据结果表明:分子质量分布和频率图体现了沟纹硬皮地蛛毒素多肽的分布特征(图4和5),大多数多肽的分子质量分布范围在1 000~3 500 u(占总数84.8%),还有一部分多肽的分子质量分布在3 500~4 500 u(占总数4.7%)和6 500~8 500 u(占总数10.5%),但是毒素多肽在分子质量分布范围4 500~6 500 u和8 500~10 000 u内没有检测到.另外,从反向色谱分离的洗脱时间来看,大多数毒素多肽在洗脱时间10~28 min被洗脱收集,且分子量几乎全在小于4 000 u以下;而大于6 500 u以上的毒素多肽均出现在洗脱时间28min之后的洗脱峰中.

图5 沟纹硬皮地蛛粗毒的多肽频率柱状图Fig.5 Frequency histogram of toxin peptides from C.signatum crude venom
3 结论与讨论
本试验首先对沟纹硬皮地蛛粗毒进行直接质谱鉴定,然后利用反向高效液相色谱分离后,再通过质谱对各洗脱成分进行分子质量鉴定.结果表明,未分离粗毒的直接质谱鉴定,明显只能获得极少的多肽分子质量信息.因为通常对蜘蛛粗毒的直接质谱检测中,由于多肽成分较多,从而导致质谱检测时会产生离子抑制效果[16].另一方面,MALDI-TOF-TOF质谱采用的是线性工作模式,尽管在该模式下灵敏度比反射模式高得多,但是分子质量较大的多肽分子(>4 000 u)更容易获得离子峰.在粗毒的直接质谱鉴定图中,在低分子质量分布范围(<4 000 u),仅1 708.3和3 543.0 u两个明显的离子峰;而反向高效液相色谱分离结合质谱分析的结果显示,分子质量小于4 000 u的多肽成分占该粗毒成分的绝大多数.因此,对沟纹硬皮地蛛粗毒进行反向高效液相色谱分离结合质谱分析更能真实反映该蜘蛛粗毒中多肽成分的分子质量特征(分布、丰度、数量、频率等).
沟纹硬皮地蛛隶属于原蛛下目蜘蛛,该下目蜘蛛还包括捕鸟蛛科、异纺蛛科、螲蟷科、漏斗网科的蜘蛛(http://www.wsc.nmbe.ch/).其中,捕鸟蛛科蜘蛛毒液研究较多,其毒素多肽分子量分布范围1 000~9 000 u,其主要分子质量范围分布在3 500~4 500 u[17],一般含有3~5对二硫键,肽链长度多为30~45个氨基酸残基.这些毒素多肽分子的功能主要是作用于昆虫和哺乳动物细胞膜上的各种离子通道.沟纹硬皮地蛛毒素多肽的分子质量分布范围在1 000~8 500 u,这与捕鸟蛛科蜘蛛多肽分子质量分布范围基本吻合.但是明显不同的是,沟纹硬皮地蛛毒素多肽的主要分子量范围集中在1 000~3 500 u,可以推测其毒素多肽主要为小于30个氨基酸的短链多肽.而且,这种蜘蛛粗毒的毒素多肽成分在分子质量4 500~6 500 u范围发生缺失,这与捕鸟蛛科蜘蛛毒素多肽成分明显不同.另外,沟纹硬皮地蛛毒素多肽成分与其他种类蜘蛛所含成分比较,其分子质量分布特征也各不相同,说明地蛛科蜘蛛所含毒液成分具有该科的特有性质[10,11,18,19].本试验是首次对沟纹硬皮地蛛毒液所含多肽成分的初探,鉴定了该蜘蛛毒素多肽成分分子质量的大体分布情况,希望能对今后的进一步研究(如测序、cDNA文库构建、多肽活性功能测定等)提供借鉴作用.
[1] WIGGER E, KUHN-NENTWIG L, NENTWIG W. The venom optimisation hypothesis: a spider injects large venom quantities only into difficult prey types[J]. Toxicon, 2002,40(6):749-752.
[2] PHILLIPS L R, MILESCU M, LI-SMERIN Y, et al. Voltage-sensor activation with a tarantula toxin as cargo[J]. Nature, 2005,436(7052):857-860.
[3] BOHLEN C J, PRIEL A, ZHOU S, et al. A bivalent tarantula toxin activates the capsaicin receptor, TRPV1, by targeting the outer pore domain[J]. Cell, 2010,141(5):834-845.
[4] VASSILEVSKI A A, KOZLOV S A, GRISHIN E V. Molecular diversity of spider venom[J]. Biochemistry (Mosc), 2009,74(13):1 505-1 534.
[5] KUHN-NENTWIG L, WILLEMS J, SEEBECK T, et al. Cupiennin 1a exhibits a remarkably broad, non-stereospecific cytolytic activity on bacteria, protozoan parasites, insects, and human cancer cells[J]. Amino Acids, 2011,40(1):69-76.
[6] 唐兴,陈连水,李江.蜘蛛抗菌肽研究进展[J].生命科学,2014,26(10):1 090-1 095.
[7] TANG X, ZHANG Y Q, HU W J, et al. Molecular diversification of peptide toxins from the tarantula Haplopelma hainanum (Ornithoctonushainana) venom based on transcriptomic, peptidomic, and genomic analyses[J]. Proteome Res, 2010,9(5):2 550-2 564.
[8] LIAO Z, CAO J, LI S M, et al. Proteomic and peptidomic analysis of the venom from Chinese tarantulaChilobrachysjingzhao[J]. Proteomics, 2007,7:1 892-1 907.
[9] YUAN C H, JIN Q H, TANG X, et al. Proteomic and peptidomic characterization of the venom from the Chinese bird Spider,OrnithoctonushuwenaWang[J]. J Proteome Res, 2007,6(7):2 792-2 801.
[10] DUAN Z G, YAN X J, HE X Z, et al. Extraction and protein component analysis of venom from the dissected venom glands ofLatrodectustredecimguttatu[J]. Comp Biochem Physiol B Biochem Mol Biol, 2006,145(3-4):350-357.
[11] ZHANG Y Q, CHEN J J, TANG X, et al. Transcriptome analysis of the venom glands of the Chinese wolf spiderLycosasingoriensis[J]. Zoology (Jena), 2009,113(1):10-18.
[12] 汪耀文,朱传典.陕西省三种蜘蛛记述[J].白求恩医科大学学报,1986,8(6):44-45.
[13] 陈会明.贵州茂兰喀斯特森林自然保护区的蜘蛛种类[J].山地农业生物学报,2003,22(2):127-135.
[14] 陈银方,宋昌琪,刘林敏,等.中国茶园蜘蛛种类研究[J].茶叶科学,2000,20(1):59-66.
[15] 王新国.陕南及关中地区蜘蛛资源研究[J].西安联合大学学报.1999,2(2):19-24.
[16] ESCOUBAS P, SOLLOD B, KING G F. Venom landscapes: mining the complexity of spider venoms via a combined cDNA and mass spectrometric approach[J]. Toxicon, 2006,47(6):650-663.
[17] ESCOUBAS P, RASH L. Tarantulas: eight-legged pharmacists and combinatorial chemists[J]. Toxicon, 2004,43:555-574.
[18] DUAN Z G, CAO R, JIANG L P, et al. A combined de novo protein sequencing and cDNA library approach to the venomic analysis of Chinese spiderAraneusventricosus[J]. Journal of Proteomics, 2013,14(78):416-427.
[19] XU X X, WANG H Y, ZHANG F, et al. A comparative analysis of the venom gland transcriptomes of the fishing spidersDolomedesmizhoanusandDolomedessulfurous[J/OL]. PLoS One, 2015,10(10)[2015-10-07]http://trove.nla.gov.au/work/198217190?q&versionId=217020089.
