血管病相关性眼肌麻痹的病因与预后分析
2018-02-09李然李文文胡晓明王佳伟景筠
李然,李文文,胡晓明,王佳伟,景筠
眼肌麻痹是神经内科及眼科的常见症状与体征。引起眼肌麻痹的病因复杂,有血管性、自身免疫性、感染性、占位性、遗传性、代谢性等不同病因。血管病相关性眼肌麻痹的病变部位既可以是支配眼球运动的颅神经,也可以是位于脑干的眼球运动神经核团及其联系纤维,以及脑干以上的中枢神经系统。本文总结了126例血管病相关性眼肌麻痹的临床资料,对其病因、临床特点进行分析,并对预后进行观察。
1 材料与方法
1.1 研究对象和方法 回顾性收集2012年12月-2016年7月在首都医科大学附属北京同仁医院神经内科以“眼肌麻痹”就诊的住院患者的临床资料,纳入确诊为血管病相关性眼肌麻痹患者,排除自身免疫性、感染性、占位性、遗传性、代谢性、外伤性等因素所致的眼肌麻痹,排除血管病病因不确切者。
收集患者的临床表现、既往史、实验室检查(包括血常规、生化常规、风湿免疫相关指标、血清及脑脊液的病毒、梅毒、结核、布氏杆菌、真菌、寄生虫等检查);影像学检查,如头颅计算机断层扫描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)、磁共振血管成像(magnetic resonance angiography,MRA)、眼眶和海绵窦MRI、CT血管造影或数字减影血管造影等;部分患者的肌肉活检、脱氧核糖核酸(deoxyribonucleic acid,DNA)基因检测结果。对入组患者随访至2016年9月,记录患者眼肌麻痹的缓解时间。缓解定义为眼肌麻痹症状、体征完全消失。
对入组患者的病因进行分析,比较不同病因患者上述临床资料的差异。
1.2 统计学方法 采用SPSS 19.0软件,符合正态分布的计量资料以表示,多组间比较采用方差分析;计数资料用率表示,组间比较采用χ2检验;采用Kaplan-Meier曲线比较缓解时间。以P<0.05为差异有统计学意义。
2 研究结果
2.1 患者的基本资料 研究共纳入126例血管病相关性眼肌麻痹患者,年龄37.7~90.3岁,平均年龄63.4岁,其中男性89例(70.6%),女性37例(29.4%)。微血管缺血性(microvascular ischemic,MVI)病变为血管病相关性眼肌麻痹最常见病因;其次为脑干梗死,其中包括3例核间性眼肌麻痹(internuclear ophthalmoplegia,INO);动脉瘤、眼肌麻痹性偏头痛(ophthalmoplegic migraine,OM)、颈内动脉海绵窦瘘(carotid-cavernous fistulas,CCFs)为相对较少见的病因。不同病因患者中性别、头痛或眼眶痛、瞳孔受累的比例比较有显著差异。MVI病变、脑干梗死、动脉瘤均多见于男性患者,且发病平均年龄在60岁以上;眼肌麻痹性偏头痛多见于女性患者,平均发病年龄相对较小;49.5% MVI病变患者伴有头痛或眶周痛,7%患者瞳孔受累;脑干梗死患者头痛或眼眶疼痛症状较少;2/3动脉瘤患者伴有头痛或眼眶痛;眼肌麻痹性偏头痛和海绵窦动静脉瘘患者头痛、动眼神经麻痹症状突出(表1)。
2.2 微血管缺血性病变与脑干梗死临床特点比较 本研究中MVI病变患者常累及动眼神经(59例,57.3%),其余依次为外展神经(27例,26.2%)、滑车神经(17例,16.5%)。脑干梗死以动眼神经核团受累最常见(12例,70.6%),其次为内侧纵束(3例,17.6%),滑车、外展神经核团受累各1例(5.9%)。MVI病变患者单眼病变比例、复视症状发生率、头痛或眼眶痛的比例高于脑干梗死患者,差异有统计学意义(表2)。
2.3 眼球运动神经微血管缺血性病变与脑干梗死预后分析 共随访52例眼球运动神经MVI病变患者、8例脑干梗死患者,随访时间的中位数为18.5月(10.0月,34.5月)。MVI病变和脑干梗死患者的缓解率分别为88.5%(46例)和87.5%(7例),差异无统计学意义(图1)。动眼、滑车及外展神经MVI病变患者的缓解率分别为89.7%(26/29)、72.7%(8/11)和100%(12/12),缓解率差异也无统计学意义。
Kaplan-Meier曲线图显示,动眼神经MVI病变缓解时间估计值中位数3.7月(3.2月,4.2月),滑车神经MVI病变缓解时间估计值中位数2.9月(2.2月,3.6月),外展神经MVI病变缓解时间估计值中位数3.5月(2.4月,4.6月)(图2)。
3 讨论
本研究显示,MVI病变为血管病相关性眼肌麻痹主要病因,常见血管病危险因素为高血压、高脂血症、吸烟、糖尿病及酗酒。文献报道糖尿病、高血压是MVI病变常见的危险因素[1-2]。Sanjay V Patel等[3]研究认为同时患有高血压及糖尿病,则MVI病变的发生率将提高8倍,说明高血压会影响糖尿病患者MVI病变的发生率。本研究中仅19.4%的MVI病变患者伴有糖尿病,考虑与患者空腹血糖和糖化血红蛋白正常、未监测餐后血糖及未行口服葡萄糖耐量实验有关,还可能与患者血糖异常较轻未达糖尿病诊断标准有关。
本研究中,MVI病变最常累及动眼神经,其次为外展神经,而滑车神经较少。有文献报道,MVI病变多累及动眼神经,而很少单独累及滑车神经,但也有报道外展神经最常受累[1,4-7]。之所以滑车神经受累较少,考虑与临床神经内科医师对滑车神经麻痹识别不足有关。
本研究所涉及的血管病相关性眼肌麻痹不同病因均可伴有前额部或眼眶周围疼痛。有研究显示,无论是否伴有糖尿病,MVI病变均可出现前额部或眼眶周围疼痛,疼痛的发生率高达62%,以动眼神经最常见(77%),滑车神经最少见;动眼神经麻痹伴有的疼痛程度较外展神经麻痹严重[6]。MVI病变之所以可伴有疼痛,其发生机制可能是由于三叉神经眼支在动眼神经和外展神经有少量分布[8-9]。因此,对于伴有疼痛的眼肌麻痹患者,需要详细询问疼痛发生的部位、性质及其他伴随症状,必要时需完善相关影像学检查以除外其他病变。
本研究所涉及的血管病相关性眼肌麻痹不同病因均可累及瞳孔,而瞳孔受累的发生率及程度与病因有关。压迫性病变发生率高,往往为完全性损害,程度重;缺血性病变发生率低,程度轻。MVI病变患者的瞳孔可受累,但受累程度较轻,多不超过1 mm[2,10]。这是因为MVI病变主要累及神经的中央部分,而支配瞳孔运动的纤维行走于动眼神经上方周边部,故缺血对其造成的影响轻[11]。
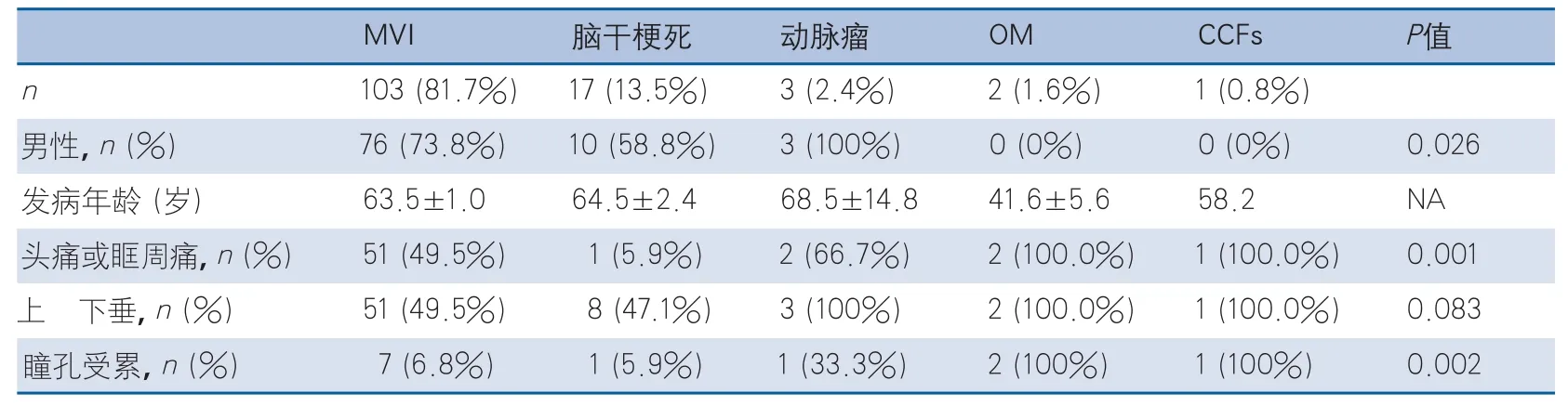
表1 不同病因血管病相关性眼肌麻痹患者临床资料比较
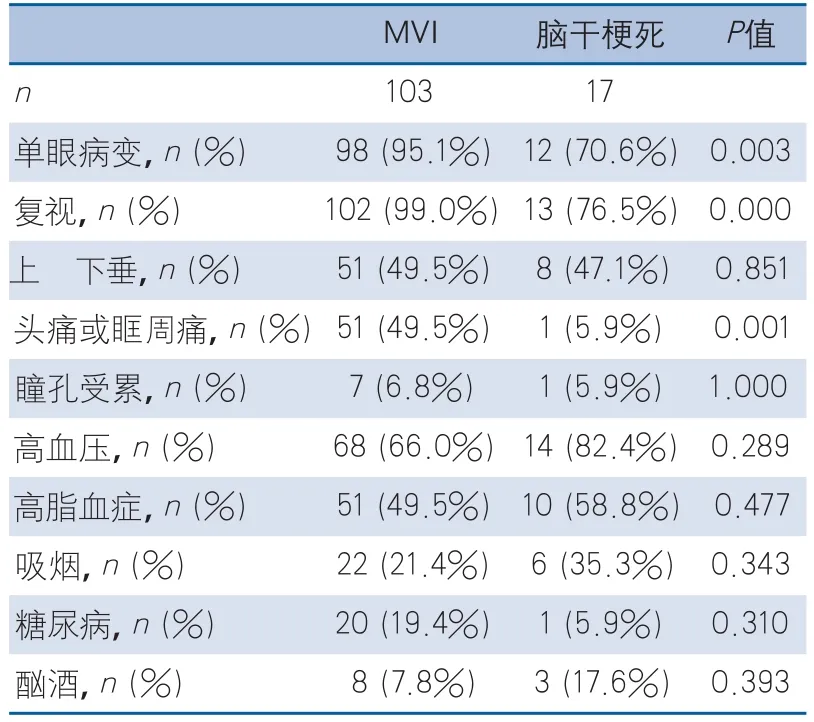
表2 眼球运动神经微血管缺血性病变与脑干梗死临床特点比较
本研究显示脑干梗死以动眼神经核受累最常见(70.6%),其原因是动眼神经的核团分布相对弥散,微小栓子可以仅影响动眼神经的一个亚核,表现不全动眼神经麻痹[12]。值得注意的是,17例脑干梗死患者中包含3例INO患者,提示INO的发生率也不低。有文献报道,38%的INO由脑干梗死导致,INO可以是脑干梗死唯一或主要的症状[13-14]。由于MVI病变和脑干梗死有共同的起病形式、临床表现、危险因素,因此,对于起病年龄较大的眼肌麻痹患者应常规行颅脑MRI检查,以鉴别脑干梗死。
本研究有2例OM患者,均为女性,起病年龄分别为37.7岁和45.6岁,均表现为上睑下垂、复视等症状,瞳孔均有受累。OM常儿童期起病,但首次发病也可在成年期[15]。OM以动眼神经受累最常见,但也可以外展神经受累起病,表现为偏头痛样偏侧头痛伴眶周痛,同时伴随或随后出现疼痛同侧眼肌麻痹[4,15-18]。OM患者早期瞳孔多不受累,后期瞳孔对光反射及调节反射可受累[19]。有研究认为,颈动脉及基底动脉管壁肿胀压迫供应颅神经的小血管导致缺血进而导致发病,还有观点认为,偏头痛发作时,血管痉挛导致的可逆性血-神经屏障功能障碍是其发病机制[20-21]。Laura Miglio等[21]认为,偏头痛、动眼神经麻痹、动眼神经根处增粗强化即可诊断OM。该病是一种自限性疾病,可自发缓解,也可采用激素治疗,且能较快缓解症状[4]。
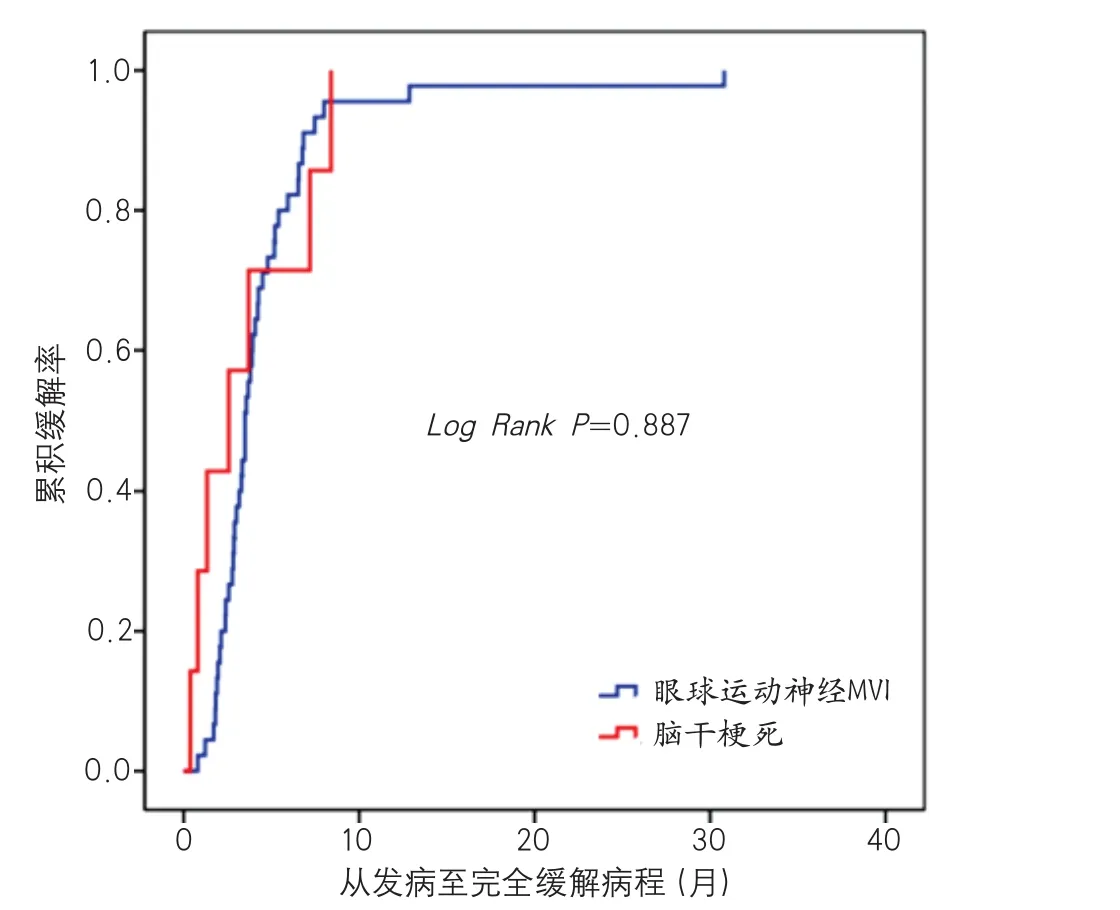
图1 眼球运动神经MVI与脑干梗死预后比较的Kaplan-Meier曲线图

图2 三种眼球运动神经MVI预后比较的Kaplan-Meier曲线图
研究显示,90%的MVI患者可在6个月内完全缓解,而且受累神经不同,恢复期长短不一,如81.8%的动眼神经麻痹患者多在起病3个月内缓解,而90%的滑车神经和60%外展神经麻痹患者会在发病后9个月内恢复[2]。本研究结果提示外展神经MVI病变预后较好,滑车神经MVI病变预后略差,但无论哪种眼球运动神经MVI病变,大部分患者可在起病6个月内恢复。
本研究为回顾性分析,在之后的研究中应进行前瞻性的试验对本研究结果进行验证。
[1] GRECO D,GAMBINA F,MAGGIO F.Ophthalmoplegia in diabetes mellitus:a retrospective study[J]. Acta Diabetol,2009,46(1):23-26.
[2] AKAGI T,MIYAMOTO K,KASHII S,et al.Cause and prognosis of neurologically isolated third,fourth,or sixth cranial nerve dysfunction in cases of oculomotor palsy[J]. Jpn J Ophthalmol,2008,52(1):32-35.
[3] PATEL S V,HOLMES J M,HODGE D O,et al.Diabetes and hypertension in isolated sixth nerve palsy[J]. Ophthalmology,2005,112(3):760-763.
[4] HUNG C H,CHANG K H,CHU C C,et al. Painful ophthalmoplegia with normal cranial imaging[J/OL]. BMC Neurol. 2014,14:7. https://doi.org/10.1186/1471-2377-14-7
[5] AI KAHTANI ES,KHANDEKAR R,AI RUBEAAN K,et al. Assessment of the prevalence and risk factors of ophthalmoplegia among diabetic patients in a large national diabetes registry cohort[J/OL]. BMC Ophthalmol. 2016,16:118. https://doi.org/10.1186/s12886-016-0272-7
[6] WILKER S C,RUCKER J C,NEWMAN N J,et al.Pain in ischaemic ocular motor cranial nerve palsies[J].Br J Ophthalmol. 2009,93(12):1657-1659.
[7] TRIGLER L,SIATKOWSKI R M,OSTER A S,et al. Retinopathy in patients with diabetic ophthalmoplegia[J]. Ophthalmology,2003,110(8):1545-1550.
[8] LANZINO G,ANDREOLI A,TOGNETTI F,et al. Orbital pain and unruptured carotid-posterior communicating artery aneurysms:the role of sensory fi bers of the third cranial nerve[J]. Arch Neurochir,1993,120(1-2):7-11.
[9] BORTOLAMI R,D’ALESSANDRO R,MANNI E. The origin of pain in ‘ischemic-diabetic’ third nerve palsy[J]. Arch Neurol,1993,50(8):795.
[10] DANIEL M. Pupil involvement in patients with diabetes-associated oculomotor nerve palsy[J]. Arch Ophthalmol,1998,116(6):723-727.
[11] 刘嵋,张金辉. 糖尿病性神经病变的药物治疗现状[J].中华内分泌代谢杂志,1996,12(1):37.
[12] THÖMKE F,GUTMANN L,STOETER P,et al. Cerebrovascular brainstem diseases with isolated cranial nerve palsies[J]. Cerebrovasc Dis,2002,13(3):147-155.
[13] VIRGO J D,PLANT G T. Internuclear ophthalmoplegia[J]. Pract Neuro,2017 17(2):149-153.
[14] KIM J S. Internuclear ophthalmoplegia as an isolated or predominant symptom of brainstem infarction[J].Neurology,2004,62(9):1491-1496.
[15] FÖRDERREUTHER S,RUSCHEWEYH R. From ophthalmoplegic migraine to cranial neuropathy[J].Curr Pain Headache Rep,2015,19(6):21.
[16] TAKIZAWA T,SHIBATA M,FUJIWARA H,et al. Adult-onset recurrent painful ophthalmoplegic neuropathy displaying atypical oculomotor nerve gadolinium-enhancement pattern in the orbit and cavernous sinus[J]. Cephalalgia,2016,36(2):199-200.
[17] LAL V,SAHOTA P,SINGH P,et al.Ophthalmoplegia with migraine in adults:Is it ophthalmoplegic migraine?[J]. Headache,2009,49(6):838-850.
[18] NUMAO F,SUZUKI K,WATANABE Y,et al. A 56-year old woman with adult-onset ophthalmoplegic migraine presenting with recurrent bilateral abducens nerve palsy[J]. Clin Neurol,2012,52(4):239-244.
[19] LANE R,DAVIES P. Ophthalmoplegic migraine:the case for reclassi fi cation[J]. Cephalalgia,2010,30(6):655-661.
[20] DUBEY R,CHAKRABARTY B,SAINI L,et al.Bilateral ophthalmoplegia in a child with migraine[J].Brain Dev,2016,38(5):525-528.
[21] MIGLIO L,FERACO P,TANI G,et al. Computed tomography and magnetic resonance imaging fi ndings in ophthalmoplegic migraine[J]. Pediatr Neurol,2010,42(6):434-436.
