葛根素对小鼠脑缺血再灌注损伤的神经保护作用及机制研究
2018-02-09姜辰杨浩鹏
姜辰,杨浩鹏
缺血性脑血管病严重危害人类的生命安全健康,目前仍缺乏行之有效的治疗手段[1]。近年来,脑缺血再灌注损伤的分子机制被广泛研究,研究证实雌激素对于缺血性脑损伤有神经保护作用,流行病学上表现为中青年女性比同龄男性的卒中发生率更低[2-3]。在缺血再灌注损伤中,雌激素受体(estrogen receptor,ER)的表达异常与缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)相互作用,激活如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(Interleukin-1β,IL-1β)和白细胞介素6(Interleukin-6,IL-6)等炎性细胞因子,从而导致细胞的级联性损伤[4-6]。有研究表明葛根素对局灶性脑缺血诱导的神经细胞损伤有一定保护作用,其在临床中治疗缺血性卒中的作用亦有文献支持[7-8]。本研究采用线栓法建立小鼠局灶性脑缺血再灌注模型,观察葛根素对ER-α与HIF-1α的表达及下游炎性因子如TNF-α、IL-1β、IL-6的影响,探讨葛根素对脑缺血再灌注损伤的神经保护潜在机制。
1 材料与方法
1.1 动物与实验试剂 健康成年雌性C57BL小鼠180只,体重20~25 g,清洁级,由扬州大学比较医学中心提供。葛根素注射液由浙江康恩贝制药股份有限公司提供,使用时根据剂量用注射用生理盐水(中国大冢制药有限公司)稀释。2,3,5-三苯基四唑氮红(2,3,5-triphenyltetrazolium chloride,TTC)(上海灵锦精细化工有限公司);总蛋白提取试剂盒(碧云天生物技术研究所);牛血清白蛋白(BSA,碧云天生物技术研究所);特超敏化学发光(enhanced chemiluminescence,ECL)试剂盒(碧云天生物技术研究所)。实验所用抗体均购买于Santa Cruz Biotechnology;所用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒均购买于南京建成生物工程研究所。
1.2 动物分组及给药
1.2.1 葛根素对脑缺血再灌注损伤的神经保护作用 取雌性C57BL小鼠60只,按体重大小编号后随机分为假手术组、溶剂对照组、葛根素低剂量组(100 mg·kg-1)、中剂量组(250 mg·kg-1)和高剂量组(500 mg·kg-1),每组12只,神经功能评分后6只用于测定脑梗死体积,6只用于测定脑含水量。对溶剂对照组与葛根素高、中、低剂量组采用线栓法制备缺血2 h再灌注24 h局灶性脑缺血模型。葛根素各剂量组给药体积均为0.01 ml·g-1,假手术组和溶剂对照组均给予等体积的生理盐水,所有实验组于手术前30 min腹腔预防性给药。
1.2.2 脑缺血再灌注损伤后ER-α和HIF-1α动态表达的时程变化 取雌性C57BL小鼠60只,按体重大小编号后随机分为假手术组、再灌注2 h组、再灌注6 h组、再灌注12 h组、再灌注24 h组,每组12只,其中6只无任何给药,另6只于手术前30 min腹腔注射0.01 ml·g-1生理盐水作为溶剂对照。对所有再灌注组均缺血2 h后方进行再灌注,从而建立不同再灌注时长的局灶性脑缺血再灌注模型。并在手术结束后取脑组织提取蛋白,测定ER-α和HIF-1α蛋白动态表达水平。
1.2.3 葛根素对脑缺血再灌注损伤后ER-α、HIF-1α表达及炎症因子释放的调节作用 取雌性C57BL小鼠60只,按体重大小编号后随机分为假手术组、溶剂对照组、葛根素低剂量组(100 mg·kg-1)、中剂量组(250 mg·kg-1)和高剂量组(500 mg·kg-1),每组12只,其中6只用于测定ER-α、HIF-1α表达水平,6只用于测定炎症因子TNF-α、IL-1β和IL-6的释放。对溶剂对照组与葛根素高、中、低剂量组采用线栓法制备缺血2 h再灌注12 h局灶性脑缺血模型。葛根素各剂量组给药体积均为0.01 ml·g-1,假手术组和溶剂对照组均给予等体积的生理盐水,所有实验组于手术前30 min腹腔预防性给药。
1.3 实验方法
1.3.1 局灶性脑缺血再灌注模型的建立及神经功能评分 采用线栓法制备小鼠右侧大脑中动脉缺血再灌注模型[9]。主要步骤为分离并暴露小鼠右侧颈总动脉、颈外动脉及颈内动脉,由远端颈外动脉插入制备好的线栓进入颈内动脉造成大脑中动脉闭塞从而缺血。2 h后拔除线栓实施再灌注。假手术组仅分离颈总动脉。
小鼠于缺血2 h再灌注24 h后进行神经功能评分,评分参考Longa评分法:0分:无神经功能缺损;1分:瘫痪侧前爪不能完全伸展;2分:行走时向瘫痪侧转圈;3分:行走时向瘫痪侧倾倒;4分:不能自发行走。
1.3.2 脑梗死体积与脑含水量的测定 小鼠于缺血2 h再灌注24 h后断头、取脑、冷冻后进行冠状切片,将脑片置于2%的TTC溶液中,37℃避光孵育约30 min后取出观察,正常脑组织染为红色,脑梗死区不着色。染色脑片置于10%中性甲醛中固定,扫描拍照后应用图像分析系统测量脑梗死面积。根据公式V=t×(A1+A2+…+An)算出梗死体积V。其中t为切片厚度,A为每个切片单侧梗死面积,n为单个鼠脑的切片数。本实验中t=2 mm,n=5。梗死体积百分比(%)=(梗死体积/对侧半球体积)×100%。
小鼠于缺血2 h再灌注24 h后断头、取缺血侧脑并称出湿重。将脑组织放入105℃烤箱内烘干24 h后称出干重。脑含水量=[(湿重-干重)/湿重]×100%。
1.3.3 蛋白质免疫印迹法检测ER-α与HIF-1α表达 蛋白质免疫印迹法(Western blot)实验步骤:取小鼠缺血侧皮层组织0.1 g,按总蛋白提取试剂盒说明书提取蛋白,并采用Bradford法测定含量。按30 μg蛋白量上样进行SDS-聚丙烯酰胺凝胶电泳。湿法转膜,200 mA恒流转膜2 h。放入5% BSA-TBST封闭液中封闭1.5 h后分别加入一抗(兔抗小鼠ER-α抗体,1∶500;兔抗小鼠HIF-1α抗体,1∶800;兔抗小鼠β-actin抗体1∶2500),4℃摇床过夜。而后加入二抗(山羊抗兔,1∶5000)室温下孵育1 h,两次抗体孵育后均用TBST洗膜3次,每次10 min。最后进行显色并用凝胶图像处理系统分析目标条带。
1.3.4 酶联免疫吸附法检测TNF-α、IL-1β和IL-6含量 按照ELISA试剂盒说明书进行操作,设标准孔8孔建立相应TNF-α、IL-1β和IL-6的标准曲线,取缺血侧脑组织匀浆液离心后的上清液,以不同浓度稀释后按加样-甩干-孵育生物素标记抗体工作液-甩干-洗板-孵育辣根过氧化物酶标记亲和素工作液-甩干-洗板-显色-读板的顺序,于酶标仪450 nm波长处测各孔吸光度OD450,根据样品OD450在相应标准曲线的位置计算出样品中TNF-α、IL-1β和IL-6含量,并根据组织裂解液浓度计算出每克脑组织中所含细胞因子的微克数(μg·g-1)。
1.4 统计分析 实验数据采用SPSS 17.0统计软件进行分析,计数数据用表示。两组间进行组间t检验;3组及3组以上采用单因素方差分析法,比较显示有整体差异后,两两比较采用Dunnett-t检验。统计学分析结果P<0.05认为有显著性差异。
2 结果
2.1 葛根素对脑缺血再灌注损伤后梗死体积、神经功能评分以及脑含水量的影响 TTC染色显示脑缺血梗死区域呈苍白色,溶剂对照组缺血2 h再灌注24 h后,脑梗死体积较手术组增加,差异有统计学意义。与溶剂对照组相比,低剂量(P=0.005)、中剂量(P<0.001)和高剂量(P<0.001)葛根素组均可降低再灌注24 h后脑梗死体积,差异有统计学意义(图1,表1)。
神经功能评分结果显示:与溶剂对照组相比,葛根素可改善小鼠缺血2 h再灌注24 h后的神经功能评分,但仅高剂量组与溶剂对照组评分差异有统计学意义(P=0.002)(表1)。
干湿重法测得缺血2 h再灌注24 h后脑组织含水量结果显示:假手术组脑含水量为(79.2±9.1)%,溶剂对照组缺血侧脑含水量为(85.3±10.2)%,与中剂量(P<0.001)、高剂量(P<0.001)葛根素组相比,差异具有统计学意义(表1)。
2.2 脑缺血再灌注损伤后ER-α和HIF-1α的表达与葛根素的调节作用 Western blot结果显示,局灶性脑缺血2 h后,随着再灌注时间的增加,相比于假手术组,手术组ER-α表达逐渐降低,HIF-1α表达逐渐升高,其中再灌注6 h、12 h、24 h三组差异具有统计学意义,均P<0.001,缺血2 h再灌注12 h ER-α和HIF-1α表达变化相比假手术组最为显著(图2)。
葛根素各剂量组均可改善局灶性脑缺血2 h再灌注12 h所诱导的ER-α表达下调及HIF-1α表达上调,其中中剂量组(P<0.001)、高剂量组(P<0.001)的改善作用具有统计学意义(图3)。
2.3 葛根素对脑缺血再灌注损伤后TNF-α、IL-1β和IL-6含量的影响 ELISA结果显示,缺血2 h再灌注12 h后,与假手术组相比,溶剂对照组脑组织中炎性细胞因子TNF-α、IL-1β和IL-6的含量升高,差异有统计学意义(表2)。葛根素各剂量组均可降低脑缺血再灌注损伤诱导的促炎细胞因子的表达,其中,中剂量组、高剂量组对TNF-α、IL-1β和IL-6均可显著性下调(中剂量组vs溶剂对照组TNF-α:P<0.001;高剂量vs溶剂对照组TNF-α:P<0.001;中剂量组vs溶剂对照组IL-1β:P<0.001;高剂量vs溶剂对照组IL-1β:P<0.001;中剂量组vs溶剂对照组IL-6:P=0.046;高剂量vs溶剂对照组IL-6:P=0.004)。与溶剂对照组相比,低剂量组仅显著性下调IL-1β(P=0.030)(表2)。
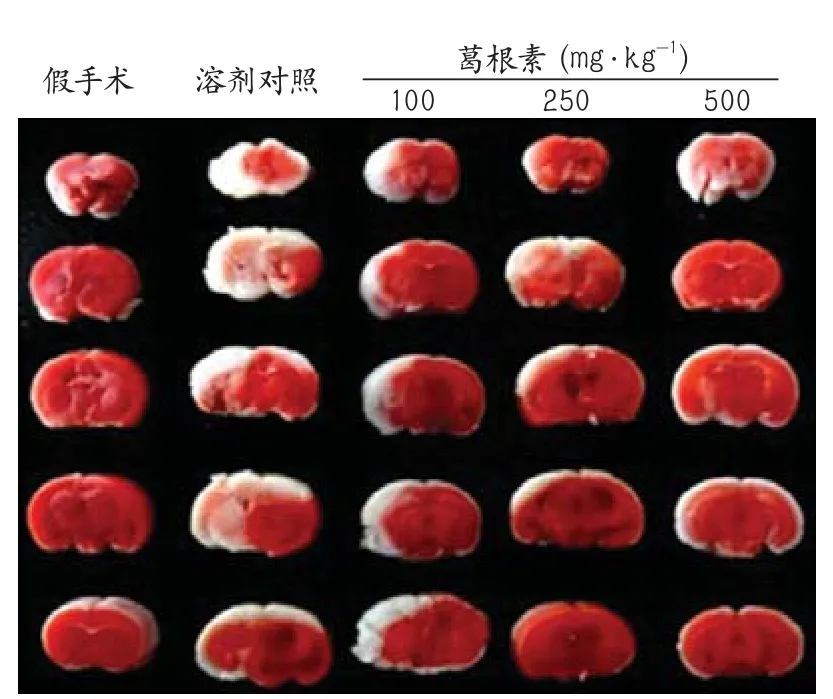
图1 脑缺血再灌注损伤后梗死体积示意图
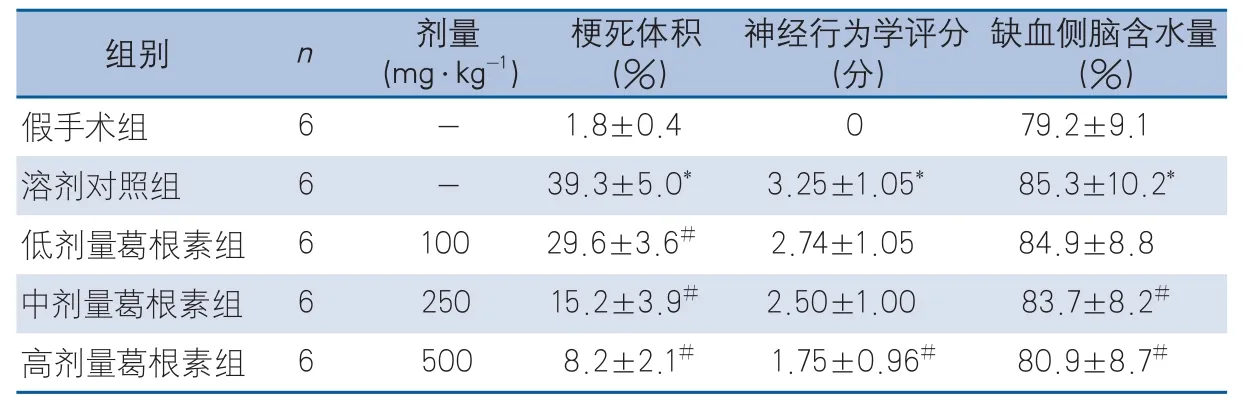
表1 各组小鼠脑梗死体积、神经行为学评分及缺血侧脑含水量的比较
3 讨论
缺血性卒中发病率高、致残率高、死亡率高。研究中药改善脑缺血再灌注损伤的作用机制,可为临床上缺血性卒中造成的神经损伤防治提供新的策略,对有效预防和治疗脑血管疾病、降低脑血管疾病的致死率具有重要意义。
葛根素作为豆科植物葛根中提取的一种黄酮苷,是葛根治疗心脑血管疾病的物质基础之一。现代研究表明,通过雌激素样作用,葛根素可降低去势雌性大鼠脑梗死体积,保护脑缺血半暗带神经元[10-11]。相关机制研究显示,葛根素的神经保护作用主要体现为阻止局部炎症诱发的级联反应并抑制神经细胞凋亡,但其作用机制与雌激素样作用的联系尚未明确[12]。
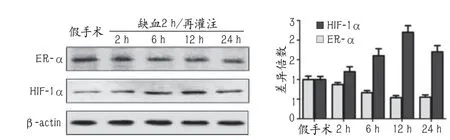
图2 脑缺血再灌注损伤后ER-α和HIF-1α的动态表达

图3 葛根素对脑缺血再灌注损伤后ER-α和HIF-1α表达的影响
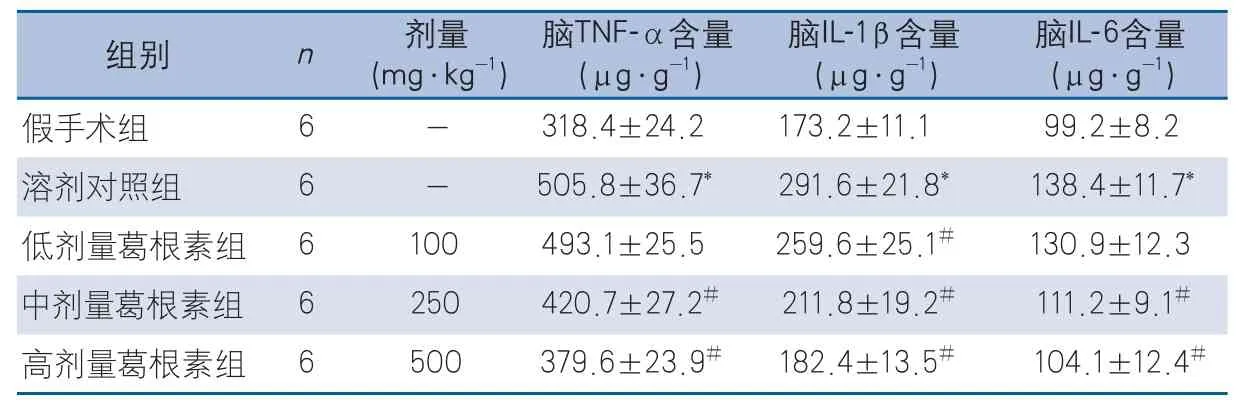
表2 各组小鼠脑组织TNF-α、IL-1β以及IL-6的比较
2016年心脏病与卒中统计数据显示,女性在青壮年时期(绝经前)的卒中发病率低于同龄男性,而在中老年时期(绝经后)的卒中发病率与死亡率均高于同龄男性,提示雌激素水平的变化影响女性卒中的发生发展[3]。有研究表明,雌激素本身即具有一定的神经保护机制,如抗炎作用、抗氧化作用、扩充脑血管并影响其自主功能调节作用[13]。除抗氧化作用以外,雌激素的神经保护机制大多通过与ER结合并进一步激活下游相关信号通路从而调节基因转录与蛋白活性,如雌激素可激活营养剥夺的PC12细胞的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,类雌激素他莫昔芬可激活海马区神经元的抗凋亡通路[14]。
ER是经典的核受体,主要包括ER-α和ER-β,主要分布在细胞核,通过与雌激素或其类似物特异性结合后形成激素-受体复合物,调节生物体内特异性靶基因的转录。ER在中枢神经系统细胞如神经元、星型胶质细胞、小胶质细胞中广泛存在,参与学习记忆、认知、运动等功能调节[15]。ER-α抑制剂已被报道可通过调节水通道蛋白4(aquaporins 4,AQP4)加重缺血再灌注后的脑损伤,同时ER-α缺陷型小鼠相比野生型小鼠在雌激素对脑缺血损伤的保护作用方面也被发现明显减弱,显示ER对脑缺血再灌注损伤中的保护作用[14]。在乳腺癌的研究中发现,ER的区域性表达下降与缺氧诱导的HIF-1α上调密切相关[16]。HIF-1α作为缺血、缺氧环境中的重要信号分子,对缺血缺氧环境中细胞的能量代谢、血管收缩控制、血管生成以及细胞凋亡等方面均具有重要的作用[17]。在改善炎症方面,HIF-1α不仅可以调节参与炎症反应的重要分子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、一氧化氮,同时在影响炎症细胞因子的释放以及调节免疫应答方面也发挥重要作用[18]。
众所周知,炎症因子的释放在缺血性卒中后期的级联损伤中尤为关键,因此,本研究从葛根素的雌激素样作用出发,通过考察其对ER与HIF-1α的作用进一步延伸至对炎症细胞因子释放的影响,从而评价葛根素防治缺血性卒中的药效并研究相关机制。实验结果表明,葛根素可在脑缺血再灌注条件下同步激活ER并降低HIF-1α表达,抑制炎症细胞因子TNF-α、IL-1β、IL-6等的释放,改善神经炎症。由此可以推测,葛根素对脑缺血再灌注损伤的神经保护作用机制可能与调节ER和HIF-1α的表达及抑制下游炎症因子的释放有关。
本研究是基于小鼠缺血再灌注模型的基础研究,仅探讨了短期(24 h内)葛根素对ER、HIF-1及相关炎症因子释放的影响,因此具有一定的局限性。后期将针对葛根素对缺血性卒中更长期的影响进行研究和探索。
[1] HU X,DE SILVA T M,CHEN J,et al. Genetic cerebral vascular disease and neurovascular injury in ischemic stroke[J]. Circ Res,2017,120(3):449-471.
[2] JOVER-MENGUAL T,CASTELLÓ-RUIZ M,BURGUETE M C,et al. Molecular mechanisms mediating the neuroprotective role of the selective estrogen receptor modulator,bazedoxifene,in acute ischemic stroke:A comparative study with 17β-estradiol[J/OL]. J Steroid Biochem Mol Biol,2017,171:296-304. https://doi.org/10.1016/j.jsbmb.2017.05.001.
[3] MOZAFFARIAN D,BENJAMIN E,GO A S,et al. Executive summary:heart disease and stroke Statistics-2016 update[J]. Circulation. 2016,133(4):447-454.
[4] SHIN J A,YOON J C,KIM M,et al. Activation of classical estrogen receptor subtypes reduces tight junction disruption of brain endothelial cells under ischemia/reperfusion injury[J/OL]. Free Radic Biol Med,2016,92:78-89. https://doi.org/10.1016/j.freeradbiomed.2016.01.010.
[5] YAMAGUCHI R,KAMIYA N,ADAPALA N S,et al. HIF-1-dependent IL-6 activation in articular chondrocytes initiating synovitis in femoral head ischemic osteonecrosis[J]. J Bone Joint Surg Am,2016,98(13):1122-1131.
[6] BALAMURUGAN K. HIF-1 at the crossroads of hypoxia,in fl ammation,and cancer[J]. Int J Cancer.2016,138(5):1058-1066.
[7] HONGYUN H,TAO G,PENGYUE Z,et al.Puerarin provides a neuroprotection against transient cerebral ischemia by attenuating autophagy at the ischemic penumbra in neurons but not in astrocytes[J/OL]. Neurosci Lett,2017,643:45-51. https://doi.org/10.1016/j.neulet.2017.02.009.
[8] ZHENG Q H,LI X L,MEI Z G,et al. Ef fi cacy and safety of puerarin injection in curing acute ischemic stroke:A meta-analysis of randomized controlled trials[J]. Medicine(Baltimore),2017,96(1):e5803.
[9] LONGA E Z,WEINSTEIN P R,CARLSON S,et al. Reversible middle cerebral artery occlusion without craniotomy in rats[J]. Stroke,1989,20(1):84-91.
[10] 么晓轶,李颖. 植物雌激素对去势雌性大鼠缺血性脑损伤的神经保护作用[J]. 中国神经免疫学和神经病学杂志,2005,12(3):160-163.
[11] 宋宏杉,何可立,汪建民,等. 葛根素对大鼠局灶性脑缺血后雌激素受体α阳性神经元变化的影响[J]. 时珍国医国药,2007,18(1):127-129.
[12] JIANG M,YUN Q,NIU G,et al. Puerarin prevents in fl ammation and apoptosis in the neurocytes of a murine Parkinson’s disease model[J]. Genet Mol Res,2016,15(4):1-9.
[13] 刘照寒,曲松滨. 雌激素与女性缺血性脑卒中[J]. 现代生物医学进展,2012,12(3):195-197.
[14] 张志春,邹萍,黄亮,等. 雌激素受体在脑内的表达与缺血再灌注损伤[J]. 生物技术通讯,2015,26(4):583-586.
[15] RUDOLPH L M,CORNIL C A,MITTELMANSMITH M A,et al. Actions of Steroids:New Neurotransmitters[J]. J Neurosci. 2016,36(45):11449-11458.
[16] ENDLER A,CHEN L,ZHANG J,et al. Binding of the ERα and ARNT1 AF2 domains to exon 21 of the SRC1 isoform SRC1e is essential for estrogen-and dioxin-related transcription[J]. J Cell Sci,2012,125(Pt 8):2004-2016.
[17] KASIVISVANATHAN V,SHALHOUB J,LIM C S,et al. Hypoxia-inducible factor-1 in arterial disease:a putative therapeutic target[J]. Curr Vasc Pharmacol.2011,9(3):333-349.
[18] DEHNE N,BRÜNE B. HIF-1 in the in fl ammatory microenvironment[J]. Exp Cell Res,2009,315(11):1791-1797.
